CD73與調節性T細胞在非小細胞肺癌中的表達及其臨床意義
高鋒 陳麗秀 朱于娟 陳敏潔 許梅杰 張潔如 錢文霞
由于煙草、大氣污染等因素的影響,近年來肺癌的發病率顯著上升,GLOBOCAN2018報告顯示:2018年全球肺癌新發病例約209萬,死亡約176萬,占惡性腫瘤新發病例及死亡病例的11.6%及18.4%,位居惡性腫瘤之首[1]。深入了解肺癌的發生、發展機制,對指導臨床治療、改善肺癌患者生存率具有重要價值。CD73,即5′胞外核苷酸酶,是參與胞外腺苷酸轉化為腺苷的生物學過程的關鍵酶,是腫瘤微環境中的免疫抑制因子,在腫瘤的免疫逃逸、侵襲轉移有重要意義[2]。調節性T細胞(regulatory T cells,Treg)是具有獨特免疫調節功能的T細胞亞群,參與腫瘤的免疫逃逸、促進腫瘤的發展,發現其與多種惡性腫瘤相關,如胃癌、胰腺癌等[3],叉頭狀核轉錄因子(Foxp3)在Treg細胞呈特異性表達,通過檢測Foxp3表達可以有效提示Treg細胞數量。本研究旨在通過采用免疫組化SP法分析CD73與Foxp3+Treg細胞在非小細胞肺癌中的表達,了解非小細胞肺癌浸潤與轉移過程中的可能機制,以期能形成新的腫瘤標志物,更好的監測非小細胞肺癌進展與判斷預后。
資料與方法
一、臨床資料
本研究選取2012年01月至2013年12月術后經病理證實為非小細胞肺癌組織標本70例,10例癌旁正常肺組織設為對照組,入組患者無其他惡性腫瘤及術后化療病史。其中女性32例,男性38例,平均年齡 63.18±7.59歲,鱗癌33例,腺癌37例,低分化27例,中高分化43例,有淋巴結轉移31例,參考第8版UICC TNM分期標準:Ⅰ期21例,Ⅱ期35例,Ⅲ期14例。該研究經由蘇州大學附屬張家港醫院倫理委員會同意。
二、主要實驗試劑
SP檢測試劑盒購自福州邁新公司,CD73、Foxp3兔抗人多克隆抗體購自武漢三鷹公司。
三、實驗方法
采用免疫組織化學SP法進行實驗檢測,實驗設置陰性對照(以PBS代替一抗)。所有標本均適當取材、及時固定、石蠟包埋,3um層厚完整切片,常規脫蠟及水化,EDTA抗原修復,過氧化酶溶液阻斷內源性過氧化酶活性,采用山羊血清封閉,加用一抗在4℃冰箱內孵育過夜,順序滴加生物素標記的二抗及鏈霉素抗生物素——過氧化酶溶液,DAB顯色,蘇木素復染,中性樹膠封閉,顯微鏡下觀察。
四、陽性結果判定
CD73染色結果參考Al-Shibli[4]標準。以肺癌細胞細胞膜出現明顯染色的棕黃色顆粒為陽性,觀察五個高倍視野(×400倍),根據陽性細胞率計分:0分為陰性,1分為陽性細胞≤10%,2分為陽性細胞11%~50%,3分為陽性細胞51~75%為3分,4分為陽性細胞>75%;根據細胞染色強度評分:無色0分,淺黃色1分,棕黃色2分,棕褐色3分,陽性細胞率與染色強度乘積在3分以上為陽性。Foxp3定位于細胞核,呈棕黃色顆粒,隨機觀察每張切片的五個高倍鏡視野,計算陽性細胞百分比及平均值,將陽性細胞百分比<5%定為表達陰性,≥5%定為表達陽性。
五、隨訪
70病例均有完整的隨訪資料,采用電話形式進行隨訪。隨訪截止日期為2018年12月。生存期的計算從手術日期至隨訪截止日期或死亡日期為止。
六、統計學分析
采用SPSS 20統計軟件對數據進行統計學分析。計數資料采用率表示,采用卡方檢驗分析CD73與Treg細胞在不同肺組織的表達及其與臨床病理特征的關系,相關性檢驗采用Spearman相關分析。采用 Kaplan-Meier分析CD73、Treg細胞與生存期的關系,Cox回歸多因素生存分析。以P<0.05為差異有統計學意義。
結 果
一、CD73在不同肺組織中的表達
CD73在非小細胞肺癌中表達分布和陽性顆粒沉淀位置主要是以胞膜型為主,根據陽性染色細胞比例和染色強度將染色結果分為四個等級:強陽性、中等陽性、弱陽性、陰性,CD73在10例癌旁正常肺組織中無表達表達,陽性表達率為0%(0/10),CD73在70例腺癌及鱗癌中呈陽性表達率為73.7%(53/70),肺癌組與癌旁正常肺組織比較,CD73表達的差異具有統計學意義(P<0.01)(見表1,圖1~6)。
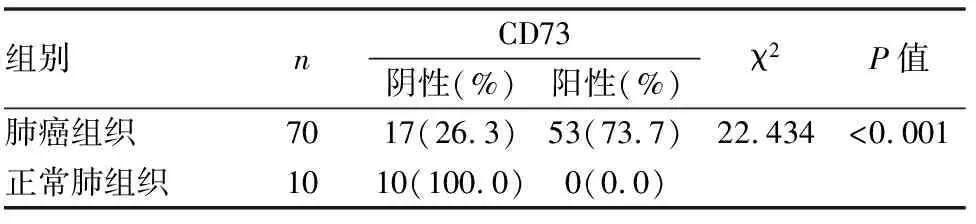
表1 CD73在不同肺組織中的表達
二、CD73的表達與臨床病理特征的關系
70例肺癌組織中,TNM分期高、存在淋巴結轉移者,其CD73陽性表達率明顯高,與CD73陰性表達者相比差異具有統計學意義(P<0.05),而CD73的表達與年齡、性別、吸煙史、腫瘤大小、組織學類型、分化程度無關(P>0.05)(見表2)。
三、Foxp3+Treg細胞在不同肺組織中的表達
Foxp3陽性表達呈棕黃色顆粒,定位于淋巴細胞細胞核,Foxp3標記的Treg細胞在10例癌旁正常肺組織中無表達表達或僅有微弱表達,陽性表達率為0%(0/10),而在70例肺癌間質內49例可見陽性浸潤表達,陽性表達率為70%(49/70),肺癌組與癌旁正常肺組織比較,Foxp3標記的Treg細胞浸潤分布的差異具有統計學意義(P<0.01)(見表3、圖7、8)。
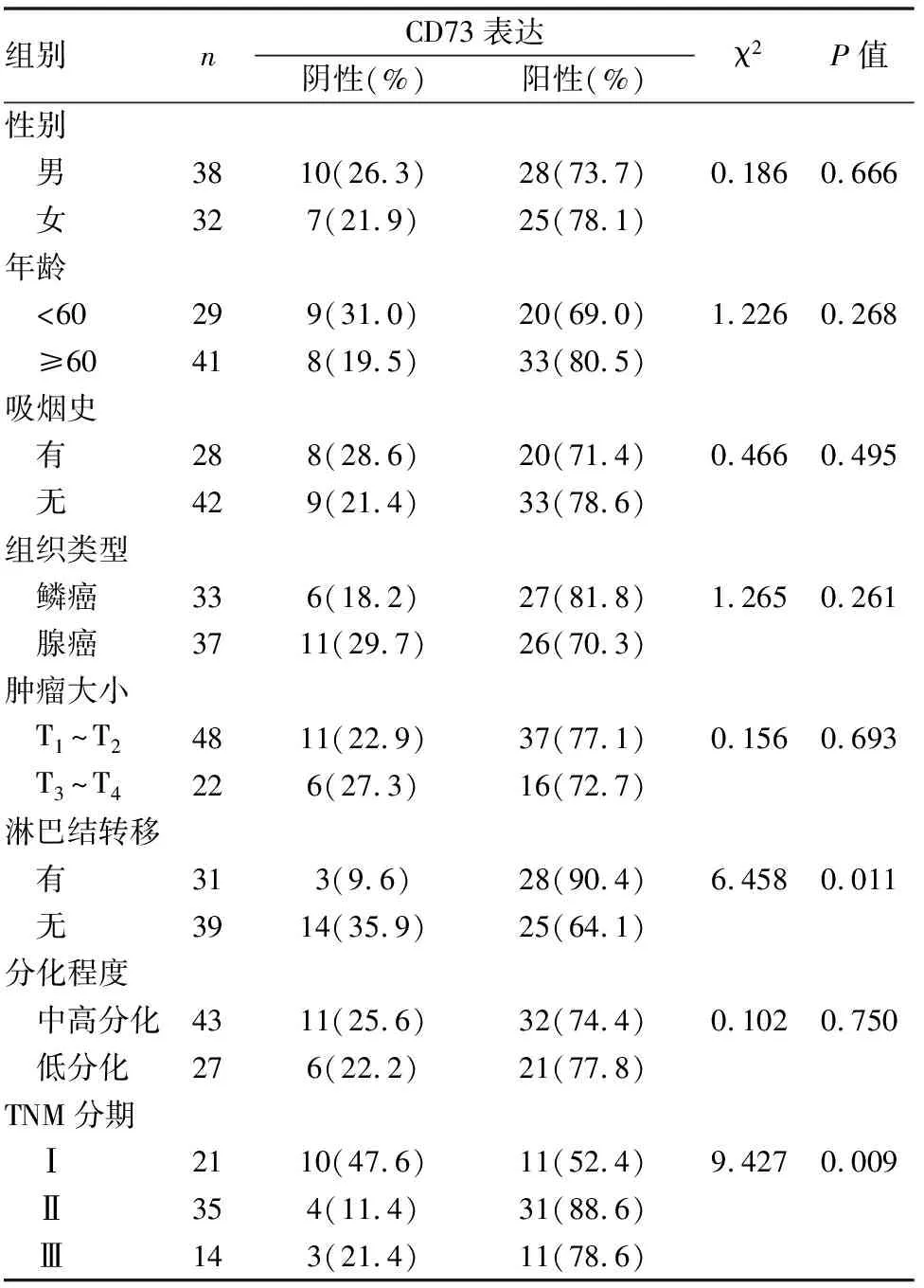
表2 CD73的表達與臨床病理特征的關系
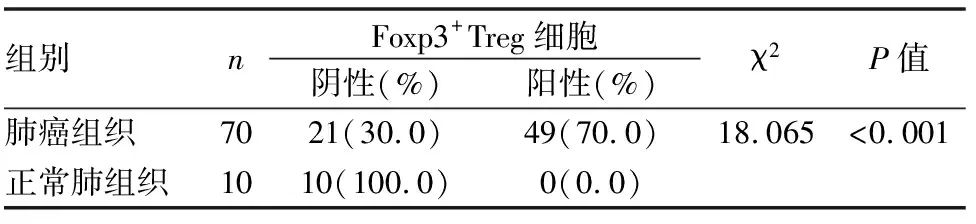
表3 Foxp3+Treg細胞在不同肺組織中的表達
四、Foxp3+Treg細胞與臨床病理特征的關系
70例肺癌組織中,TNM分期高與存在淋巴結轉移患者的Foxp3+Treg細胞在間質內的浸潤數量明顯增加,陽性表達率明顯升高,與Foxp3+Treg細胞陰性表達者相比差異具有統計學意義(P<0.05),而Foxp3+Treg細胞的表達與年齡、性別、吸煙史、腫瘤大小、組織學類型、分化程度無關(P>0.05)(見表4)。
五、CD73與Foxp3+Treg細胞表達相關性分析
70例肺癌組織中,CD73的陽性表達與Foxp3+Treg細胞在肺癌間質內的陽性浸潤呈正相關(r=0.284,P<0.05)(見表5)。
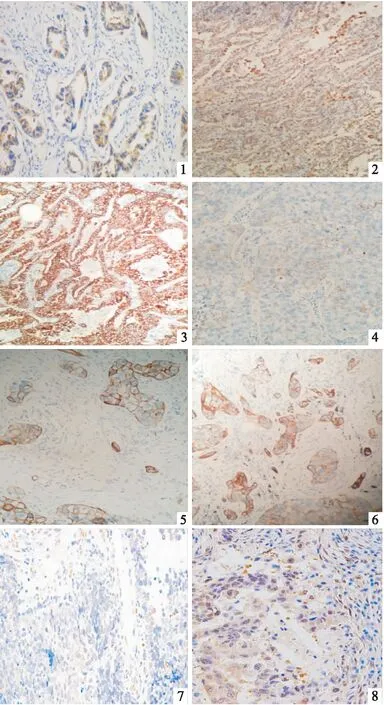
圖1 C達(×400) 圖2 CD73在肺腺癌中中等陽性表達(×100) 圖3 CD73在肺腺癌中強陽性表達(×100) 圖4 CD73在肺鱗癌中弱陽性表達(×400) 圖5 CD73在肺鱗癌中中等陽性表達(×400) 圖6 CD73在肺鱗癌中強陽性表達(×400) 圖7 Foxp3+Treg細胞在肺鱗癌中陽性表達(×200) 圖8 Foxp3+Treg細胞在肺腺癌中陽性表達(×200)
六、CD73與Foxp3+Treg細胞表達與預后的關系
Kaplan-Meier生存曲線分析提示在70例非小細胞肺癌中,CD73陰性表達組患者中位生存期(58.00±5.65月)明顯優于陽性表達組患者(32.00±1.55月),兩者差異具有統計學意義(P<0.01)。Foxp3+Treg細胞陰性表達組患者中位生存期(58.00±4.57月)與陽性表達組(32.00±1.16月)相比,差異亦具有統計學意義(P<0.01)。單因素分析提示患者預后與腫瘤大小、淋巴結轉移、腫瘤細胞分化程度、TNM分期、CD73與Foxp3+Treg細胞的陽性表達密切相關。Cox回歸多因素分析顯示淋巴結轉移、TNM分期、CD73與Foxp3+Treg細胞的陽性表達密切相關(P<0.05)。分析結果提示CD73與Foxp3+Treg細胞是判斷患者預后的獨立預測因子(見圖9、10、表6、7)。
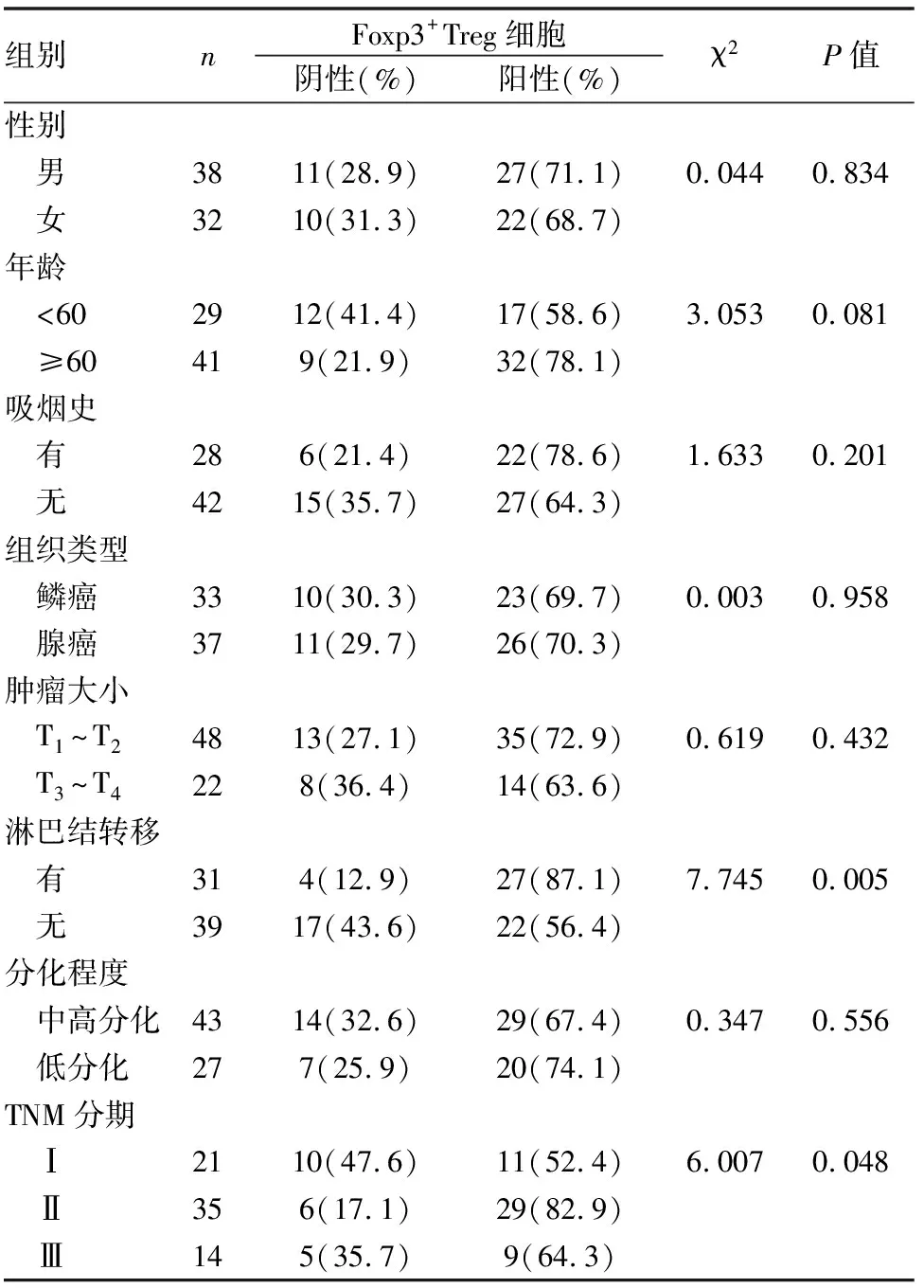
表4 Foxp3+Treg細胞的表達與臨床病理特征的關系

表5 CD73與Foxp3+Treg細胞表達的相關性
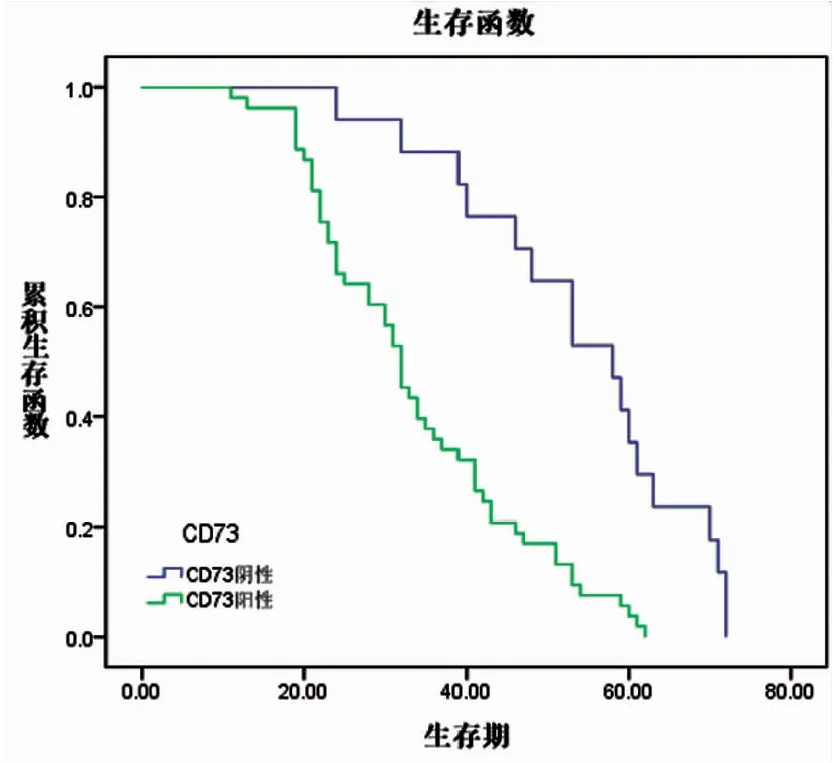
圖9 CD73與生存期
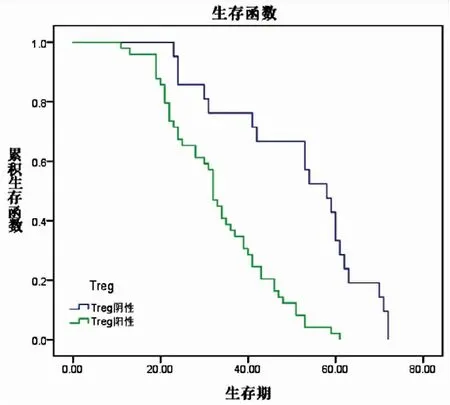
圖10 Foxp3+Treg細胞與生存期
討 論
肺癌是全球范圍內最常見的惡性腫瘤之一,具有高患病率及高死亡率的特點,嚴重威脅人類的生命健康,其中約85%為非小細胞肺癌(NSCLC)[5]。近年來,由于煙草、大氣污染等因素的影響,NSCLC的患病率和死亡率均呈上升趨勢,其治療也面臨著嚴峻的挑戰。由于NSCLC發病隱匿、早期缺乏典型癥狀且具有侵襲轉移力強、易復發等特點,多數患者確診時已錯過最佳治療時期,其5年的生存率僅為17%[6],因此探索NSCLC發生、發展機制對于指導患者早期診療、開發新的靶點治療以及改善患者預后具有十分重要的意義。
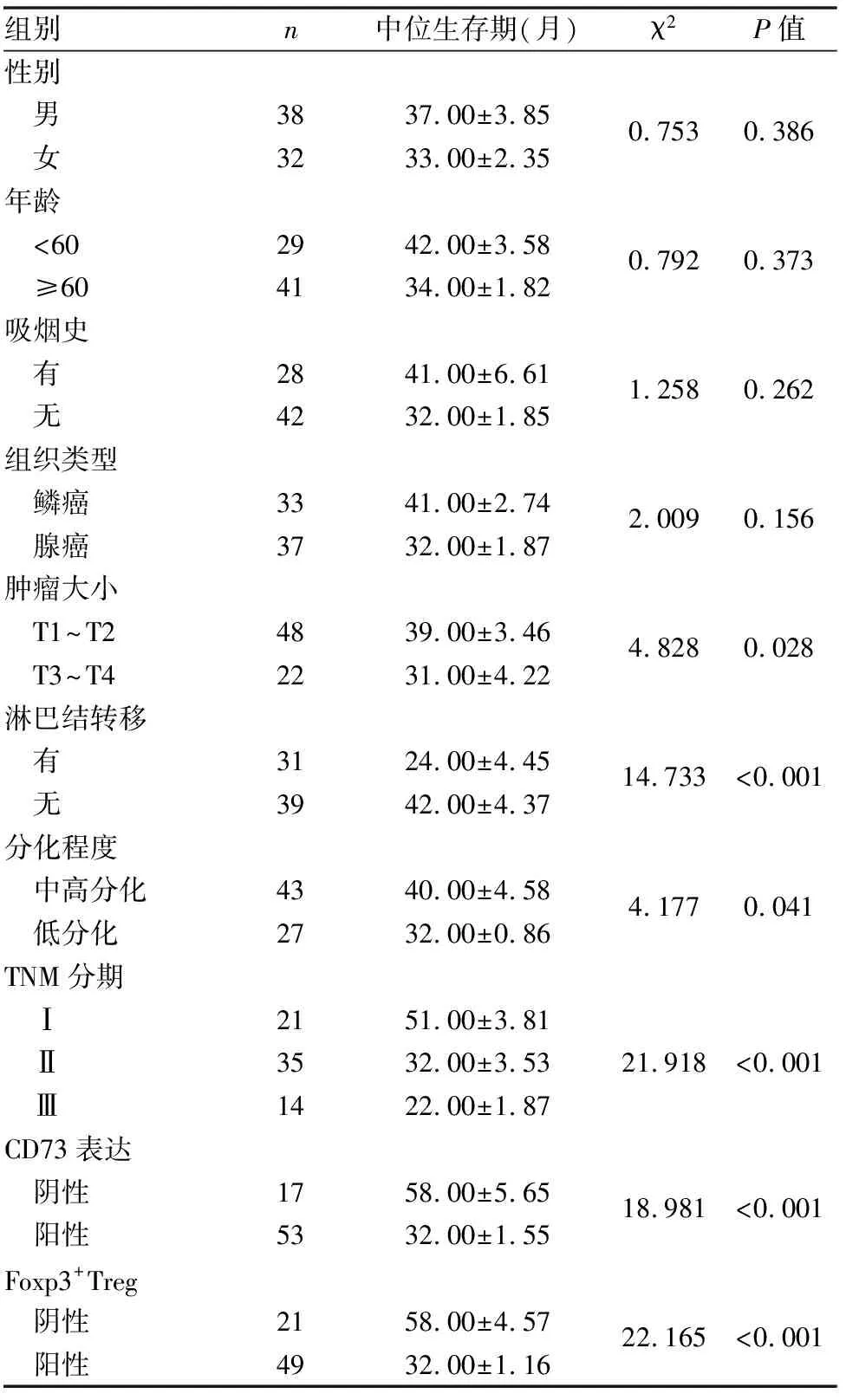
表6 非小細胞肺癌生存期相關因素單因素分析
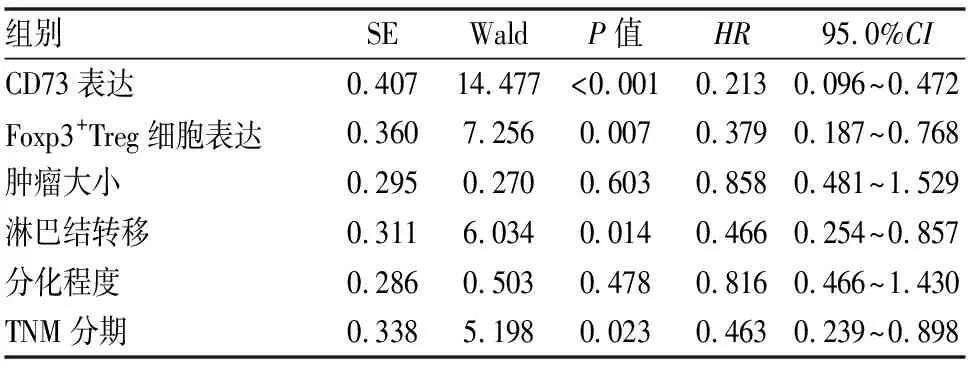
表7 非小細胞肺癌生存相關因素Cox回歸多因素分析
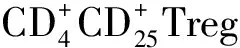
綜上所述,NSCLC的發生一個多種因素影響、多種環節參與的復雜過程,早期發現與診斷肺癌是改善患者預后的重要措施,通過本研究結果提示CD73、Foxp3+Treg細胞參與了NSCLC的進展過程,CD73、Foxp3+Treg細胞可能成為監測NSCLC病情變化的新型標志物及腫瘤防治的新突破口,形成肺癌精準治療的新途徑,從而有效改善患者預后。

