趨化因子CXCL4L1及其受體CXCR3在胰腺癌轉移中的作用機制
韓靜綺 張易青 冶俊玲 郭新建 王豐梅 (青海大學附屬醫院病理科,青海 西寧 810001)
CXC趨化因子配體(CXCL)4L1為血小板衍生的趨化因子CXCL4的同源物質〔1〕,CXCL4L1和CXCL4有34%的氨基酸序列不同,這種不同主要存在于編碼信號分子序列的C末端氨基酸序列。并且,當肽鏈進一步折疊成成熟的蛋白質后發現,兩種物質結構比對僅有4.3%的不同。相對于CXCL4來說,CXCL4L1具有更大的潛力抑制細胞的增殖和轉移〔2,3〕。通過移植肺癌細胞A549、小鼠肺癌細胞LLC和小鼠黑色素瘤細胞B16的裸鼠喂食重組CXCL4L1后,裸鼠的成瘤性降低〔4〕。雖然CXCL4L1和CXCL4的分泌與作用機制不同,但是這兩種細胞因子具有相似的功能。與CXCL4相比,CXCL4L1具有更低的多糖結合親和性,而且不論在體內還是體外研究中,CXCL4L1具有更好的擴散性。這些不同主要是由于單個氨基酸的不同所引起的〔5〕。CXCL4L1不僅在血小板巨核細胞家族中有表達,在免疫細胞和其他細胞中也可以表達,例如平滑肌細胞和上皮細胞。同時趨化因子受體CXCR3也在多種細胞中表達,包括免疫細胞,血管細胞和腫瘤細胞〔6,7〕。CXCR3具有多種異構體,包括CXCR3-A、CXCR3-B和CXCR3-alt。其中CXCR3-A主要在Th1-CD4+T細胞、CD8+T細胞和自然殺傷細胞中表達,并且表現為促進腫瘤發展的功能。CXCR3-B與CXCR3-A相比,具有一個氨基酸末端的延伸,主要具有抑制血管生成的作用〔8〕。有報道表明CXCL4L1通過和CXCR3-B相結合可以抑制角膜新生血管的發展,當用抗CXCR3-B的單克隆抗體作用于小鼠時,可以有效解除CXCL4L1對于角膜新生血管發展的抑制作用〔9,10〕。有研究已經報道關于外源性的CXCL4L1或者CXCL4L1的C末端片段在皮下腫瘤模型中的作用,但是有關它在腫瘤發展和轉移中的作用未做進一步分析。本文研究CXCL4L1和CXCR3的表達及二者在腫瘤轉移中的作用。
1 材料和方法
1.1實驗試劑 Hoechst33342,RNA提取試劑盒(美國,Thermo Scientific),DMEM培養液,血清(美國,gibco),兔抗人CXCL4L1抗體(ab97799),鼠抗人CXCR3抗體(ab64714),兔抗人GFP標記CXCR3抗體(ab71864),兔抗人藻紅蛋白(PE)標記CXCL4L1抗體(ab83123)(美國,Abcam),transwell小室(中國,碧云天)。
1.2細胞培養 人胰腺腺癌細胞BxPC3,胰腺導管癌細胞Panc-1和成肌纖維細胞(MF)C2C12購買于中國科學院上海細胞庫,培養于含10%胎牛血清(FBS)和雙抗的DMEM和MEM培養基中,放入5%CO2,37℃培養箱中培養。
1.3共培養 2×105胰腺腺癌細胞BxPC3接種于transwell小室的上層,3×105個MF接種于transwell小室的下層于6孔板中,添加20%FBS的DMEM培養基,培養24 h進行免疫熒光染色實驗。
1.4臨床樣本 胰腺癌早期患者20例,其中胰腺腺癌肺轉移患者10例,胰腺導管癌肺轉移患者10例(術前未經任何治療)。其中男8例,女12例,年齡60~85歲,平均年齡(68.32±5.31)歲。組織樣本(術后取下經液氮凍存)均經過病理證實。
1.5實驗方法
1.5.1RT-PCR 從Genbank數據庫中獲取目的基因CXCL4(Hs0090185_m1)和CXCL4L1(Hs99906_m1)的mRNA序列,引物由上海生工設計并合成。取對數期長勢良好胰腺腺癌細胞BxPC3和胰腺導管癌細胞Panc-1,消化計數后,以105個細胞每孔的數目接種于六孔板內,貼壁培養24 h。按照RNA提取試劑盒說明書提取RNA,并檢測RNA含量。將所得RNA逆轉錄為cDNA(42℃ 30 min,85℃ 5 min)。對樣品進行梯度稀釋,得到6個濃度的模板,冰上加樣SYBR Premix EX TapⅡ(10 μl),底漆混合物(1.6 μl),cDNA(1.5 μl),dH2O(6.9 μl)。離心,在Rt-PCR儀(Thermo,7900HT)上進行擴增,根據標準曲線,計算擴增效率。
1.5.2免疫熒光 BxPC3和經MF共培養的BxPC3細胞,胰腺腺癌細胞BxPC3和胰腺導管癌細胞Panc-1培養于24孔板中,待細胞長到80%左右開始進行熒光染色。用醋酸-乙醇固定液固定細胞,磷酸鹽緩沖液(PBS)搖床上漂洗5 min,分別加入Hoechst 33342工作液,GFP-CXCR3抗體(1∶500),PE-CXCL4L1抗體(1∶800)進行染色,室溫15 min,PBS漂洗3次,每次5 min,加入甘油與PBS(1∶9)的混合液,熒光顯微鏡(日本,Nikon,Ti-s)下觀察,熒光顯微鏡下拍片,采用ImagePlus 7.0 軟件對各組細胞中的熒光表達進行定量分析。
1.5.3免疫組化 制備胰腺癌早期患者組織樣本切片,在載玻片上將切片固定好之后進行干燥處理。在二甲苯(Ⅰ)(Ⅱ)中進行脫蠟,后置于100%的純酒精(Ⅰ)(Ⅱ)和梯度為95%、80%、70%的酒精和水中各5 min進行水化。水化完成后的片子置于3%的H2O2中,室溫孵育10 min,PBS洗滌3次。將片子置于檸檬酸緩沖液(0.01 mol/L,pH6.0)中加熱,待沸騰后改中火(92℃以上),室溫下復溫,PBS洗滌3次。吸干多余液體,滴加山羊血清封閉液,在37℃的溫度下孵育30 min。滴加異硫氰酸熒光素(FITC)-CXCR3抗體(1∶600)和PE-CXCL4L1抗體(1∶800),在4℃的溫度下過夜,取出后置于37℃烤箱中復溫30 min,用磷酸鹽吐溫緩沖溶液(PBST)洗3次。滴加生物素標記的羊抗兔IgG二抗,在37℃的溫度下孵育1 min,PBST洗滌3次。用3,3-二氨基聯苯胺(DAB)試劑盒進行顯色30 min,顯色終止后清洗切片。滴加蘇木素室溫染液3 min,清水沖洗,鹽酸酒精分化1 s,氨水返藍5 min。將片子分別放入70%、80%的酒精各1 min,90%的酒精2 min,95%的酒精3 min,100%的酒精(Ⅰ)(Ⅱ)各3 min。二甲苯(Ⅰ)(Ⅱ)中各放置15 min,晾干,中性樹膠封片。每個標本的陰性對照只滴加PBS液,在顯微鏡(CK30-F200,日本Olympus公司)下觀察。
1.6統計學方法 采用SPSS21.0行成組t檢驗。
2 結 果
2.1RT-PCR檢測CXCL4和CXCL4L1胰腺腺癌細胞BxPC3和胰腺導管癌細胞Panc-1中的表達 CXCL4在胰腺腺癌細胞BxPC3和胰腺導管癌細胞Panc-1中均有表達,其mRNA相對表達量分別為1.75±0.21、1.59±0.19,二者比較差異無統計學意義(t=1.384,P=0.196);CXCL4L1在胰腺導管癌細胞Panc-1中 mRNA相對表達量為(2.05±0.23),而在胰腺腺癌細胞BxPC3中幾乎不表達,mRNA相對表達量僅為(0.03±0.01),兩者比較差異具有統計學意義(t=4.237,P=0.032)。
2.2免疫熒光檢測CXCL4L1在BxPC3和經MF共培養的BxPC3細胞中的表達 圖1結果表明,CXCL4L1在胰腺腺癌細胞BxPC3中不表達,但在MF共培養的BxPC3細胞中高表達。BxPC3與培養的MF中CXCL4L1的相對熒光表達量為(27.80±0.43)%,與單獨BxPC3細胞培養的相對熒光表達量(1.07±0.02)%比較,差異有統計學意義(t=6.223,P=0.004)。
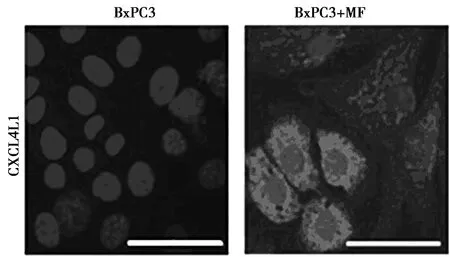
圖1 CXCL4L1在BxPC3和經MF共培養的BxPC3細胞中的表達(×200)
2.3免疫熒光檢測CXCR3在胰腺腺癌細胞BxPC3和胰腺導管癌細胞Panc-1中的表達 圖2結果表明,CXCR3在胰腺腺癌細胞BxPC3中幾乎不表達,相對熒光表達量為(1.03±0.02)%,在胰腺導管癌細胞Panc-1中高表達,相對熒光表達量為(15.73±0.52)%,差異有統計學意義(t=7.005,P=0.000)。
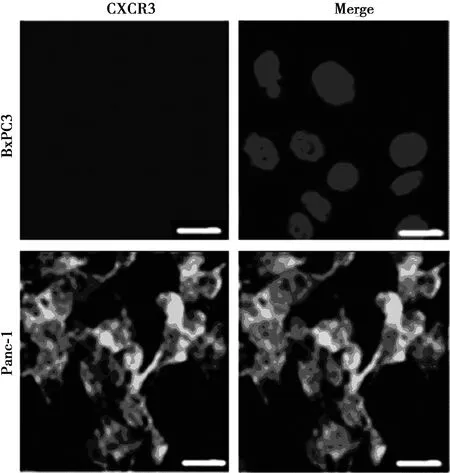
圖2 CXCR3在胰腺腺癌細胞BxPC3和胰腺導管癌細胞Panc-1中的表達(×400)
2.4免疫組化檢測CXCL4L1在胰腺癌組織和肺轉移的組織中的表達 胰腺腺癌原發腫瘤組織中CXCL4L1的陽性表達與肺轉移比差異無統計學意義(χ2=3.333,P=0.068);相比于胰腺導管癌原發腫瘤組織,CXCL4L1在肺轉移胰腺導管癌組織中高表達(χ2=5.051,P=0.025),見圖3和表1。
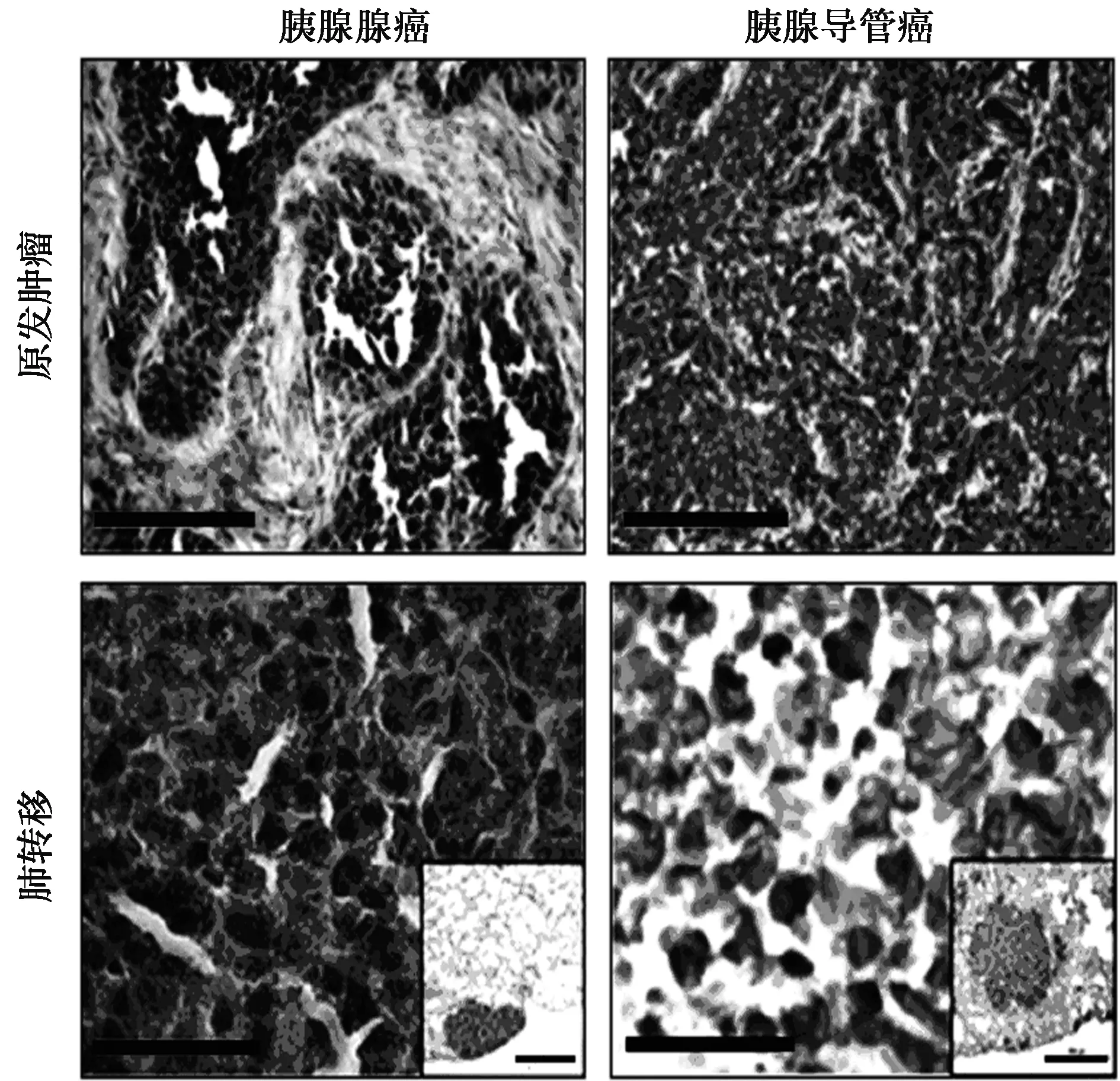
圖3 免疫組化檢測CXCL4L1在胰腺癌組織和肺轉移的組織中的表達(×400)
2.5免疫組化檢測CXCR3在胰腺癌組織和肺轉移的組織中的表達 在胰腺腺癌原發腫瘤組織中CXCR3不表達,而在肺轉移組織中CXCR3高表達(χ2=8.571,P=0.003)。在胰腺導管癌原發腫瘤組織中CXCR3低表達,而在肺轉移組織中CXCR3高表達(χ2=9.899,P=0.002)。見表2、圖4。
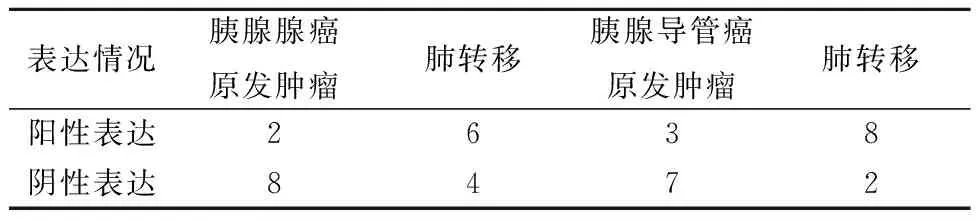
表1 CXCL4L1在胰腺癌組織中的表達情況(n,n=10)
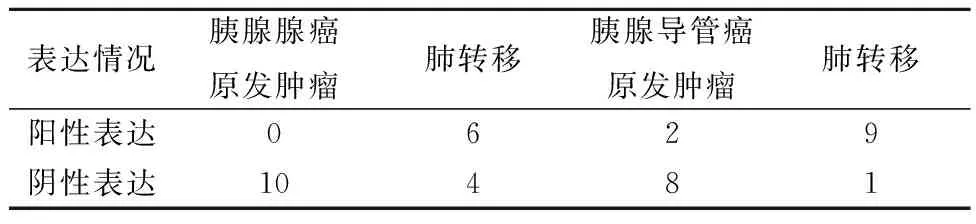
表2 CXCR3在胰腺癌組織中的表達情況(n,n=10)
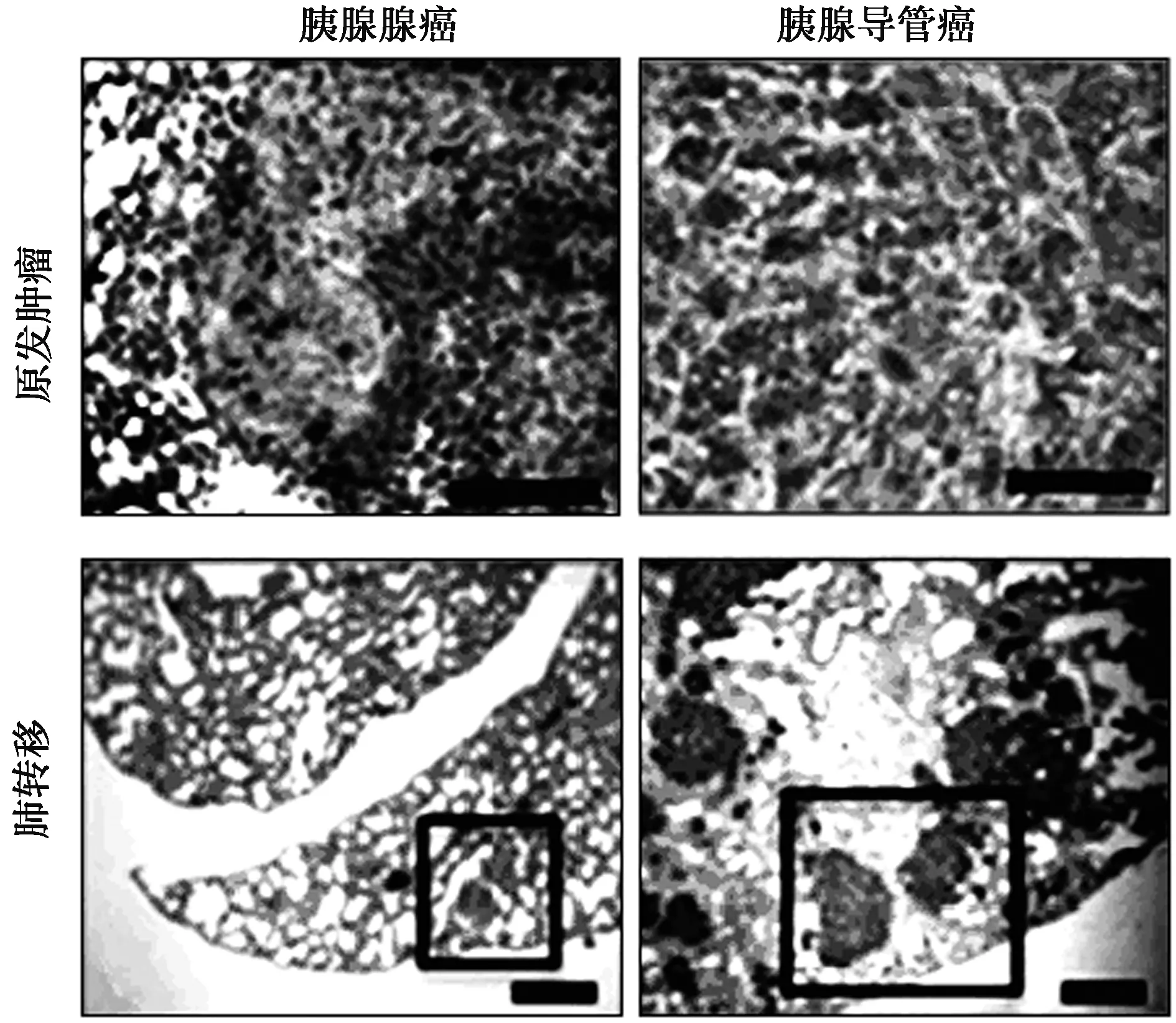
圖4 免疫組化檢測CXCR3在胰腺癌組織和肺轉移的組織中的表達(×200)
3 討 論
胰腺癌是全球第五大癌癥,其治愈率低,死亡率高〔11,12〕。根據胰腺癌的病理類型,胰腺癌可分為導管腺癌(導管腺癌占胰腺癌的80%~90%),腺鱗癌,腺泡細胞癌(僅占1%),小腺體癌(為少見類型的胰腺癌),小細胞癌(占胰腺癌的1%~3%)〔13,14〕。因此本文主要研究了常見的胰腺導管癌和胰腺腺癌。在胰腺癌細胞中,CXCL4L1和CXCL4的表達水平并不是完全一致的。例如,體外的胰腺癌細胞或者在腫瘤移植后的細胞BxPC3和Panc-1中,CXCL4L1的表達水平增加,而CXCL4的表達水平并沒有增加。CXCL4也許在人胰腺導管癌細胞系PDAC的病理學過程中可能起到重要作用,但其具體的機制還需實驗進一步證明。研究表明,CXCL4L1在結腸癌和食管癌中均有表達〔15,16〕。而在子宮內膜移位結合的卵巢癌中CXCL4L1和 CXCL4的表達水平看起來低于其在正常子宮內膜和子宮內膜移位的組織中的表達,但是這僅僅發生于腫瘤結合的巨噬細胞中〔17〕。CXCL4L1抗體可以將腫瘤轉移灶作為靶點,但在人體中,如果將CXCL4L1作為靶點,可能同時會影響正常細胞的功能,所以CXCL4L1作為腫瘤細胞的靶點還存在著爭議。由于CXCL4L1的擴散能力要遠遠強于CXCL4,所以CXCL4L1并不會僅僅存在于腫瘤組織中〔18,19〕。因此,需要進一步試驗證明CXCL4L1作為腫瘤靶點的合理性。本研究結果表明,CXCL4L1在胰腺腺癌細胞BxPC3中不表達,但在經MF共培養的BxPC3細胞中CXCL4L1卻高表達。MF可以模擬體內微環境,說明當腫瘤細胞處于一個穩定的微環境中,腫瘤細胞可以上調CXCL4L1的表達。CXCR3 作為CXCL4L1的受體,二者結合后可促進腫瘤細胞的增殖,轉移和存活。本研究結果說明CXCR3在胰腺癌的轉移中發揮著重要的作用。CXCL4L1作為胰腺癌發展的一個新穎的調節因子,不僅在腫瘤的微環境中發揮作用,同時還在轉移的腫瘤組織中高表達〔20〕。可能表達有CXCL4L1的腫瘤細胞受到基質腫瘤細胞的接觸控制,同時受到表觀遺傳學的調節有關。為了進一步了解特異的腫瘤微環境和表觀遺傳學基質對于腫瘤細胞表達CXCL4L1以及CXCL4L1在腫瘤細胞轉移中的調節作用,本文通過實驗模擬體內微環境,表明可以上調CXCL4L1的表達,CXCR3在胰腺導管癌原癌組織中低表達,而在肺轉移組織中高表達,為胰腺癌的轉移機制提供理論基礎。

