基于鐵離子作用結合高效液相色譜在線篩選金花茶花黃酮中抗氧化物質和體內抗氧化活性研究
張海龍,虞青婷,吳清孝,秦小明*
1廣東海洋大學食品科學與技術學院 廣東省水產加工與安全重點實驗室 廣東省亞熱帶果蔬加工現代農業科技創新中心,湛江 524088;2懷化學院生物與食品工程學院,懷化 418008
金花茶為常綠灌木至小喬木,高2~3 m,屬山茶科(Theaceae)山茶屬(Camellia),于1933年在我國廣西壯族自治區防城港防城大菉阿泄隘被我國學者左景烈首次發現,1965年被命名為TheopsischrysanthaHu,現《中國植物志》修訂為CamellianitidissimaChi[1],其大部分分布于中國廣西[2]。近年來研究表明,金花茶葉提取物中含有多種黃酮類物質[3],具有抗氧化、抗癌、降血脂等多種生物活性[4,5]。金花茶葉的化學成分和生物活性已被深入研究和報道,金花茶花富含黃酮[6],生物活性卻研究較少,有報道金花茶花在體外具有良好抗氧效果,但僅限于體外抗氧化實驗[7]。因此,研究金花茶花黃酮的體內抗氧化效果將其用于保健功能食品,具有十分重要的意義。
目前體外篩選抗氧劑主要采用柱后衍生的方法如圖1所示,用相對穩定的自由基溶液,如2,2-二苯基-1-苦基肼(DPPH)或2,2-偶氮二(3-乙基苯并噻唑啉-6-磺酸)(ABTS)顯色后,注入到高效液相色譜(HPLC)來篩選抗氧化劑。Wu等[8]采用DPPH結合高效液相色譜從相思樹花提取物中在線篩選出6種潛在的抗氧化物質,并分別用清除DPPH自由基、超氧化物自由基方法驗證了上述物質的抗氧化效果;Kara?elik等[9]用ABTS結合高效液相色譜從歐洲莢蒾花中在線篩選出12種抗氧化物質,并用質譜表征上述篩選物均為已證實具有抗氧化效果的化合物。上述柱后衍生方法雖然能成功篩選出抗氧化物質,但是這些方法較復雜、試劑消耗大、操作繁瑣而沒有被商業化。可否用柱前衍生的方法篩選抗氧化物質,Tang等[10]報道了一種基于柱前衍生的方法,將金銀花提取物與DPPH反應后,再注入到液相色譜系統,快速篩選出抗氧化物質,這表明柱前衍生篩選抗氧化物質是可行的。目前基于鐵離子清除自由基和螯合作用篩選抗氧化物質的研究鮮有報道,因此,本文將建立基于鐵離子作用(清除自由基和螯合作用)的柱前衍生方法,在線快速、簡單和高效的篩選金花茶花黃酮中抗氧化物;同時結合體內抗氧化實驗系統評價金花茶花黃酮的抗氧化效果。
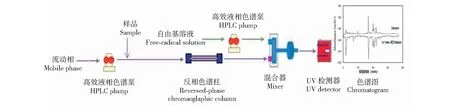
圖1 采用自由基溶液在線篩選抗氧化物示意圖Fig.1 Instrumental setup for the HPLC-DPPH or ABTS online detection of radical-scavenging compounds
1 材料與方法
1.1 材料
金花茶花黃酮(Cnfe)本實驗自制,詳細制備過程參閱文獻[11],黃酮含量為70±5.83 g蘆丁當量/100 g提取物。
1.2 實驗試劑和儀器
1.2.1 實驗試劑
乙腈和甲酸均為色譜純,購自Fisher Chemical公司;DPPH、ABTS和維生素C購自Sigma Aldrich公司;三氯化鐵購自國藥控股有限公司;SPF級雄性SD(Sprague Dawley)大鼠(4~5周齡)購于濟南朋悅實驗動物繁育有限公司(實驗動物生產許可證:SCXK (Lu) 2014-0007);維持飼料購于北京華阜康生物科技股份有限公司;D12492高脂飼料(脂肪供能占比60%)購于小黍有泰(北京)生物科技有限公司;谷胱甘肽過氧化物酶(GSH-Px)檢測試劑盒、總超氧化物歧化酶(T-SOD)檢測試劑盒、丙二醛(MDA)檢測試劑盒、過氧化氫酶(CAT)檢測試劑盒和BCA法檢測總蛋白含量試劑盒均購于南京建成生物工程研究所有限公司。
1.2.2 實驗設備
e2695高效液相色譜儀(美國,Waters),Lynx6000高速落地離心機(美國,ThermoFisher),1200型分析半制備高效液相色譜儀(美國,Agilent),Xevo G2-XSQTof四級桿飛行時間質譜(美國,Waters),Varioskan LUX全自動多功能酶標儀(美國,ThermoFisher),N-1100V-W旋轉蒸發儀(日本,東京理化器械株式會社)。
1.3 方法
1.3.1 鐵離子作用結合高效液相色譜法篩選抗氧化物質
1 mg/mL金花茶花黃酮溶液和濃度為0.1% 三氯化鐵溶液等體積混合在40 ℃下孵育40 min。然后離心(10 000 rpm,10 min),收集上清過0.22 μm濾膜進入液相系統分析,用蒸餾水代替金花茶花黃酮溶液做空白實驗。
1.3.2 高效液相色譜分析條件
采用C18色譜柱(4.6 mm × 250 mm,5 μm),柱溫25 °C,UV檢測器,波長280 nm,上樣量10 μL,流速1.0 mL/min。流動相A甲酸水(水∶甲酸,99.7∶0.3,V/V)和流動相B乙腈,洗脫程序為:7% B(0~25 min),7%→9% B(25~40 min),9%→14% B(40~55 min),14%B(55~70 min),14%→18% B(70~90 min),18%→20% B(90~96 min),20%→80% B (96~99 min)和80%→7% B(99~100 min)。
1.3.3 收集各目標組分
采用半制備色譜收集各個目標峰,色譜條件如下:半制備柱YMC C18ODS-A column(10 mm × 250 mm,5 μm),柱溫30 °C,流速4 mL/min,上樣量100 μL,上樣濃度100 mg/mL。其它色譜條件與上述1.3.2一致。目標組分采用人工收集,當目標峰被流動相洗脫下來時,收集目標峰放置于棕色玻璃瓶中,各目標物在40 ℃條件下,旋轉蒸發脫除溶劑,然后冷凍干燥48 h,再加入適量溶劑配成相應的濃度用于抗氧化分析。
1.3.4 清除DPPH自由基方法
采用早期報道的方法[12],并略作修改,100 μL不同濃度的樣液和100 μL濃度 0.2 mM DPPH溶液混合,在25 ℃孵育30 min。100 μL的蒸餾水和100 μL的DPPH溶液用于空白實驗。上述混合物在517 nm處檢測吸光度。
自由基清除率 =(1-樣品吸光度/空白吸光度)× 100%
1.3.5 清除ABTS自由基方法
清除ABTS自由基方法根據Re等[13]的報道,并略作修改。ABTS+溶液用乙醇稀釋到吸光度在0.7附近,50 μL的樣品溶液和200 μL ABTS+溶液混合置于25 °C避光孵育6 min,在734 nm處檢測上述混合物的吸光度。50 μL的蒸餾水和50 μL的ABTS+溶液用于空白實驗。
自由基清除率 =(1-樣品吸光度/空白吸光度)× 100%
1.3.6 黃酮化合物結構表征
采用時間飛行質譜對目標組分結構表征,質譜條件如下:采用負離子全掃描模式,質量范圍設置為100~2 000 Da,霧化溫度400 ℃,毛細管電壓2 kV。將目標組分的質譜數據與文獻對照確定化合物的結構。
1.3.7 動物實驗設計
實驗選用SPF級雄性SD大鼠(4~5周齡,體重120~130 g),飼養條件為:濕度:55%±10%、溫度:24±2 ℃、光照/黑暗周期12 h,大鼠可自由獲取水和維持飼料。經過7天適用期后,60只大鼠被隨機分為高脂飼料飲食組(50只)和正常維持飼料飲食組(10只)。選擇經過4周高脂飲食成功造成肥胖的大鼠氧化應激模型(體重大于正常飲食組平均體重10% 以上),隨機分為4個小組,每組7只,每籠3~4只。第一組(HFD)模型組,采用高脂飼料喂養;第二組高劑量組(HDG),高脂飼料加金花茶花黃酮(灌胃量:300 mg/kg體重(BW)/天); 第三組中劑量組(MDG),高脂飼料加金花茶花黃酮(灌胃量:150 mg/kg BW/天);第四組低劑量組(LDG),高脂飼料加金花茶花黃酮(灌胃量:75 mg/kg BW/天)。實驗于四周后結束,SD大鼠禁食12 h后,采用15%水合氯醛麻醉,收集腹主動脈血樣。血樣在4 ℃下,3 000 rpm離心10 min,收集血清和肝臟置于-80 ℃直至用于檢測抗氧化指標。以上所有的動物實驗操作均按照廣東海洋大學倫理委員會(SYXK(YUE) 2019-0204)批準的方法進行。
1.3.8 體內抗氧化指標檢測
血清和肝臟的谷胱甘肽過氧化物酶(GSH-Px)、總超氧化物歧化酶(T-SOD)、丙二醛(MDA)、過氧化氫酶(CAT)的檢測方法均按照南京建成生物工程研究所有限公司說明書進行。
1.3.9 數據處理

2 結果與分析
2.1 鐵離子作用結合高效液相色譜法篩選抗氧化物質結果
人們通常用兩種機制來解釋鐵離子與黃酮的抗氧化作用,即清除自由基和金屬螯合作用[14]。金屬螯合作用支持了黃酮作為潛在的抗氧化劑在抑制過渡金屬催化自由基形成方面的作用[15,16]。金屬螯合和氧化還原作用發生在鐵離子和黃酮溶液之間。
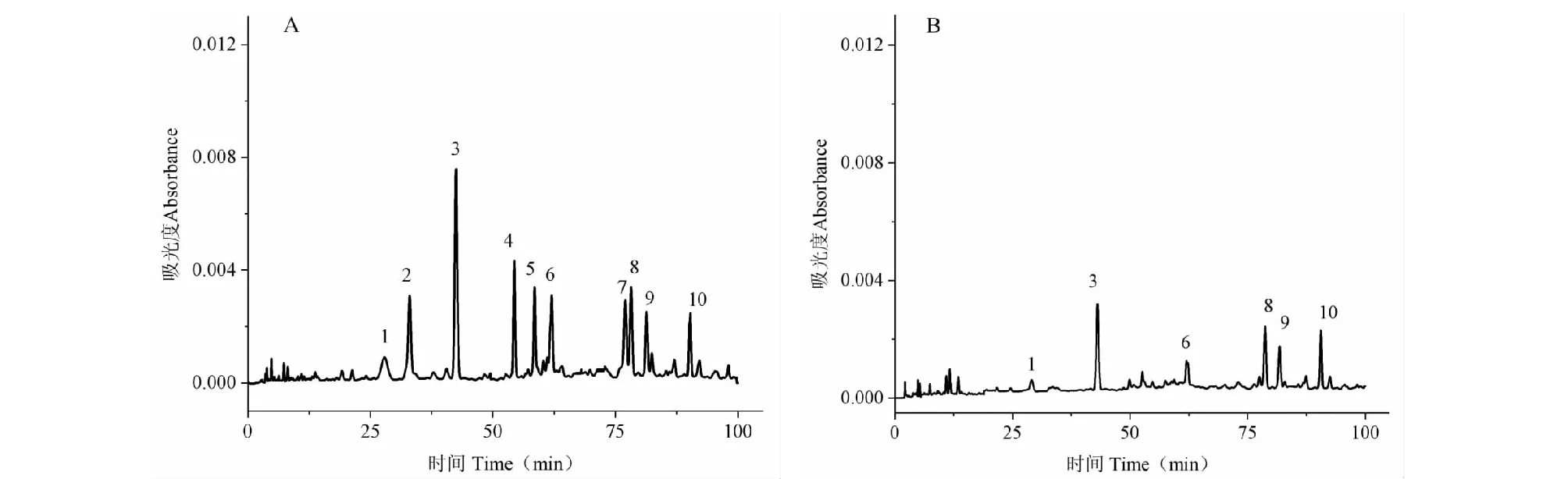
圖2 金花茶花黃酮分別與水(A)、三氯化鐵溶液(B)反應后的高效液相色譜色譜圖Fig.2 High performance liquid chromatography (HPLC) of Cnfe with water (A) and FeCl3 solution (B)
在金屬螯合過程中,三價鐵離子與黃酮的結合破壞了黃酮的分子結構。在氧化還原反應中, 三價鐵離子被還原成二價亞鐵離子[17,18],同時抗氧化劑一旦與三價鐵離子反應,分子結構中的共軛系統被破壞。因此,具有抗氧化效果的黃酮與三氯化鐵溶液相互作用后,其高效液相色譜圖的吸光度下降;而與三氯化鐵溶液混合反應后峰型幾乎沒有變化的化合物,說明其抗氧化作用弱或無抗氧化作用。實驗結果如圖2和表1所示,金花茶花黃酮高效液相色譜圖中有多個峰,經鐵離子作用結合高效液相色譜法處理后,峰1、2、3、4、5、6、7、8、9峰面積相對減少量分別為60.20%±1.56%、100.00%±0.00%、54.75%±2.05%、100.00%±0.00%、100.00%±0.00%、43.70%±3.54%、72.65%±1.06%、17.10%±1.00%、26.20%±2.21%。峰10的峰面積相對減少量為1.96%±0.28%,峰面積幾乎沒有大的改變。因此,除了峰10外,所有指定的峰都被認為是金花茶花黃酮中潛在抗氧化劑。

表1 金花茶花黃酮1~10峰面積數據Table 1 Peak area data of 1-10
注:A為金花茶花黃酮與水反應后各峰面積值,B為金花茶花黃酮分別與三氯化鐵反應后各峰面積,峰面積減少量=A-B,峰面積相對減少量=(A-B)/A×100%,UD為沒有檢測到峰面積。
Note:A was the peak area of the reaction of Cnfe with water,and B was the peak area of the reaction of Cnfe with Fecl3,respectively.The peak area decrease value=A-B,and the relative decrease amount of peak area= (A -B) /A×100%.UD:The peak area was not detected.
2.2 驗證金花茶花黃酮中1~10峰的抗氧化效果
采用DPPH自由基清除方法和ABTS自由基清除方法鑒定了金花茶花黃酮1~10峰的抗氧化活性。1~10峰的清除自由基效果如表2和表3所示。結果表明,1~9峰的DPPH自由基清除率和ABTS自由基清除率較好。其中峰1、2、3、5、6、9的DPPH自由基清除率IC50分別為9.17±0.51、7.46±0.04、8.35±0.04、9.12±0.85、9.29±0.71、9.14±0.66 μg/mL,均小于陽性對照維生素C組的DPPH自由基清除率IC50(9.46±0.33 μg/mL)。峰10的DPPH自由基清除率IC50(65.51±2.38 μg/mL)明顯高于1~9峰的DPPH自由基清除率IC50,而對應的清除DPPH 自由基活性最低。清除ABTS自由基的IC50由小到大的順序如下:峰2的IC50(8.39±0.01 μg/mL)< 峰1的IC50(10.66±0.22 μg/mL)<峰9的IC50(10.69±0.18 μg/mL)<峰3的IC50(10.84±0.04 μg/mL)<峰4的IC50(12.22±0.25 μg/mL)<維生素C的IC50(13.23±0.09 μg/mL)<峰6的IC50(13.98±0.14 μg/mL)<峰5的IC50(15.75±0.30 μg/mL)<峰8的IC50(15.93±0.62 μg/mL)<峰7的IC50(35.51±0.01 μg/mL)<峰10的IC50(264.67±19.82 μg/mL)。峰10的清除ABTS自由基IC50是所有峰中最大的,而對應的ABTS清除活性最小。液相色譜圖的峰面積相對減少量、DPPH自由基清除率IC50和ABTS自由基的清除率IC50三者之間并不呈對應關系。這主要是由于三者檢測抗氧化物的原理(抗氧化體系)不同造成的。綜上所述DPPH和ABTS自由基清除能力IC50的測定結果也證實了鐵離子作用結合高效液相色譜法篩選金花茶花黃酮的抗氧化化合物是可行的。

表2 金花茶花黃酮1~10峰清除DPPH自由基的效果Table 2 Effects of Cnfe single sample on DPPH-scavenging activity

表3 金花茶花黃酮1~10峰清除ABTS自由基的效果Table 3 Effects of Cnfe single sample on ABTS-scavenging activity
2.3 金花茶花黃酮中1~10峰的結構表征
采用時間飛行質譜對金花茶花黃酮中的1~10峰的結構進行表征,結果如表4所示。峰1和峰2的紫外吸收光譜在280 nm有最大吸收值,且在m/z577處有分子離子峰,二級質譜數據在m/z451、425、407、289處出現特征碎片離子,上述數據顯示峰1和峰2可能為原花青素二聚體(Procyanidin dimer)的同分異構體[19]。碎片離子m/z451通過雜環裂變失去一分子間苯三酚(分子量126)的中性物質產生;碎片離子m/z425由分子離子經逆狄爾斯-阿德爾(RDA)裂解失去一個C8H8O3(分子量152)產生。碎片離子m/z407由碎片離子m/z425失去了一個水分子得到。碎片離子m/z289是表兒茶素或兒茶素,兩分子的表兒茶素(兒茶素)通過醌甲基化機制產生分子離子m/z577。綜合上述分析,峰1和峰2為原花青素二聚體。
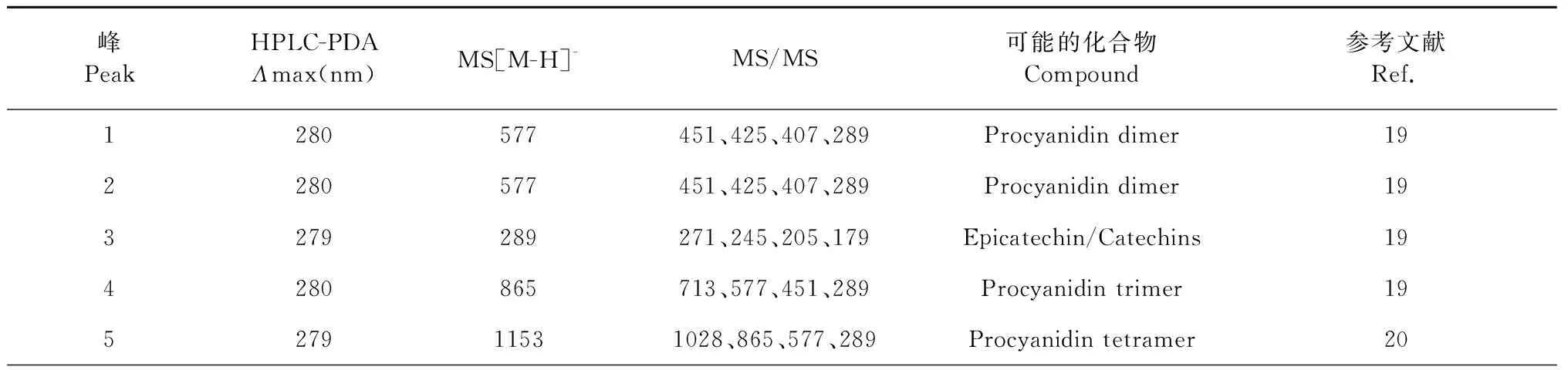
表4 金花茶花黃酮1~10峰的最大紫外可見吸光度和質譜數據Table 4 UV-vis and MS spectra and proposed identities of Cnfe
續表4(Continued Tab.4)
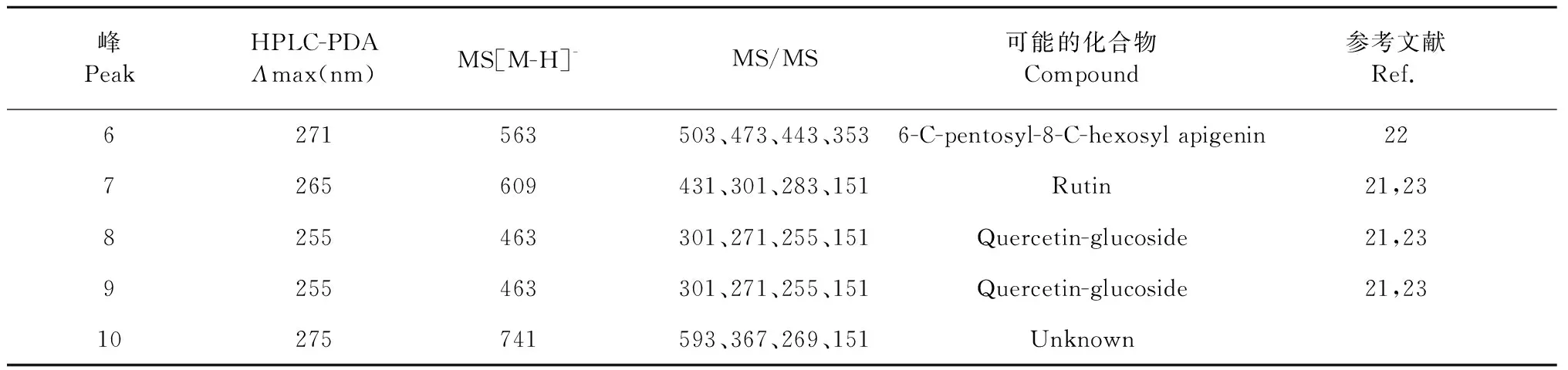
峰PeakHPLC-PDA Λmax(nm)MS[M-H]-MS/MS可能的化合物Compound參考文獻Ref.6271563503、473、443、3536-C-pentosyl-8-C-hexosyl apigenin227265609431、301、283、151Rutin21,238255463301、271、255、151Quercetin-glucoside21,239255463301、271、255、151Quercetin-glucoside21,2310275741593、367、269、151Unknown
峰3的紫外吸收光譜在279 nm處有最大吸收值,在m/z289處有分子離子峰,其二級質譜數據在m/z271、245、205、179處有特征碎片離子,上述數據顯示峰5為表兒茶素或兒茶素[19]。碎片離子m/z271和245分別通過分子離子m/z289失去一分子水和一分子二氧化碳形成。碎片離子m/z205是由分子離子m/z289失去兩個乙烯酮形成;碎片離子m/z179由分子離子m/z289失去一分子鄰苯二酚分子形成的。4和5峰的紫外吸收光譜分別在279 和280 nm處有最大吸收值,分別在m/z865和1 153處有分子離子峰,且二級質譜數據中分別有m/z713、577、451、289特征碎片離子和m/z1028、865、577、289特征碎片離子,為原花青素三聚體和四聚體[19,20]。
峰6和7的紫外吸收光譜在271和265 nm處有最大吸收值,分別在m/z563和609處有分子離子峰,且二級質譜中分別有m/z503、473、443、353和m/z431、301、283、151特征碎片離子,符合芹菜素-6-C-葡萄糖-8-C-木糖苷[22]、蘆丁[21]結構特征,所以峰6和7分別是芹菜素-6-C-葡萄糖-8-C-木糖苷和蘆丁。8峰和9峰的紫外吸收光譜在255 nm處有最大吸收值,在m/z463處出現分子離子峰,二級質譜數據在m/z301、271、255、151處出現特征碎片離子,峰8和9為同分異構體,且符合異槲皮素的結構特征[21,23],峰8和9為異槲皮素或異槲皮素同分異構體。10峰的紫外吸收光譜在275 nm處有最大吸收值,在m/z741處有分子離子峰,二級質譜數據為m/z593、367、269、151,10峰的詳細結構未知需要進一步表征。
綜述所述1~9峰分別為原花青素二聚體、原花青素二聚體、表兒茶素、原花青素三聚體、原花青素四聚體、芹菜素-6-C-葡萄糖-8-C-木糖苷、蘆丁、異槲皮素或異槲皮素同分異構體,這與我們早期的研究結果一致[11],這些物質都具有較強的抗氧化效果。
2.4 金花茶花黃酮體內抗氧化研究
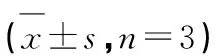
表5 金花茶花黃酮體內抗氧化指標(肝臟)Table 5 Antioxidant activity of Cnfe in
注:與HFD比較,*P< 0.05;**P< 0.01;與NFD比較,#P< 0.05;##P< 0.01,下同。
Note:Compared with HFD,*P< 0.05,**P< 0.01;Compared with NFD,#P< 0.05,##P< 0.01,the same below.
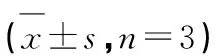
表6 金花茶花黃酮體內抗氧化指標(血清)Table 6 Antioxidant activity of Cnfe in
檢測了金花茶花黃酮干預高脂飼料誘導的氧化應激模型大鼠肝臟和血清的抗氧化指標,結果如表5和表6所示。相對正常飲食組肝臟中脂質過氧化物丙二醛含量(2.03±0.11 nmol/mg),高脂飼料能顯著增加高脂飼料組肝臟中丙二醛的含量(3.10±0.36 nmol/mg,P<0.01)。經過金花茶花黃酮干預后,能顯著降低肥胖大鼠肝臟中丙二醛的含量,且劑量效應明顯。隨著金花茶黃酮濃度增加,高脂飼料誘導的氧化應激模型大鼠肝臟丙二醛含量越低,高劑量組和中劑量組的肝臟丙二醛含量顯著低于高脂飲食組(P< 0.05)。相對正常飲食組而言,高脂飼料導致了高脂飼料組肝臟和血清中過氧化氫酶、谷胱甘肽過氧化物酶和總超氧化物歧化酶含量下降,誘發了氧化應激效應。經過金花茶花黃酮干預后能顯著增加肝臟和血清中過氧化氫酶、谷胱甘肽過氧化物酶和總超氧化物歧化酶的含量。特別是在高劑量金花茶花黃酮組,肝臟中的過氧化氫酶(60.47±2.80 U/mg)、谷胱甘肽過氧化物酶(649.10±51.50 U/mg)和總超氧化物歧化酶(69.91±4.56 U/mg)經過干預后均接近正常飲食組的過氧化氫酶(60.68±4.34 U/mg)、谷胱甘肽過氧化物酶(627.10±49.8 U/mg)和總超氧化物歧化酶(73.27±8.31 U/mg)水平,實驗結果與Xu[24]和Xiao[25]等的研究結果一致。Xu等[24]發現含有原花青素的蘋果多酚能提高仔豬的抗氧化能力、改善脂質代謝、降低氧化應激效應;Xiao等[25]也發現含有原花青素的蓮蓬提取物能提高小鼠血清中總抗氧化能力水平、谷胱甘肽過氧化物酶和總超氧化物歧化酶活性,降低脂質過氧化產物丙二醛的含量。實驗結果表明金花茶花黃酮也含有大量的原花青素,具有顯著改善高脂飼料導致大鼠的氧化應激效應,提高血清和肝臟中總抗氧化能力水平。
3 結論
本文以金花茶花黃酮為例,建立了基于鐵離子作用結合高效液相色譜在線篩選抗氧化物的方法。用清除DPPH自由基和ABTS自由基方法驗證了鐵離子作用結合高效液相色譜篩選抗氧化物質是可行的,并用時間飛行質譜表征了潛在的抗氧化物質。鐵離子作用結合高效液相色譜篩選抗氧化物質的方法具有快速、簡單和高效特點,是否能應用于其他提取物還需進一步研究。體內抗氧化實驗表明,金花茶花黃酮通過降低脂質過氧化產物丙二醛的含量,上調抗氧化應激防御系統中過氧化氫酶、谷胱甘肽過氧化物酶和總超氧化物歧化酶的含量,顯著改善大鼠體內氧化應激效應。上述發現為金花茶花在功能性食品的應用提供了理論支持。

