中性粒細胞/淋巴細胞比值與2型糖尿病合并非酒精性脂肪肝的相關性分析
鄭海蘭 李 凡 丁 維 祁明霞 黃 茗
在2型糖尿病(type 2 diabetes mellitus,T2DM)、肥胖或代謝綜合征等患者中, 非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的患病率明顯高于健康人群[1-2],另外,T2DM是NAFLD進展為非酒精性脂肪肝炎(nonalcoholic steatohepatitis, NASH)和進展性肝纖維化的危險因素之一[3-5],NASH在10~15年內進展為肝硬化高達15%~25%[6]。肝臟脂肪變及肝臟纖維化的早期診斷和評估,對及時治療和控制病情進展具有重要意義。近年,中性粒細胞/淋巴細胞比值(neutrophil/lymphocyte ratio, NLR)作為主要炎癥標志物之一備受關注。與其他白細胞亞型相比,NLR更穩定,且更容易獲得。據報道,NLR與糖尿病的多種并發癥相關[7-8],并與多種肝病相關[9-10]。研究表明,NLR可作為預測多種疾病嚴重程度的無創性新指標,且已被應用于與腫瘤及急性冠狀動脈綜合征患者的預后評估[11],但有關NLR與T2DM合并NAFID的報道少。本研究擬探討NLR與T2DM合并NAFLD的相關性,以了解NLR對T2DM合并NAFLD的預測價值。
1 資料與方法
1.1 一般資料 回顧性分析2018年1月至2019年4月安慶市第一人民醫院住院的430例T2DM患者的臨床資料。納入標準:T2DM患者,年齡>18歲。排除標準:排除病毒性肝炎、自身免疫性肝病、腫瘤、糖尿病嚴重并發癥及其他急慢性炎癥等;1個月內使用他汀類等可能損肝藥物的患者。T2DM診斷符合1999年WHO標準[12]。NAFLD的診斷標準采用2010年中華醫學會肝病學會NAFLD診斷標準[13]:肝臟影像學表現符合彌漫性脂肪肝的診斷標準且無其他原因可供解釋,和/或有代謝綜合征相關組分的患者出現不明原因的血清ALT和/或AST、GGT持續增高半年以上。根據彩超檢查有無脂肪肝將研究對象分為T2DM合并NAFLD組(NAFLD組,177例)和T2DM不合并NAFLD組(n-NAFLD組,253例)。NAFLD組中男性112例,女性65例,平均年齡 (49.63±3.56)歲;n-NAFLD組中男性134例,女性119例,平均年齡(55.18±12.4)歲。
1.2 實驗室檢查 所有患者均于入院第2天早晨6∶00~7∶00抽取靜脈血和餐后2小時靜脈血,使用自動血液分析儀(XE-2100),檢測白細胞數(white blood cell,WBC)、中性粒細胞數(neutrophil,Neut)和淋巴細胞數(lymphocyte,Lym);采用全自動生化分析儀(Beckman Unicel Dxc800)檢測空腹血糖(fasting plasma glucose,FPG)、空腹C肽(fasting C-peptide,FCP),餐后2小時血糖(2 hour postprandial blood glucose,2 h PBG)、谷丙轉氨酶(alanine aminotransferase,ALT)、谷草轉氨酶(aspartate aminotransferase,AST)、總膽固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-c)、尿酸(uric acid,UA);采用Arleray HA-8160全自動糖化血糖分析儀檢測糖基化血紅蛋白(hemoglobin A1c,HbA1c)。計算NLR,NLR=中性粒細胞數/淋巴細胞數。所有血清指標均進行了評估及實驗室質量控制。采用穩態模型法評估基礎狀態胰島素抵抗,HOMA 胰島素抵抗指數(HOMA insulin resistance index,HOMA-IR)=FPG×Fcp/22.5。
1.3 肝臟檢查
1.3.1 超聲檢查 用彩超了解是否存在脂肪肝,超聲儀器為飛利浦IE33,由經過統一培訓的2名超聲醫師操作。超聲具備以下3項表現中的2項者為彌漫性脂肪肝[13]:①肝臟近場回聲彌漫性增強(“明亮肝”),回聲強于腎臟;②肝內管道結構顯示不清;③肝臟遠場回聲逐漸衰減。
1.3.2 肝硬度及肝臟脂肪衰減測定 用FibroScan(法國Echosens公司)檢測肝臟硬度及脂肪衰減情況,由 2 名經過專門培訓的操作醫師嚴格按照儀器使用手冊進行操作。患者取仰臥位,雙手抱頭,探頭與皮膚表面垂直,選擇肝左右葉為檢測區域,連續有效檢測 10 次以上,取中位數為最終測定結果,以肝硬度值(liver stiffness measurement,LSM)和脂肪衰減指數(controlled attenuation parameter,CAP)表示。最終檢測成功率>60%且四分位數間距低于測量值中位數 1/3為有效測量。
1.4 觀察指標 包括體質量指數(body mass index BMI)、收縮壓(systolic blood pressure,SBP)、舒張壓(diastolic blood pressure,DBP)、HbA1C、FPG、2 h PBG、FCP、TC、TG、LDL-c、WBC、NLR、UA、ALT、CAP、LSM和HOMA-IR。
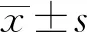
2 結果
2.1 兩組患者臨床基本資料及實驗室檢查結果比較 NAFLD組患者的年齡低于n-NAFLD組,差異有統計學意義(P<0.05);兩組糖尿病病程差異無統計學意義(P>0.05),但NAFLD組患者BMI、TG、2 h PBG、HOMA-IR、WBC、NLR、ALT、CAP、LSM均高于n-NAFLD組,差異有統計學意義(P<0.05)。見表1。

表1 兩組患者臨床基本資料及實驗室檢查結果比較
續表1

項目NAFLD組(n=177) n-NAFLD組(n=253) t/Z/χ2值P值WBC(×109/L)7.29±1.406.57±1.435.178<0.001NLR2.20 (1.74, 2.97) 1.51 (1.12,2.08) 4.631<0.001UA(mmol/L)336.5 (283.00,439.25) 329 (270.00,374.00) 2.3400.058ALT(U/L)58.56±39.9333.24±10.459.628<0.001AST(U/L)42.23±15.1237.76±15.650.9550.513CAP(db/m)286±63214±2316.669<0.001LSM(kp)10.87±3.406.63±2.5614.740<0.001
注:BMI為體質量指數,SBP為收縮壓,DBP為舒張壓,HbA1c為糖化血紅蛋白,FPG為空腹血糖,2 h PBG為餐后2小時血糖,FCP為空腹C肽,TC為總膽固醇,TG為三酰甘油,LDL-c為低密度脂蛋白膽固醇,WBC為白細胞總數,NLR為中性粒細胞/淋巴細胞比值,UA為血尿酸,ALT為谷丙轉氨酶,AST為谷草轉氨酶,CAP為脂肪衰減指數,LSM為肝硬度值,HOMA-IR為HOMA胰島素抵抗指數
2.2 NLR與相關因素的相關性分析 NLR與各因素進行Pearson相關分析, NLR與年齡、HbA1C、TG、TC、LDL-c、2 h PBG、CAP、ALT和LSM呈正相關。見表2。

表2 NLR與相關因素的Pearson相關分析
注:BMI為體質指數,HOMA-IR為HOMA胰島素抵抗指數,SBP為收縮壓,DBP為舒張壓,HbA1c為糖化血紅蛋白,FPG為空腹血糖,2 h PBG為餐后2小時血糖,FCP為空腹C肽,TC為總膽固醇,TG為三酰甘油,LDL-c為低密度脂蛋白膽固醇, UA為血尿酸,ALT為谷丙轉氨酶,CAP為脂肪衰減指數,LSM為肝硬度值
2.3 T2DM合并NAFLD與相關因素的logistic回歸分析 以 T2DM 是否合并 NAFLD 為因變量(是=1,否=0),以上述有統計學意義的指標(性別:男=0,女=1;其余為連續型變量)為自變量,進行逐步logistic回歸分析。結果顯示,HOMA-IR、ALT、BMI、TG、NLR是T2DM合并NAFLD的獨立危險因素。見表3。

表3 2型糖尿病患者NAFLD危險因素分析
注:NLR為中性粒細胞/淋巴細胞比值,ALT為谷丙轉氨酶,TG為三酰甘油,BMI為體質量指數,HOMA-IR為HOMA胰島素抵抗指數
2.4 NLR診斷T2DM合并NAFLD的ROC的曲線分析 T2DM合并NAFLD患者,NLR的ROC曲線下面積為0.873,相對應的95%CI為0.809~0.940。NLR的最佳截斷值為1.88時,對T2DM合并NAFLD的診斷敏感性為90.5%,特異性為53.6%。見圖1。

圖1 NLR預測2型糖尿病合并NAFLD的ROC曲線
3 討論
NAFLD是一個臨床病理生理綜合征,包括單純的脂肪變性、非酒精性脂肪肝炎(nonalcoholic steatohepatitis, NASH),以及相關肝硬化和肝細胞癌[14-15]。它是21世紀全球重要的公共健康問題之一,亦是我國愈來愈重視的慢性肝病問題[16]。隨著人民生活水平的改善,乙肝疫苗的廣泛使用,病毒感染導致的肝臟疾病呈逐漸減少趨勢[17],而NAFLD的患病率逐漸增加[13],發達地區發病率可達15%左右[16]。在代謝性疾病患者中,發病率更高,有研究[14-15]顯示,在糖尿病患者中NAFLD的發病率可達28%~55%。本研究結果顯示,住院T2DM患者NAFLD的患病率為41.2%,與周健等[18]研究結果一致。本研究結果提示,T2DM合并NAFLD組患者平均年齡(49.63±3.56)歲,顯著低于n-NAFLD組的(55.18±12.4)歲,提示在T2DM患者中NAFLD的發病也更加年輕化。而T2DM合并NAFLD 與HOMA-IR和BMI顯著相關,因此對T2DM患者進行NAFLD常規篩查非常必要。
臨床上檢測脂肪肝的方法較多,但均有一定缺點,如肝活檢是評估NAFLD病變程度的“金標準”,但其有創性及潛在并發癥等限制了臨床使用;B超和CT臨床使用較多,但敏感性差;MRI敏感性好,費用又較高;肝臟彈性回聲瞬時成像是近年興起的一種評估肝臟脂肪變及纖維化的一種設備,研究[19]顯示,肝臟彈性回聲瞬時成像測定對NASH及纖維化NASH的診斷均具有良好的診斷效能,與肝穿刺病理分期一致性好。研究[13]顯示,慢性炎癥狀態可能在 NAFLD 進展為NASH及肝臟纖維化過程中發揮重要作用,已有多個炎癥因子被證實可作為NASH潛在的生物標志物。外周血 NLR 為亞臨床炎癥的指標,可通過血常規白細胞分類檢查容易獲得。本研究結果提示,與未合并NAFLD的患者相比,T2DM合并NAFLD患者的NLR明顯升高。進一步行相關性分析發現,NLR與CAP、LSM、ALT呈明顯正相關。提示NLR越高,肝臟發生脂肪肝炎或纖維化可能越大,并且NLR隨著NAFLD患者組織病變嚴重程度的增加而增高。之前的研究[20]也表明,NAFLD的炎癥反應是由胰島素抵抗、基因多態性、系統脂毒性產物、大量的炎性因子、腸道微生物和氧化應激等多種因素共同導致的。NLR反映機體整體的炎癥狀態,中性粒細胞介導炎癥反應,淋巴細胞負責免疫調節。因此,當NLR值增加時,機體炎癥反應越重,發生NASH和肝纖維化的可能性更大。這與Abdel-Razik等[9]的研究一致,該研究發現NLR和NAFLD活動評分、促炎性細胞因子和CRP呈正相關。另有研究[21]顯示,脂代謝紊亂、肥胖和高血壓是糖尿病合并脂肪肝的獨立危險因素。本研究通過回歸分析發現,NLR與HOMA-IR、BMI、TG一樣,是T2DM合并NAFLD的獨立危險因素。
ROC曲線結果提示,NLR鑒別T2DM是否合并NAFLD的最佳截斷值為1.88,曲線下面積為0.87,敏感性為90.5%,特異度為53.6%,這與Alkhouri等[22]研究一致。提示NLR可以作為T2DM合并NAFLD的預測指標和病情進展的監測指標。
綜上所述,NLR是T2DM合并NAFLD患者的獨立危險因素,可作為T2DM合并NAFLD及出現肝臟脂肪變性及纖維化進展的預測指標。

