低鹽發酵鳀魚魚露過程中品質動態變化分析
王炳華,胡建國,童光森
(1.浙江商業職業技術學院 旅游烹飪學院,杭州 310053;2.濟南大學,濟南 250002;3.四川旅游學院,成都 610100;4.成都大學肉類加工四川省重點實驗室,成都 610106)
魚露制備主要是利用一些低值魚蝦及其下腳料通過微生物分解原料中的蛋白質、脂肪等物質發酵制備的一款具有咸鮮適口風味的調味品[1]。因其在發酵過程中經多種微生物參與,其營養較為全面,富含多種風味成分,氨基酸組成合理,含有可溶性短肽、牛磺酸等抗氧化活性物質,是我國常用的一種調鮮調味品[2]。
傳統魚露制備發酵周期較長,含鹽量高,與低鹽的健康理念相悖,較高的鹽濃度雖然可以有效地抑制腐敗菌繁殖,但是同時也降低了酶解活力,延長了發酵周期[3]。低鹽發酵魚露降低了鹽添加量,通過曲種添加、調節發酵溫度等縮短了發酵周期,有效地克服了傳統發酵存在的弊端,但低鹽發酵魚露過程中存在的風味不明顯、生物胺含量較高等問題,主要是受微生物影響[4]。微生物菌群變化及其微生態作用直接影響成品魚露的品質,微生物作用在魚露生產中具有重要地位[5]。目前國內對白酒、陳醋、黃豆醬等發酵過程中的微生物動態變化相關研究較多,但是對低鹽發酵魚露的微生物動態變化研究較少,生產企業缺少相關依據,通過分析影響魚露品質的相關微生物在發酵不同階段的變化,探討其與主要理化指標的關系,可以解釋魚露品質指標形成的本質,為低鹽魚露發酵工藝提供了理論依據[6]。
基于此,通過研究低鹽發酵方式制備的鳀魚魚露在發酵過程中不同階段微生物群落結構的變化情況,分析其pH值、氨基酸態氮(AAN)、揮發性鹽基氮(TVB-N)等理化指標以及揮發性風味物質、游離氨基酸的含量動態變化情況,探討低鹽發酵鳀魚魚露過程中微生物菌群與理化指標的聯系,分析其揮發性風味物質與游離氨基酸的變化情況,為低鹽魚露發酵工藝改良及相關研究提供了參考。
1 材料與方法
1.1 材料與試劑
鳀魚:購于舟山漁港;木瓜蛋白酶、pH緩沖液、米曲霉3.042:購于浙江匯寧生物科技有限公司;食鹽:市售;甲醇、乙腈:均為色譜純;其他試劑:均為國產分析純。
1.2 儀器與設備
GJJ-2/32均質機 杭州惠和機械設備有限公司;HT-1300潔凈工作臺 蘇州安泰空氣技術有限公司;FE28 pH計 德州市高通實驗儀器有限公司;FA2104B電子天平 上海精密儀器儀表有限公司;恒溫水浴鍋 江蘇金怡儀器科技有限公司;GL22M離心機 湖南邁達儀器有限公司;LN-998多功能料理機 廣東省中山市創冠電器廠;DHG恒溫鼓風干燥箱 上海精宏實驗設備有限公司;BJPX-I生化培養箱 山東科博生物產業有限公司;ATN-300型全自動凱氏定氮儀 上海洪紀儀器設備有限公司;KG203快速DNA提取檢測試劑盒 北京杰輝博高生物技術有限公司;S-433D氨基酸分析儀 北京安信科儀器設備有限公司;TSQ 9000 GC-MS聯用儀 賽默飛世爾科技(中國)有限公司。
1.3 方法
1.3.1 鳀魚魚露制備
參考袁樹昆[7]、鄒敏[8]的方法。
鳀魚酶解:將鳀魚清洗干凈,猛火蒸50 min,放入多功能料理機攪打成漿,添加pH緩沖液調勻至pH值6.0,固液比為1∶4,加入2.5%木瓜蛋白酶,加熱至55 ℃,酶解6 h。
曲種制備工藝:將麩皮與魚糜按1∶2比例接種米曲霉培養液0.6%,添加200%的水,培養溫度33.5 ℃,培養時間8 d。
發酵工藝:將鳀魚酶解液與麩皮按9∶1比例混合,添加0.9%曲種,加鹽9.3%,在31 ℃,發酵期間每5 d攪拌一次,發酵80 d。
1.3.2 微生物總DNA提取與16S rDNA鑒定
取發酵0,20,40,60,80 d鳀魚魚露發酵液,過濾去除大顆粒物質,將發酵液中的蛋白質用C2HCl3O2沉淀,在4 ℃下離心30 min,收集微生物細胞;使用細菌基因組DNA提取試劑盒提取細菌總DNA[9]。
DNA 16S rDNA PCR擴增體系:包含12.5 Master Mix(Taq酶、dNTP混合物以及反應緩沖液),27F 引物1.5 μL,1492R引物1.5 μL,模板DNA 1.5 μL,雙蒸水15.5 μL;16S rDNA PCR擴增條件:預變性(96 ℃,3 min),變性(95 ℃,30 s),復性(60 ℃,30 s),延伸(72 ℃,30 s),共進行40次循環;72 ℃延伸8 min;將PCR產物送至上海美吉生物醫藥科技有限公司進行測序,將微生物16S rDNA序列在GenBank進行同源性檢索,并采用MAGA 5.0軟件進行序列分析[10]。
1.3.3 理化指標測定
pH值的測定參考李可人等[11]的方法;氨基酸態氮的測定參考鄒大維等[12]的方法;揮發性鹽基氮的測定參考方靖等[13]的方法;揮發性風味物質的測定采用GC-MS,參考王炳華等[14]的方法;游離氨基酸的測定參考姜慧嫻等[15]的方法。
1.4 數據分析與處理
采用SAS 8.1與Excel 2010進行統計分析與制圖,所有試驗平行3次,p<0.05為顯著性差異[16]。
2 結果與分析
2.1 低鹽發酵鳀魚魚露中微生物群落結構分析
通過傳統培養法從低鹽發酵鳀魚魚露的不同發酵時間分離出厚壁菌門、變形菌門、放線菌門等36個門,以及部分無法鑒定序列,魚露微生物菌群結構復雜,根據相對豐度,本研究選取豐度值較高的前10位進行統計,并測定菌落總數,并計算各門數量,結果見表1和圖1。

表1 不同發酵時期菌群門類數量Table 1 The number of phyla of microbial flora in different fermentation periods
注:數量單位lg(個/mL)。
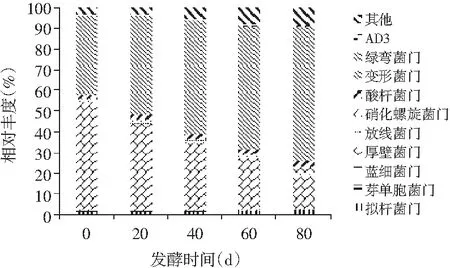
圖1 發酵過程中菌群門類組成豐度Fig.1 Abundance of phyla composition of microbial flora in the fermentation process
由表1和圖1可知,低鹽鳀魚魚露在發酵過程中其微生物菌群主要分布在厚壁菌門、變形菌門、擬桿菌門、酸桿菌門、放線菌門等。擬桿菌門、放線菌門、酸桿菌門的相對豐度波動較小,分別從前期的1.23%、1.35%、1.54%到發酵后期的2.05%、1.34%、2.6%,屬于優勢菌群;厚壁菌門的相對豐度呈下降趨勢,從發酵0 d的52.32%下降到16.32%,數量從6.02 lg(個/mL)減少到3.89 lg(個/mL),主要是受其門中的乳桿菌目、芽孢桿菌等厭氧或兼性厭氧微生物的影響,低鹽魚露發酵過程中,微生物菌群總量增加,對其門類微生物起抑制作用;變形菌門的相對豐度呈上升趨勢,從發酵初期的38.23%上升到65.23%,數量相對穩定,從5.88 lg(個/mL)減少到5.41 lg(個/mL),變形菌門中的假單胞菌目等是嗜氧微生物,微生物菌群總量增加并不影響其門類微生物的生長。
綜上分析,低鹽發酵鳀魚魚露在發酵過程中,受外界環境及鹽度影響,微生物菌群總量增加,對微生物種類有一定影響,菌群主要分布在厚壁菌門、變形菌門、擬桿菌門、酸桿菌門、放線菌門等,變形菌門與厚壁菌門在整個發酵過程中的豐度相對較高,屬于絕對優勢菌群。
2.2 低鹽發酵鳀魚魚露過程中pH值含量變化分析
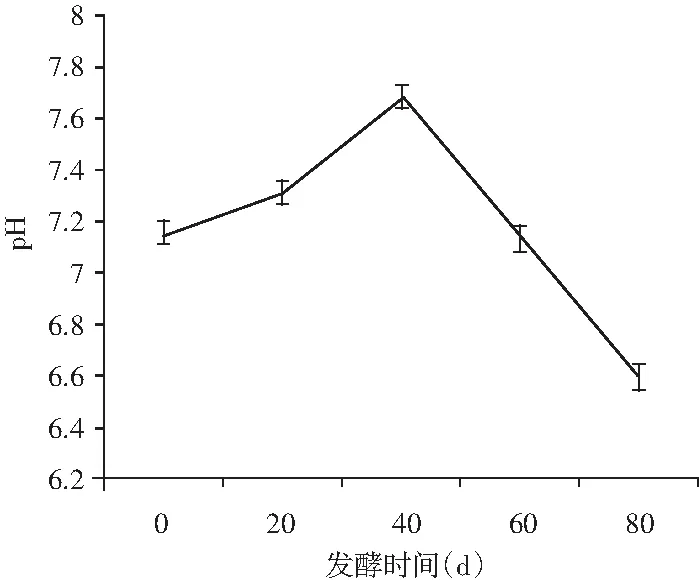
圖2 發酵過程中pH的變化Fig.2 Changes in pH values during fermentation
pH的變化在一定程度上反映了低鹽發酵鳀魚魚露酸度的變化,其是反映乳酸發酵的一個重要指標[17]。由圖2可知,實驗樣品在發酵0 d時pH值為7.15,在發酵的前40 d呈上升趨勢,在第40天時,pH值達到了7.68,之后持續下降,在發酵第80天時,pH值下降到6.59,結合微生物群落結構變化情況分析,pH值變化與厚壁菌門和變形菌門微生物生長一致,發酵前期變形菌門中的假單胞菌目等嗜氧微生物開始繁殖,乳酸菌等有益菌種不能充分抑制雜菌的生長,使pH值呈上升趨勢,在40 d后,各種微生物數量達到頂峰,有益菌種對雜菌的抑制作用引起pH值下降,微生物中的嗜鹽乳酸菌成為后期的優勢菌種,直接影響魚露的發酵效果。
2.3 低鹽發酵鳀魚魚露過程中AAN值與TVB-N值變化分析
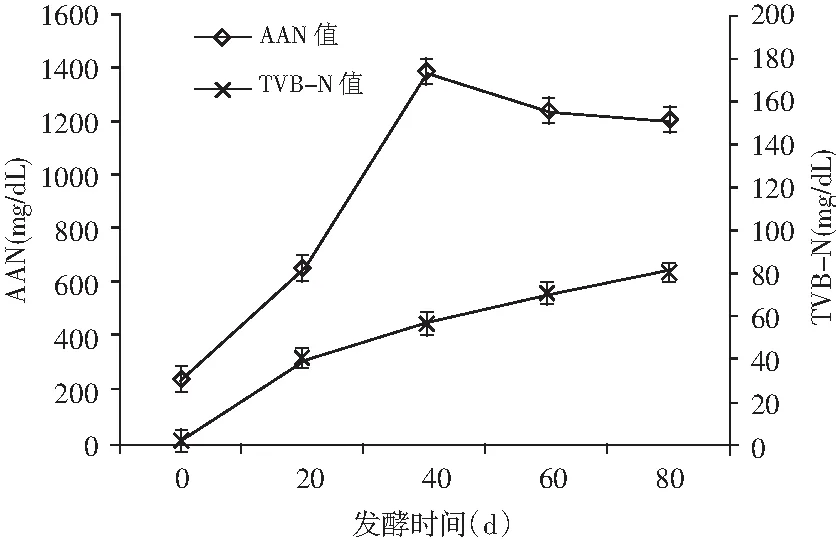
圖3 發酵過程中AAN值與TVB-N值變化Fig.3 Changes in AAN and TVB-N values duringfermentation
魚露中的氨基酸態氮(AAN)含量是反映其發酵過程中氮源被有益微生物利用的程度,其利用程度越高,說明鮮味物質含量越多,感官指標的鮮味越佳,氨基酸態氮(AAN)是衡量鳀魚魚露質量的重要指標[18]。揮發性鹽基氮(TVB-N)主要是指鳀魚魚露在發酵過程中原料肉蛋白被腐敗微生物分解的情況,其含量越高表明氨基酸被破壞的越多[19]。由圖3可知,低鹽鳀魚魚露在發酵前40 d,AAN含量迅速增加,20~40 d增長快于0~20 d,主要是在發酵前40 d,魚露中微生物菌群結構復雜,各種優勢菌相互競爭,分泌大量蛋白酶,充分水解鳀魚蛋白質,游離氨基酸含量上升。在發酵40~80 d,AAN含量開始平緩下降,其主要受鳀魚蛋白質含量影響,分解速度下降,其游離氨基酸含量趨于穩定。低鹽發酵鳀魚魚露中TVB-N含量始終呈上升趨勢,在發酵后期其含量達到80.21 mg/dL,含量略高,但是在發酵結束后存儲過程中易被去除,TVB-N值上升與微生物菌群結構復雜有關,復雜的菌群結構導致乳酸菌外的雜菌生長比較旺盛,腐敗微生物對鳀魚蛋白質分解較快,造成TVB-N值一直呈上升趨勢。
2.4 低鹽發酵鳀魚魚露過程中揮發性風味物質變化分析
本文采用氣質聯用技術測定低鹽鳀魚魚露發酵過程中揮發性風味物質,分別在0,20,40,60,80 d 5個不同發酵時間節點魚露樣品中共檢測出28種揮發性風味物質,其中酸類6種、醇類5種、醛類與酮類7種、酯類3種、含氮化合物5種以及其他2種。不同發酵節點揮發性風味物質差異較大,在發酵0 d時共檢測出揮發性風味物質9種,其揮發性風味物質主要是腌制液及鳀魚中的風味。在發酵過程中的20,40,60,80 d 4個不同發酵時間節點分別檢測出揮發性風味物質21種、23種、26種、26種,整體分析其在發酵過程中揮發性風味物質種類隨著發酵時間延長呈增加趨勢。
醇類是低鹽鳀魚魚露中主要的揮發性風味物質,在20,40,60,80 d 4個不同發酵時間節點其占樣品總量的34.06%、44.81%、34.81%和33.54%。發酵0 d時揮發性物質主要是腌制液與鳀魚肉本身所含風味物質。酸類物質中的閾值較高,對魚露整體風味影響不大。前期酸類總量較低,隨著發酵時間延長,其總量增加,這與pH值的檢測結果一致。醇類物質主要是鳀魚脂肪氧化以及氨基酸水解產物,其閾值較低,對整體風味影響較大。醛類物質是降解產物,其中魚露中的戊醛、己醛、2-甲基丙醛、3-甲基丁醛等濃度較高,賦予魚露青草、麥芽香等令人愉快的氣味。庚醛主要呈現魚腥味,經過發酵其含量降低,抑制腥味的呈現。酯類物質主要是醇類和酸類物質經過酯化反應的產物,某些酯類物質呈現水果和花的香味,豐富魚露的風味[20]。含氮化合物主要來源于美拉德反應或熱分解的產物,其閾值較低,呈現青草味,對魚露風味有一定影響。
綜合分析,低鹽發酵鳀魚魚露揮發性風味物質隨著發酵時間延長種類增加,其呈味感受受發酵時間影響,主要是隨著發酵時間延長,魚露微生物菌群中的優勢菌種對雜菌的抑制作用,抑制不利風味物質的產生,微生物菌群是低鹽鳀魚魚露發酵過程中產生特征風味的重要影響因素。
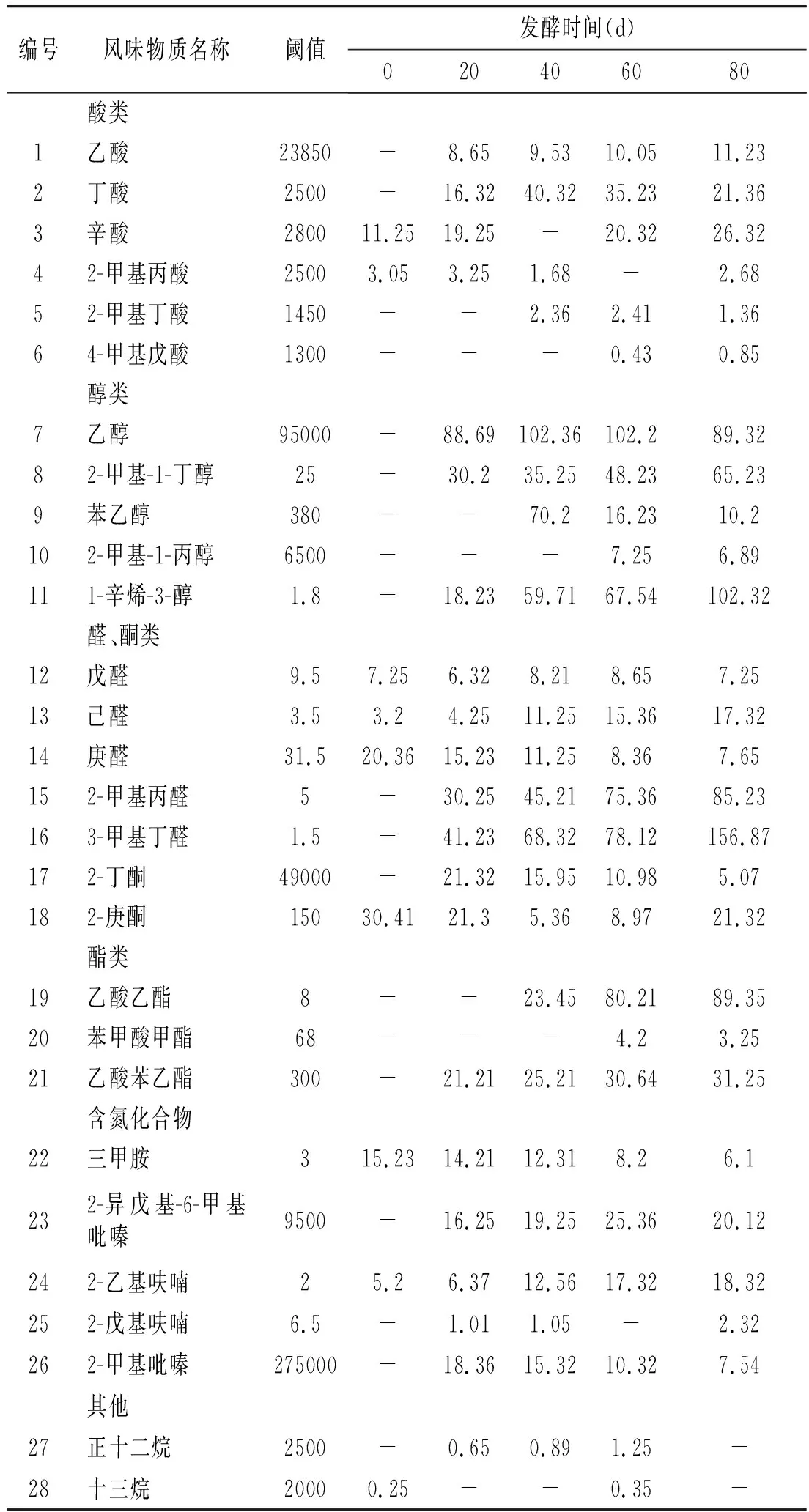
表2 魚露主要揮發性成分測定結果Table 2 Determination results of main volatile components in fish sauce ng/g
注:“-”表示未檢測出。
2.5 低鹽發酵鳀魚魚露過程中游離氨基酸的含量變化
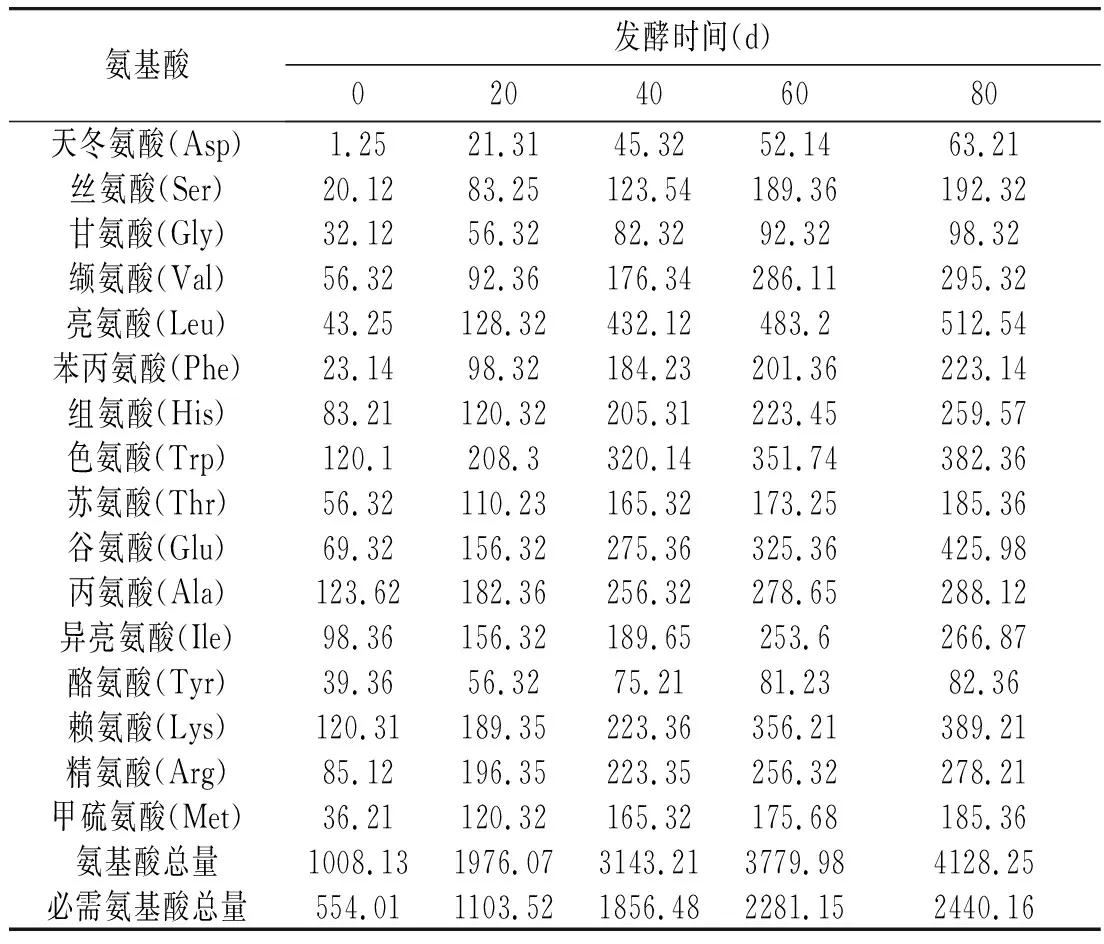
表3 主要游離氨基酸測定結果Table 3 Determination of main free amino acids mg/dL
魚露中的游離氨基酸是其鮮味物質的重要組成部分,是評價魚露鮮味的主要指標,也是評價其營養價值的主要指標[21]。由表3可知,游離氨基酸總量和必需氨基酸總量隨著發酵時間延長呈現上升趨勢,0~40 d增加幅度較大,40 d后趨于穩定增長,其增長趨勢與氨基酸態氮(AAN)含量變化一致,其與低鹽發酵鳀魚魚露中微生物菌群結構變化有關,前期優勢菌相互競爭,分泌大量蛋白酶,充分水解鳀魚蛋白質,游離氨基酸含量上升。在發酵40~80 d,分解速度下降,其游離氨基酸含量趨于穩定。
3 結果與討論
通過研究低鹽發酵方式制備的鳀魚魚露在發酵過程中不同階段微生物群落結構的變化情況,分析了pH值、氨基酸態氮(AAN)、揮發性鹽基氮(TVB-N)等理化指標以及揮發性風味物質、游離氨基酸的含量動態變化情況,研究結果表明:低鹽發酵鳀魚魚露在發酵過程中,受外界環境及鹽度的影響,隨著發酵時間延長,微生物菌群總量增加,菌群主要分布在厚壁菌門、變形菌門、擬桿菌門、酸桿菌門、放線菌門等,變形菌門與厚壁菌門在整個發酵過程中豐度相對較高,屬于絕對優勢菌群。微生物菌群結構變化直接影響pH值、AAN值與TVB-N值的變化:在發酵的前40 d pH值呈上升趨勢,達到了7.68,然后持續下降,在發酵第80天時,pH值下降到6.59;在發酵前40 d,AAN含量迅速增加,20~40 d增長快于0~20 d,在發酵40~80 d,AAN含量開始平緩下降;TVB-N含量始終呈上升趨勢,在發酵后期其含量達到80.21 mg/dL。揮發性風味物質隨著發酵時間延長呈現上升趨勢,隨著發酵時間延長,其種類增加,呈味感受增強,微生物菌群中的優勢菌種抑制不利風味物質的產生,游離氨基酸總量和必需氨基酸總量與魚露中微生物菌群結構變化有關,前期優勢菌相互競爭,分泌大量蛋白酶,充分水解鳀魚蛋白質,游離氨基酸含量上升,后期趨于穩定。
本研究明確了低鹽發酵鳀魚魚露過程中微生物菌群與理化指標的聯系,分析了其揮發性風味物質與游離氨基酸的變化情況,為低鹽魚露發酵工藝改良及相關研究提供了理論依據及方法借鑒。

