近紅外上轉換納米轉換器在光遺傳學調控中的應用
王志敏 胡 明 邢本剛
(新加坡南洋理工大學,數(shù)理與科學學院,化學與生物化學系,新加坡 637371)
0 引 言
精準調控生物分子以及生理過程,對于理解疾病的發(fā)生發(fā)展和實施有效的治療具有重大意義[1-2]。而離子通道作為細胞膜的主要成分,對于神經、肌肉等其它系統(tǒng)的電生理信號的傳導和整合起到關鍵作用,它的活化或功能障礙會影響正常生理及病理進程,比如大腦思維,肌肉收縮和離子通道病[3-5]。目前,常用于離子通道調控的策略有以下幾種:(1)化學分子作用,如離子通道激活劑或阻斷劑;(2)基因工程干預,如特異性地表達、敲除或沉默目的基因來影響通道蛋白的活性;(3)物理電刺激,作用于特定的電壓門控離子通道[6-9]。盡管這些方法都取得了一定的進展,但在實際應用中依然存在著許多挑戰(zhàn)。例如,化學藥物隨血液循環(huán)的非識別性積累及作用難以避免,這極大地限制了調控的空間分辨率[10]。再者,化學或遺傳擾動的不可逆性也阻礙了實際調控的時間準確性[7]。此外,盡管電學模式的物理刺激,尤其是對于深部大腦刺激而言,顯示出很好的時空準確性和應用價值。但是,實際操作中需要高侵入性地在深層腦組織植入電極或芯片,會造成潛在的臨床不良反應[11-12]。
因此,迫切需要開發(fā)精度高、損傷小的調控膜離子通道的有效技術。近年來,使用光來控制生物分子和生理過程已引起了廣泛關注[13-15]。其中一種新興的被稱作光遺傳學的生物技術被應用于神經科學領域,并且能高選擇性地,甚至在毫秒級的時間分辨率下實現(xiàn)神經功能的操控[16-18]。更重要的是,通過基因工程對光敏視紫紅質離子通道蛋白進行改造,使其在離子特異性以及光譜響應性2個方面進一步多樣化。這為推動光遺傳學在更復雜的生物體系應用的提供了機會,不僅在體外單細胞水平,還在自由活動動物上對腦回路介導的行為學進行調控[19-22]。然而,盡管這些技術取得了令人矚目的成就,但目前報道的光敏感視紫紅質蛋白,或其它用于膜通道調節(jié)的光遺傳學工具主要是在可見光區(qū)工作。由于可見光組織穿透性不足,生物體吸收和散射嚴重,這些因素極大地限制了光遺傳學在體內應用[18,23-25]。雖然有研究報道通過光學纖維或微型發(fā)光二極管植入可以做到深層腦組織刺激,但這種高度侵入性的手段會引起一定的安全隱患[26-27]。由此,開發(fā)新的光遺傳學技術,使其能夠在活體條件下無(微)創(chuàng)地、有效地調控深層部位膜通道具有重要意義。
值得注意的是,科學家們目前為實現(xiàn)體內有效的光遺傳學刺激做出了多方面努力,其中將光敏離子通道蛋白激發(fā)波長移至近紅外窗口(>700 nm)被認為有利于更深的組織穿透能力[24,28-29]。比如通過基因工程化的策略,目前不同突變視紫紅質離子通道蛋白的響應光譜已經從藍光紅移到黃光,甚至紅光區(qū)域,但這些光遺傳學體系仍局限在可見光波長范圍內(表1)[30-31]。此外,通過使用近紅外光響應納米材料作為光轉換器,進一步原位刺激光遺傳學工具,可以增強光穿透能力進而調控離子通道的活性[32-34]。其中,鑭系元素摻雜的上轉換納米粒子作為獨特的光學材料被選為潛在的光納米轉換器。該材料具有將近紅外光(如980或808 nm)轉換為紫外、可見或近紅外區(qū)域的多種發(fā)射的性能(表2),鑒于其較少的散射和更深的組織滲透深度,已被廣泛地應用于生物成像和納米醫(yī)學研究領域[35-39]。基于此,近年來人們將鑭系元素摻雜的上轉換納米粒子與各種光敏離子通道蛋白結合,實現(xiàn)了近紅外上轉換的光遺傳學調控,并取得了顯著的研究成果[32,40-41]。
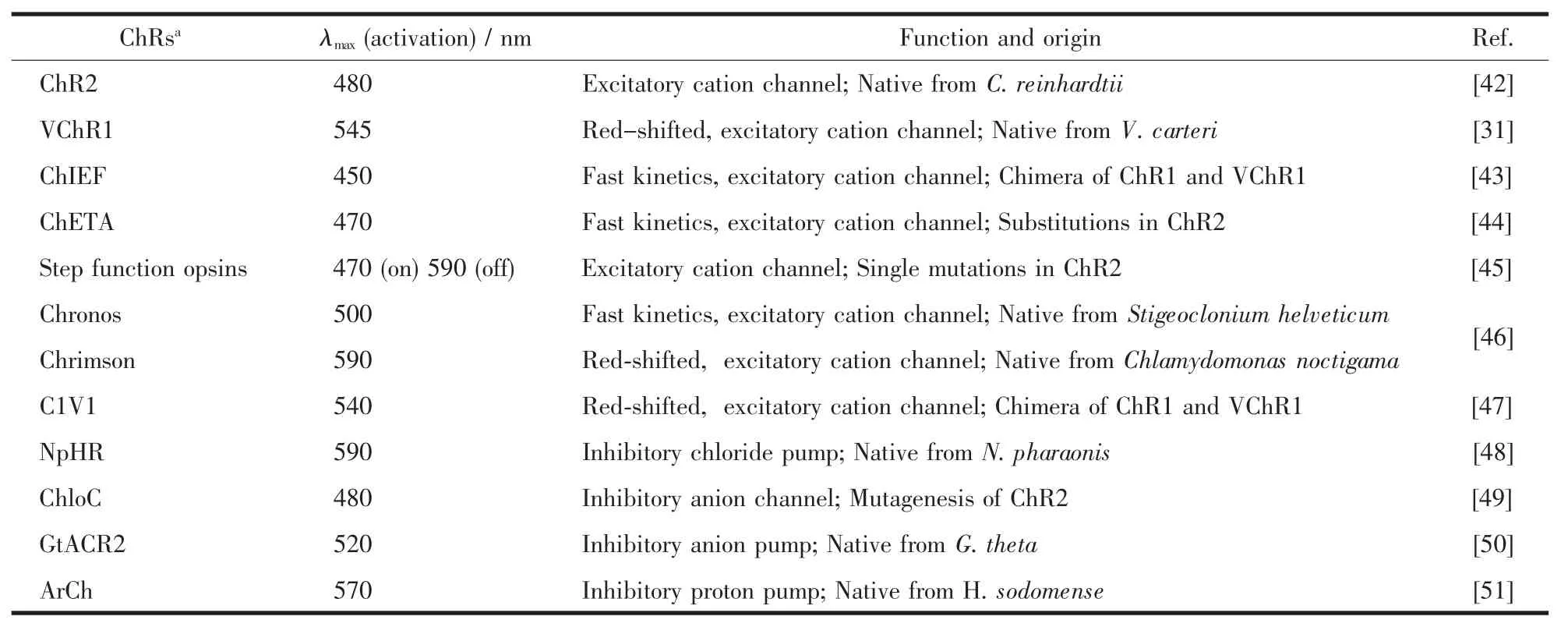
表1 常用的視紫紅質離子通道蛋白(ChRs)Table 1 Commonly used channelrhodopsins(ChRs)

表2 常用的上轉換納米粒子(UCNPs)Table 2 Commonly used upconversion nanoparticles(UCNPs)
因此,我們聚焦于生物醫(yī)學研究中將近紅外上轉換納米轉換器用于光遺傳學調控的最新成果。首先,我們對特定功能的上轉換納米平臺與光敏離子通道蛋白結合的策略進行了總結;其次,詳細地介紹了上轉換光遺傳學的廣泛應用以及可改進的技術;最后,關于進一步推進該技術向臨床轉化并克服當前挑戰(zhàn)提出了建議和展望。
1 開發(fā)上轉換納米粒子介導的近紅外光遺傳學平臺
通過匹配不同光敏視蛋白的激活波長,選擇適當?shù)纳限D換納米粒子作為近紅外光轉換器,這種組合策略可以靈活地實現(xiàn)特定離子通道的激活。2011年,Deisseroth等[53]在一項專利申請中首先提出了這個理念,并列舉了各種上轉換納米粒子與細胞膜上光響應視蛋白表達的神經元組合并進行光調控的方法。在2013年,Han等在一項基金申請里介紹了用于體內神經元無光纖操控的上轉換光遺傳學設計。此后在2015年,不同研究團隊分別報道了在體外體內成功地實現(xiàn)了上轉換光遺傳學調控的 研究[54-55]。
例如,Yawo等[40]使用藍色發(fā)光(發(fā)射峰在450和480 nm)的上轉換納米材料 NaYF4∶Yb/Sc/Tm@NaYF4,在近紅外976 nm激光照射下,可以有效地激活PsChR離子通道,并產生明顯的動作電位;另外,利用發(fā)出綠光(550 nm)的 NaYF4∶Sc/Yb/Er 作為近紅外光轉換器,進而可用于激活表達細胞中的C1V1或mVChR1離子通道蛋白(圖1)。進一步地研究還證明,結合上轉換納米粒子的光遺傳學調控效果顯示了刺激的時間和功率依賴性。但是,該研究仍有待改進空間,比如上轉換發(fā)光效率,納米材料的生物安全性等方面。
盡管上轉換光遺傳學系統(tǒng)具有靈活的適用性,但人們在實際應用中需要開發(fā)必要的刺激平臺,以取得有效地光敏離子通道的近紅外調控。目前報道了以下幾種不同的設計:
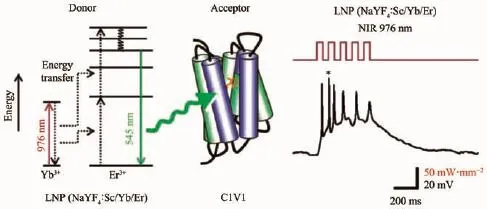
圖1 近紅外激發(fā)的上轉換納米粒子活化光敏離子通道蛋白(C1V1)[56]Fig.1 Near infrared excited up-conversion nanoparticles activate photosensitive ion channel proteins(C1V1)[56]
(1)將上轉換納米粒子嵌入細胞可生長的膜載體。如圖2a所示,Lee等[54]制備了上轉換納米材料(NaYF4∶Yb/Tm@NaYF4)混合嵌入聚乳酸-羥基乙酸(PLGA)聚合物的薄膜。這種0.5 mm厚的薄膜不僅可用于神經元接觸培養(yǎng),還可以用作光遺傳學調節(jié)的基礎平臺,將近紅外激光轉換為藍光,隨后激活表達有藍色光敏通道視紫紅質的蛋白(ChR2)的神經元。更關鍵地是,該體系通過1、5和10 Hz的980 nm脈沖激光刺激,實現(xiàn)了毫秒級分辨率的神經元活化響應。此外,Yawo等[40]比較分析了不同接觸式細胞光遺傳學調控平臺的效率。根據(jù)圖2b所示,方法一將上轉換納米粒子與神經元直接接觸,而方法二在二者之間采用玻片間隔。實驗結果發(fā)現(xiàn)兩種方法均以激光功率依賴性的方式顯示出光刺激下向內性的膜電流響應。但是,在相同的近紅外激發(fā)功率下,方法一的效率明顯高于方法二,說明需要將上轉換納米材料盡可能靠近地放置于光敏通道蛋白的位置,因為光子的功率密度與距離的平方成反比。
(2)將上轉換納米粒子制成微光極。Shi等[57]首先將UCNPs包裝到玻璃微光極中,制成可植入的光轉換器將近紅外能量轉換為可見光,然后刺激具有不同ChRs表達的神經元(圖2c)。這些微型光學器件顯示出極好的長期生物相容性,并且可以遠程控制腦功能的調節(jié),甚至用于復雜的動物行為學操控。
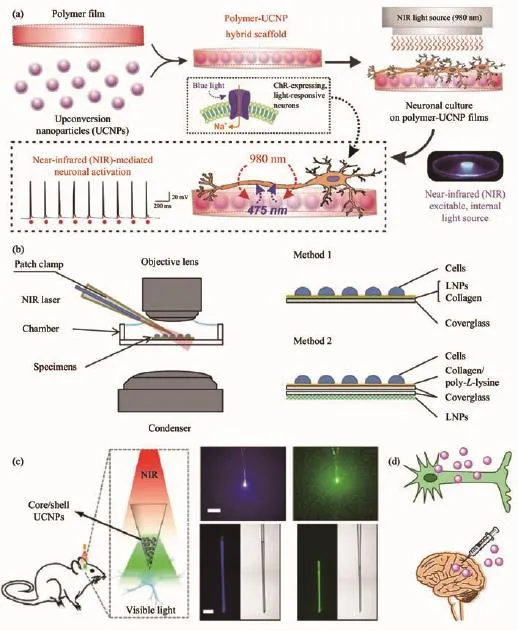
圖2 不同上轉換光遺傳學刺激方法:(a)上轉換納米粒子-聚合物雜合的膜平臺[54];(b)2種上轉換納米粒子調控體系[40];(c)基于上轉換納米粒子的微型光極器件;(d)細胞或組織攝取上轉換納米粒子的示意圖[57]Fig.2 Different optogenetic stimulation platforms:(a)UCNPs-polymers hybrid membrane for cells culture and optogenetic activation[54];(b)Two membrane-based UCNPs systems for optogenetic regulation[40];(c)UCNPs-based optotrode micro-devices;(d)Schematic illustration of UCNPs uptake by cells and tissues[57]
(3)直接利用細胞或生物體組織攝取上轉換納米粒子(圖2d)。該方法在目前研究中最為常用,將功能修飾的上轉換納米粒子與所要調控的細胞孵育,或者直接通過注射的方式進入特定組織器官,待納米粒子被有效攝入后,進行近紅外激光照射并實現(xiàn)光遺傳學調控。這種策略不僅可以達到亞細胞層面的精準光調控,而且在動物體內實驗方面也易于實施。但是,局限也很突出,比如難以操作,生物安全性隱患等方面。
2 近紅外上轉換光遺傳學體系在生物功能調控方面的應用進展
近紅外上轉換納米技術和光遺傳學的結合,從原理上克服了體內常用光遺傳學研究中遇到的局限性,包括激發(fā)光的低穿透性或者光源植入的侵入性,為神經細胞或非神經體系中膜離子通道的調控提供了巨大的機會[32]。這種靈活的光學操控技術在神經科學領域取得了一系列成果,并進一步證明了其更廣泛的適用性(表3)[34,69-70]。考慮到生物的內在復雜性,到目前為止,上轉換光遺傳學及其他調控技術,在詳細闡明基本的生理、病理方面的探索仍然處于最初期階段。因此,下面將著重討論目前在不同生物模型上,采用近紅外上轉換光遺傳學調節(jié)膜離子通道、鈣信號以及相關生物學活性方面的研究進展。
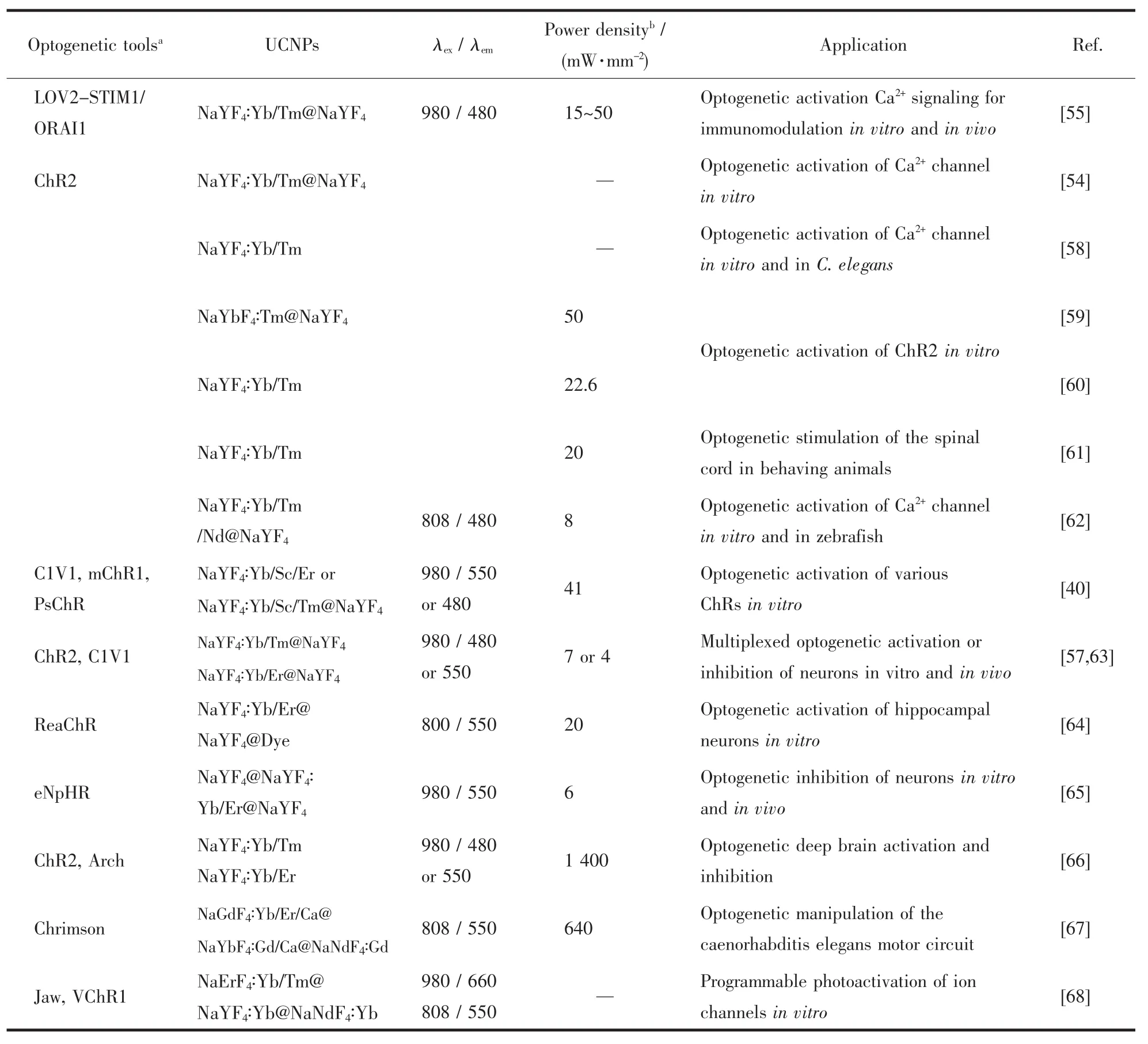
表3 當前上轉換光遺傳學的應用總結Table 3 Summary of current applications of upconversion optogenetics
2.1 神經細胞膜電位
將光活性蛋白用于刺激活化或抑制神經活動是近年來神經學研究中的一大創(chuàng)新。這種光遺傳手段由于具有較低的侵入性并且能夠在時間與空間尺度精確地調節(jié)神經活動,因而在神經學研究中具有較為廣闊的應用前景[23]。
早在2015年,Lee等[54]報道了通過UCNP進行神經調節(jié)的應用。該研究中視紫紅質離子通道蛋白通過生物工程的手段表達于神經元細胞中,在近紅外光(980 nm)的照射下,這些神經元能夠在毫秒范圍內產生持續(xù)的神經脈沖信號。在之后的研究中,科研人員設計并制備了一系列發(fā)光性質不同的UCNPs,用于不同光敏離子通道的活化[15,31]。 譬如,Han等[41]設計制備了IR806染料敏化的UCNP,通過800 nm的近紅外光激發(fā),實現(xiàn)了對紅光響應離子通道(ReaChR)的調節(jié)。實驗中,染料敏化的UCNP被包覆于聚甲基丙烯酸甲酯(PMMA)薄膜中,用于海馬神經細胞的培養(yǎng)。這些神經細胞能夠實現(xiàn)精確的時空調節(jié),以光強度依賴性地方式被激活并產生神經信號。除此之外,在976 nm激發(fā)條件下能發(fā)射綠光(550 nm)的 UCNPs(NaYF4∶Sc/Yb/Er@NaYF4)也 被 用于刺激離子通道C1V1或mVChR1以產生光電流。而對于表達PsChR的神經元,則可以通過發(fā)射藍光的 UCNPs(NaYF4∶Sc/Yb/Tm@NaYF4)實現(xiàn)近紅外光遺傳學刺激。上轉換納米材料可調的光學性質和不同光敏離子通道蛋白的靈活搭配為近紅外光遺傳學體系提供了豐富多樣的選擇,極大地促進了后續(xù)在動物模型上的生理、病理研究。
2.2 鈣信號通路
不同于常見報道的UCNP-ChR體系,Zhou和Han等[55]展示了另一種基于上轉換納米顆粒的近紅外光遺傳學平臺,被稱作“Opto-CRAC”(圖 3a)。 Opto-CRAC在細胞和活體環(huán)境中,通過近紅外光照射而發(fā)出藍光的 UCNPs(NaYF4∶Yb/Tm@NaYF4)作用于經基因工程改造的光敏鈣離子通道蛋白,既可以選擇性地控制細胞內鈣離子的流入以及受此過程調控的基因表達,進而調節(jié)機體的免疫炎癥反應(圖3(b~d))。通過對光信號的調節(jié)(如激光的脈沖、強度),該體系的光遺傳模塊LOVSoc能夠可逆地產生持久且周期變化的鈣離子信號。更為重要的是,Opto-CRAC介導的光致鈣離子信號通路活化可以引發(fā)免疫細胞的特異性生理響應。通過使用近紅外光激活光控-鈣通道,可以促進樹突狀細胞的成熟及抗原的呈遞,進而刺激T細胞的活化。通過這種手段實現(xiàn)了對細胞信號通路進行的精確操作,進而調控下游信號轉導,方便其在動物生理/病理研究中發(fā)揮作用。

圖3 Opto-CRAC(CRAC,Ca2+release-activated Ca2+)體系用于細胞膜鈣離子通道的光遺傳調控[55]:(a)LOVSoc介導的細胞內光致鈣離子內流以及NFAT(nuclear factor of activated T-cells)的核轉移;(b)UCNPs(NaYF4:Yb/Tm@NaYF4)的發(fā)射光譜;(c)親和素修飾的UCNPs與細胞膜表面的ORAI1鈣離子通道相互作用示意圖;(d)通過近紅外光介導的活體內細胞鈣離子內流,進而引發(fā)NFAT依賴的螢光素酶表達Fig.3 Illustration of Opto-CRAC(CRAC,Ca2+release-activated Ca2+)system for optogenetic regulation of membrane Ca2+channel[55]:(a)LOVSoc photoactivation mediated Ca2+influx and NFAT(nuclear factor of activated T-cells)nuclear translocation;(b)UCNPs(NaYF4∶Yb/Tm@NaYF4)luminescence spectra;(c)Specific targeting of streptavidinconjugated UCNPs to engineered ORAI1 channels in the plasma membrane;(d)NFAT-dependent luciferase expression in vivo triggered by NIR light stimulation
此外,斑馬魚活體模型廣泛用于生命醫(yī)藥領域,比如生物造影,診斷治療及生理病理研究[61]。目前,關于近紅外光遺傳學調控在斑馬魚模型中的可行性研究被Xing等[62]報道。該工作巧妙地設計了808 nm激發(fā)的上轉換光遺傳學體系,實現(xiàn)了對離子通道ChR2的調節(jié)以及鈣離子介導的腫瘤細胞命運調控(圖4)。更為重要的是,該體系揭示了在體外和活體條件下,通過近紅外光介導的離子通道的調節(jié)可引起細胞的凋亡,具有進一步在腫瘤治療方面的應用前景。
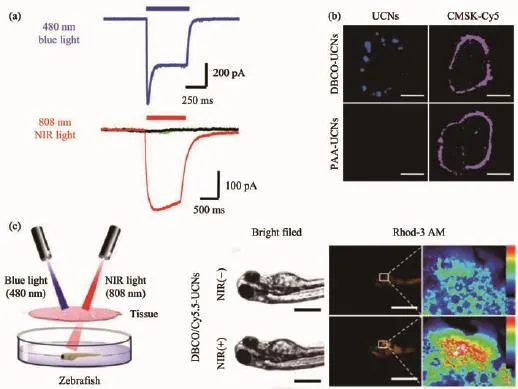
圖4 斑馬魚模型中通過細胞膜靶向的上轉換光遺傳學技術進而實現(xiàn)離子通道的精確調控[62]:(a)細胞表達ChR2以及在可見光及近紅外光照射下產生的電生理;(b)通過糖代謝途徑標記于細胞膜表面的UCNPs成像;(c)近紅外光觸發(fā)的體內ChR2激活以及鈣離子內流(CMSK-Cy5,細胞膜特異性熒光染料)Fig.4 Membrane targeted upconversion optogenetic technique for remote regulation of ion channels in the zebrafish model[62]:(a)Photocurrents in ChR2-expressing cells labeled with UCNPs under NIR and blue light excitation;(b)Imaging of plasma membrane localized UCNPs through glycan metabolic labeling strategy;(c)NIR light excited in vivo ChR2 activation and Ca2+influx(CMSK-Cy5,cell membrane staining fluorescence dye)
2.3 線蟲行為學
除了能對細胞膜離子通道進行有效地調節(jié)外,在改進上轉換光遺傳學研究方面,Zhang等[58]通過利用準連續(xù)波的近紅外激發(fā)手段,提高了上轉換發(fā)光效率并在表達ChR2的線蟲體內成功地實現(xiàn)光遺傳學神經信號及行為學調控(圖5(a,b))。最近的一項研究中,Gao等[67]采用線蟲模型,借助近紅外激發(fā)綠光發(fā)射的UCNP對表達有Crimson光敏離子通道的不同神經元(運動神經元或中間神經元)進行調控,實現(xiàn)了對線蟲多種運動行為的控制(圖5c)。這些工作不僅揭示了增強UCNP的多光子發(fā)光效率的可能性,還通過近紅外光使線蟲產生了受觸動刺激的反應,展現(xiàn)出近紅外光光遺傳學這種非侵入性調控策略在不同活體動物模型應用上的優(yōu)勢和靈活性。
2.4 鼠神經活性及行為學
鼠類模型在生化、醫(yī)藥研究中作為一種最為普遍的動物模型,對于光遺傳學的轉化研究更具價值[30]。盡管深層組織的光學刺激在鼠類模型中很大程度上需要特殊的光學設施,以及復雜的實驗手術操作,但隨著光遺傳學和上轉換納米技術的發(fā)展,通過近紅外光進行小鼠腦部功能的光遺傳學調控已經成為可能。
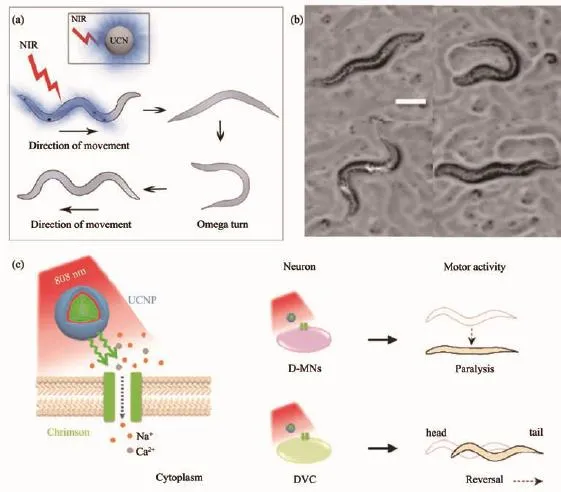
圖5 上轉換近紅外光遺傳平臺實現(xiàn)對線蟲行為學調控[58,67]:機械感受神經元中表達ChR2的線蟲,在標記UCNP后,(a)于近紅外光刺激下產生的不同行為動作及(b)在近紅外光遺傳刺激下表現(xiàn)的轉向動作;(c)通過對Chrimson表達的神經元進行近紅外光刺激,實現(xiàn)線蟲不同運動形態(tài)的調控Fig.5 Upconversion optogenetic manipulation of C.elegans behaviors by NIR excitation[58,67]:(a)Different movement behavior in worms expressing ChR2 in their mechanosensory neurons with NIR light illumination alone(no UCNPs),and(b)NIR light illumination in the presence of UCNPs;(c)Schematic diagram of UCNPs for chrimson-expressing cells activation illuminated by 808 nm NIR light,thereby changing the locomotion behaviors
Shi等[63]報道了一種基于UCNP的微型光極器件實現(xiàn)了遠程光學控制小鼠腦部神經元 (表達有多種視蛋白如ChR2或C1V1)的目標(圖6)。機械激光投射系統(tǒng)通過發(fā)出的近紅外光,可以有效地控制鼠的不同腦部區(qū)域的功能并產生神經脈沖活動,譬如腦部紋狀體,中腦腹側蓋區(qū)以及視覺皮層。值得注意的是,在另一項工作中,Shi等[63]還通過設計制備不同光譜特征的UCNPs,實現(xiàn)了體外與體內條件下,神經細胞的多重刺激或抑制。上轉換光遺傳技術在小鼠神經活動刺激研究中的成功應用,極大地促進了基礎生理調控以及神經科學的發(fā)展。
另外,McHugh及Liu[66]探究了將UCNPs作為光遺傳調節(jié)器以微侵入注射式的方法調控小鼠腦部深層神經元功能的可能性(圖7)。該研究中,近紅外介導的光遺學傳刺激能夠引發(fā)腦部腹側被蓋區(qū)域多巴胺的釋放。在此基礎上,通過刺激腦部內側隔核的抑制性神經元,可以誘導產生神經振蕩。更為重要的是,研究中這種上轉換光遺傳體系還可以抑制癲癇小鼠海馬體中的興奮性神經元,實現(xiàn)記憶恢復,展現(xiàn)了其在神經疾病治療方面的巨大潛力。
除了腦部神經活動調控,上轉換光遺傳體系還被成功地應用于小鼠的脊柱神經調節(jié)并用以控制小鼠的行為活動。Shi等[61]用聚丙烯以及UCNP制成光極器件,植入小鼠脊柱不同部位中(圖8)。這些小鼠在已麻醉的情況下,通過近紅外光的刺激,可以由肌電圖觀測到其腿部肌肉的活動。而自由活動的小鼠,在光的刺激下其運動行為還能被有效地抑制。這種柔性器件與上轉換光遺傳學的結合,還展現(xiàn)出較好的生物相容性。在長達4個月的植入期內未引起明顯的炎癥,適用于動物行為學的長期跟蹤研究。
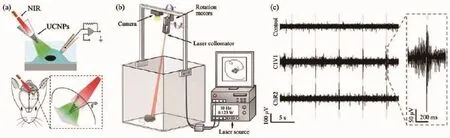
圖6 通過近紅外上轉換光遺傳手段實現(xiàn)的小鼠腦部活動[63]:(a)通過近紅外光光遺傳學平臺在體外和活體條件下對表達ChR的神經元刺激活化;(b)用于對活動小鼠頭部提供近紅外光刺激的自動化激光投射系統(tǒng);(c)由近紅外刺激引起的小鼠腦部(表達ChR2和C1V1)神經脈沖信號Fig.6 NIR upconversion optogenetic control of rat brain activity[63]:(a)NIR stimulation of ChRs-expressing neurons using UCNPs in vitro and in vivo;(b)Robotic laser projection and monitoring systems for automatic and consistent NIR irradiation of the heads of behaving animals;(c)Recordings of spiking trances in neurons in response to NIR illuminations
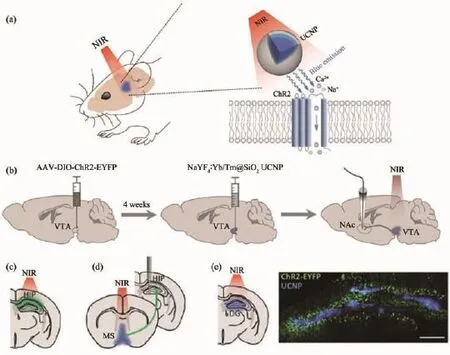
圖7 UCNP介導的腦部深層的近紅外上轉換光遺傳學刺激[66]:(a)發(fā)射藍光的UCNP介導的近紅外上轉換光遺傳在TH-Cre轉基因小鼠表達ChR2的神經元作用原理示意圖;(b)腦部深層組織的AAV-DIO-ChR2-EYFP、UCNP的注射以及近紅外光遺傳刺激示意圖;(c)通過顱部近紅外照射抑制癲癇小鼠腦部海馬區(qū)活動;(d)顱腦近紅外光照射刺激內側隔核以誘導產生神經振蕩;(e)刺激海馬印記細胞實現(xiàn)記憶恢復Fig.7 UCNPs-mediated NIR optogenetics for deep brain stimulation[66]:(a)Illustration of blue emissive UCNPs for NIR optogenetic activation of ChR2-expressing neurons TH-Cre transgenic mice;(b)Scheme of AAV-DIO-ChR2-EYFP and UCNPs injection and NIR optogenetic stimulation in deep brain tissue;(c)Illustration of transcranial NIR inhibition of hippocampal(HIP)activity during chemically induced seizure,(d)medial septum(MS)for generation of θ oscillations and(e)hippocampal engram formemory recall
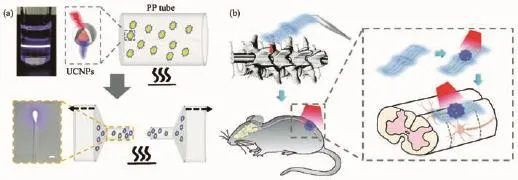
圖8 上轉換光極器件用于光遺傳學脊髓調控[61]:(a)含UCNPs的聚丙烯材料融化拉制成纖維狀的上轉換光極;(b)通過微創(chuàng)手術將上轉換微光極(UCNP-PP-optrode)植入小鼠的脊柱并進行光遺傳學調控Fig.8 Implantable upconversion device for wireless optogenetic stimulation of the spinal cord in behaving animals[61]:(a)Diagram of the UCNPs-optrode fabrication;(b)Illustration of implantation of the UCNP-PP-optrode at the spinal cord of a mouse by minimal invasive surgery
3 近紅外上轉換光遺傳學技術存在的問題及改進策略
盡管上轉換光遺傳學前景廣闊,但目前仍然面臨著納米粒子生物安全性低,近紅外光上轉換效率低,以及持續(xù)照射引起的熱效應顯著等挑戰(zhàn)[32,71]。為了解決這些問題,科學家們已經從各方面入手來改進這項技術,以期實現(xiàn)更高效,更精確地生物功能調控,并進一步使未來的臨床轉化研究成為可能。
3.1 提高上轉換效率
首先,上轉換納米材料的量子效率低是實現(xiàn)有效地光遺傳學調控的最大限制因素。到目前為止,在低于100 W·cm-2的激發(fā)光功率密度下,近紅外到可見光上轉換效率最高僅約為5%,而考慮到實際應用中,生物機體對于輻射暴露的最大允許劑量(例如 980 nm,皮膚組織 MPE(maximum permissible exposure)<1 W·cm-2)的限制,通常上轉換效率會遠遠低于1%[72]。對此,許多研究團隊提出了增強上轉換效率的不同策略,包括合成核-殼結構或表面修飾來控制局部環(huán)境的猝滅效應,利用敏化劑/活化劑來改善能量轉移效率,以及通過激發(fā)光源的工程化來促進光子轉移等[73-74]。
將增強上轉換發(fā)光效率的策略進一步應用于光遺傳學調控的研究已有報道。Shi和Wang研究團隊[65]最近通過合成核-殼-殼納米結構,并優(yōu)化Yb3+離子的摻雜含量,實現(xiàn)了3倍于傳統(tǒng)核-殼結構納米粒子的上轉換發(fā)光增強,并將其進一步開發(fā)為一種可植入的光學傳感器,用于對表達eNpHR氯離子通道的小鼠大腦活性及行為學進行光遺傳學抑制。另外,Prasad等[59]在一項近紅外光遺傳學的工作中應用了新型的核-殼型上轉換納米粒子(NaYbF4∶Tm@NaYF4),這種材料的發(fā)光強度比傳統(tǒng)NaYF4∶Yb/Tm@NaYF4納米體系發(fā)光約高出6倍。此外,Zhang團隊[58]通過使用準連續(xù)波作為激發(fā)光源來進行光遺傳學實驗,不僅提高了上轉換藍光發(fā)射,還降低了潛在的熱效應,從而實現(xiàn)了有效的光遺傳神經調控。
3.2 控制熱效應
利用近紅外上轉換技術可以有效地激活深層組織中的光敏膜離子通道。但應該指出的是,大部分上轉換納米粒子在980 nm激光照射下可能會導致局部組織的熱損傷[72]。為了避免這種熱效應,在實際上轉換光遺傳學調控中,大部分的研究只能通過合理控制激光的功率以及照射時間來控制。除此以外,將上轉換激發(fā)波長從980 nm移至800 nm,在很大程度上降低了機體組織水的熱響應,可以極大地減少激光引起的熱刺激[75]。例如,在Han等[64]的報道中,使用染料敏化的核/殼結構上轉換材料,可以在800 nm近紅外光照射下激活海馬神經元中的離子通道蛋白(ReaChR)。
3.3 改善生物相容性
在生物醫(yī)學乃至臨床應用中,無機金屬納米材料在體內的生物相容性或潛在毒性是一個重要的問題[76]。迄今為止,尚無詳盡的報道涉及上轉換納米粒子本身或用于表面功能化的相關試劑和配體的刺激性及長期毒性的研究,如免疫反應和誘變作用。但可以證實的是,上轉換納米材料的形貌尺寸、化學組成及表面修飾都影響其在體外和體內的安全性[76-80]。有一些常規(guī)的策略可以在一定程度上降低上轉換納米體系的毒性,比如制備超小尺寸納米粒子(<10 nm)以增強生物清除率[81];選擇合適的配體進行表面修飾,例如聚乙二醇(PEG)、二氧化硅(SiO2)等安全性高的生物功能修飾劑;再者,通過增強上轉換發(fā)光進而降低納米材料的使用濃度,也是一種解決劑量依賴的毒性問題行之有效的方法[82-83]。另一方面,由于生物體本身沒有光遺傳學工具,而通過病毒或聚合物的基因轉染手段在體內表達光敏蛋白也具有一定的安全性顧慮。
3.4 實現(xiàn)特異性調控
盡管通過上轉換光遺傳學在神經元或非神經元調節(jié)方面取得了初步成功,但是目前在實際應用中光控生理功能的效率還受限于調控的精確性。主要表現(xiàn)在以下幾個方面:
(1)光遺傳學工具的離子選擇性。目前廣泛使用的光敏感視紫紅質蛋白,尤其是陽離子通道蛋白(例如ChRs),其激活后對Ca2+、Na+或K+等的細胞內流缺乏選擇性,因此難以做到精準控制生理信號。對于如何解決離子選擇性問題,有以下兩種可能的策略:一是對已有的ChRs進行基因工程改造,得到具有高離子選擇性的突變體,但至今還鮮有相關報道;二是結合其他現(xiàn)有的光遺傳學技術,構建離子選擇性好的光遺傳學工具。例如,基于特異性的Ca2+通道激活釋放的光遺傳學平臺(Opto-CRAC),在體外和體內都體現(xiàn)出優(yōu)秀的 Ca2+信號調節(jié)能力[55,84];另外,近年來報道的熱敏離子通道(TRPs)也極具潛力,有望實現(xiàn)高選擇性的Ca2+信號調控。
(2)光遺傳學調控的細胞/組織特異性。許多在細胞層面上的光遺傳學研究表明,上轉換納米轉換器盡可能地靠近膜離子通道蛋白,可顯著提高光子能量轉移的效率,對調控效果產生重要影響。目前已報道了不同的策略,被用于將上轉換納米粒子盡可能特異地連接在光敏蛋白表達的細胞膜上(圖9)。其中包括抗原-抗體結合的策略,將UCNPs定位于細胞表面,還可以通過糖代謝標記技術來共價連接。
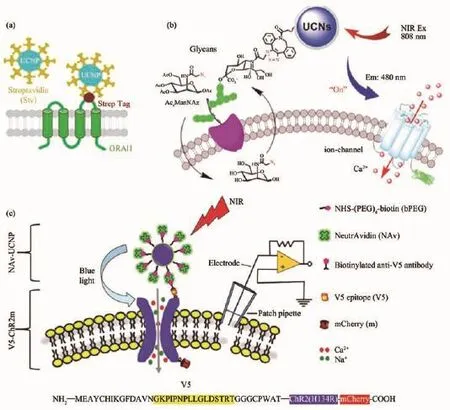
圖9 幾種細胞膜連接上轉換納米粒子用于精準光遺傳學調控的策略:(a)基于親和素-生物素系統(tǒng)將上轉換納米材料與光敏蛋白ORAI1連接[55];(b,c)基于糖代謝以及親和素-生物素的方法將上轉換材料在細胞膜標記用于 ChR2 活化[60,62]Fig.9 Different plasma membrane labeling strategies for precise upconversion optogenetic manipulation:(a)Biotin-streptavidin interaction mediated UCNPs-ORAI1 labeling strategy[55];(b,c)Glycan metabolic and biotin-streptavidin labeling strategies[60,62]
而在動物層面,目前通過使用靶向的光基因遞送技術,如細胞/組織特異性慢病毒感染等可以實現(xiàn)特異性的光遺傳學調控[85-87]。但在實際的神經科學領域應用中,需要借助于腦定位注射來實現(xiàn)精確光遺傳學基因及上轉換納米體系在目的組織區(qū)域表達。由于大腦結構的復雜性,很難保證操作的精準度,這在光遺傳學研究中也是一個很大的挑戰(zhàn)。
(3)納米粒子靶向性。除此以外,上轉換納米粒子的靶向能力是遠程調控細胞/組織特異性離子通道的另一個限制因素[88-89]。例如,在深層腦區(qū)的光遺傳學操作中,納米粒子難以有效通過血腦屏障(BBB),因而只能通過注射的方法來輸送上轉換納米顆粒。這種策略不僅增加了創(chuàng)傷性,還有可能引入一些潛在的不良反應。因此,開發(fā)完全無創(chuàng)的、可血液遞送的上轉換納米平臺,進而能夠用于腦部的近紅外光遺傳學體系將是未來研究的一大方向。
3.5 標準化上轉換光遺傳學設備
最后,除了對上轉換納米轉換器和光遺傳學工具的改進之外,可靠的光學調控儀器以及信號記錄設備在實際的上轉換光遺傳學應用也亟待開發(fā)。迄今為止,用于上轉換材料光學表征的大多數(shù)儀器都是實驗室個人定制。此外,在動物模型中用于近紅外激光介導的光遺傳刺激、監(jiān)測的專用儀器也非常有限[90-91]。因此,目前的上轉換光遺傳學研究的穩(wěn)定性和重復性還不盡人意,亟待研發(fā)商用的、標準化的儀器(例如光譜儀,刺激器,顯微成像系統(tǒng)及膜片鉗設備等)。總體而言,由于近紅外上轉換光遺傳學是一個多學科、高度交叉的領域,學術界和工業(yè)界的任何建設性合作與整合都將有利于該技術的轉化應用。
4 總結與展望
總之,通過將上轉換納米材料作為光轉換器,與光遺傳學體系結合起來,新興的上轉換光遺傳學平臺可實現(xiàn)對膜離子通道的近紅外操控。并且該技術具有更深的組織穿透力,更高的時空分辨率和低的創(chuàng)傷性,克服了傳統(tǒng)光遺傳學在活體研究中遇到的問題。盡管上轉換光遺傳學具有廣闊的前景,并已被廣泛應用于神經活性、行為學調控,甚至疾病的治療。但目前在實踐中依然存在著局限,比如上轉換效率低、熱效應明顯和特異性不足等。鑒于此,研究者們也做出了巨大的努力來不斷地克服這些問題。我們相信,這項強大的化學生物學技術將加深我們對離子通道的生理和相關病理方面的理解,并為神經系統(tǒng)疾病及其他威脅生命的重大疾病的治療開辟新的方向。
- 無機化學學報的其它文章
- 《無機化學學報》投稿須知(NOTICE TO AUTHORS)
- An N-Alkylated 2-(5-Bromo-4-methylthiophen-2-yl)-imidazo[4,5-f]-[1,10]-phenanthroline Rhenium(Ⅰ)Tricarbonyl Compound Showing Aggregation-Induced Emission Enhancement
- Syntheses,Structures and Magnetic Properties of Manganese Phosphonates
- Two Zn(Ⅱ) and Cd(Ⅱ) Metal-Organic Frameworks with Mixed Ligands:Synthesis,Structure,Sorption and Luminescent Properties
- Syntheses and Crystal Structures of Two Copper Complexes Based on Quinolyl and Pyridyl Substituted Triaryltriazoles
- Plasma-Assisted Fabrication of Ferroelectric Flakes with Single-Unit-Cell Thickness and Characterization of Ferroelectricity

