錳(Ⅱ)配合物發光材料與器件研究進展
吳 越 楊 明 王金云 陳忠寧*,
(1中國科學院福建物質結構研究所,結構化學國家重點實驗室,中國福建光電信息科學與技術創新實驗室(閩都創新實驗室),福州 350002)
(2中國科學院大學,北京 100039)
0 引 言
發光材料在能源[1]、傳感[2]和顯示[3]等領域具有極其重要的應用價值。鑒于稀土離子展現f-f躍遷窄譜帶和高色純度發光,稀土化合物及摻雜體在光致發光領域得到了廣泛應用,但稀土材料目前仍然難于為我們提供高效率的電致發光。另一方面,Ir(Ⅲ)[4]、Pt(Ⅱ)[5]、Ag(Ⅰ)[6]和 Au(Ⅰ)[7]等貴金屬發光材料展現較高的發光效率,特別是環金屬化Ir(Ⅲ)配合物以其高效率發光及出色的穩定性等優點在照明和顯示領域得到了商業應用。然而,這些貴金屬地殼豐度極低且儲存量有限且生產成本昂貴,越來越難于滿足全球照明和顯示等產業領域巨大的市場發展需求。近年來,科學家們已經提出了解決此問題的兩種方案。一是設計合成熱活化延遲熒光有機材料,可以實現三重激發態到單重激發態間的反系間竄越并充分利用單重態和三重態激子,實現高效發光[8-9];二是開發廉價金屬配合物發光材料。近年來,大量研究表明某些Cu(Ⅰ)[10-12]和Pb(Ⅱ)[13]配合物展現了出色的發光性能,然而Cu(I)配合物光熱穩定性較差,Pb(Ⅱ)配合物毒性極大。因此,尋找具有低廉成本、高效發光、高穩定性而且低毒的替代品顯得尤為重要。
與磷光貴金屬化合物以及Cu(Ⅰ)和Pb(Ⅱ)等發光材料相比較,Mn(Ⅱ)化合物具有廉價、高效發光、高熱穩定性以及低毒等優勢,有望成為傳統發光材料的替代品,因此近年來引起了人們濃厚的研究興趣。Mn2+具有5個單電子,分別占據5個3d軌道,屬于3d5電子結構。分析Tanabe-Sugano圖可以確定Mn(Ⅱ)配合物的寬發射峰來源于自旋軌道禁阻的d-d躍遷(4T1→6A1),其發光特性主要取決于配體及其配位晶體場。由于Mn(Ⅱ)配合物主要呈現四配位和六配位,其配位場主要為四面體場和八面體場,通常情況下,八面體的場強度要大于四面體場強,具有較大的場分裂能,使其激發態能量較低。通常八面體場Mn(Ⅱ)配合物發射橙光[14]或紅光[15-17],而四面體場Mn(Ⅱ)配合物發射綠光[18-20]。若與特定的有機配體配位,Mn(Ⅱ)也可呈現三配位、五配位、七配位甚至八配位,配位數的多樣化也可導致發光性質的多樣化,從而可通過改變配體來調控發光顏色。
基于國內外學者近年來對發光Mn(Ⅱ)配合物的研究成果,本文將對Mn(Ⅱ)配合物的磷光性質及其材料與器件的研究進展進行綜述,并展望其發展前景。
1 無機-有機雜化Mn(Ⅱ)發光材料
1.1 Mn2+摻雜的發光化合物
在無機固體材料中摻雜一定比例的Mn2+是提高發光效率并實現色度調控的一種重要的方法。Feng等[21]設計并合成了核殼納米簇Mn@CdS@InS,通過改變Mn2+與金屬離子的比例得到具有不同發光強度的結構,證實了Mn2+離子的引入對于核殼納米簇發光增強有很大影響。Luo等[22]報道了一例鉛鹵化物(C5H14N2)2Pb5Cl14,室溫下發光微弱。但在結構中引入Mn2+取代部分Pb2+離子后得到雜核金屬鹵化物(C5H14N2)2Pb4MnCl14,其發光量子產率可以提高到32%。摻雜Mn2+不僅可以增加發光強度,還可以實現調控發光材料的發射波長。Yan等[23]通過離子交換的方式將Mn2+(客體離子)引入到MOF材料中,得到具有主客體結構的Mn2+@AMOF-1材料,隨著客體離子Mn2+比例的增加,Mn2+@AMOF-1材料的發射波長發生明顯變化 (圖1a),(AMOF-1發射波長為410 nm,Mn2+在650 nm產生新的發射峰)其發光顏色可以從綠色到藍色、紫色、白色、黃色、橙色,然后到紅色的全色段變化(圖1b)。Mn2+影響主客體體系中電荷轉移及軌道能量分布,從而提高了AMOF-1材料的室溫超長磷光壽命。鑒于Mn2+摻雜的發光材料可以調控發光顏色,可以將其應用到白光電致發光器件(white light-emitting diodes,WLEDs)的制備中。 近年來,WLEDs器件的研究愈加廣泛[24]。然而,目前Mn2+摻雜的金屬離子發光化合物大多數都含有Cd(Ⅱ)和Pb(Ⅱ)等對人體有害的重金屬離子,從長遠發展來講,環境友好型的廉價金屬發光材料具有更重要的應用價值[25],更加能夠引起研究興趣。
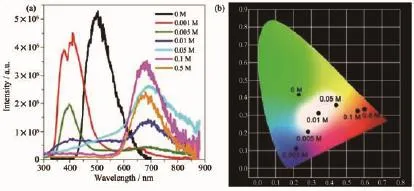
圖1 (a)激發波長為250 nm時,不同Mn2+摻雜濃度下,Mn2+@AMOF-1的超長磷光(LLP)光譜圖;(b)與發射相應的CIE色坐標圖[23]Fig.1 (a)Long-lasting phosphorescence(LLP)emission spectra of Mn2+@AMOF-1 with different Mn2+concentrations under irradiation at 250 nm and corresponding(b)CIE chromaticity diagram[23]
1.2 有機-無機雜化鹵化錳(Ⅱ)配合物
Mn2+摻雜類發光材料,雖然在一定程度上可以達到增強發光的效果,但是摻雜比例過高或過低都會嚴重影響發光強度,難于把握一定的尺度。具有一定組成比例的有機-無機雜化鹵化錳(Ⅱ)配合物通常具有較強的發光效率,在光致發光[26]、電致發光[18]、力致發光[27-28]和鐵電性質[15-17,19]等領域占據重要席位。有機-無機雜化鹵化錳(Ⅱ)配合物通常設計簡單、易于合成且具有很好的穩定性。Xiong等報道了一系列具有鈣鈦礦構型的AMnX3(A為有機陽離子,X為鹵素離子)配合物(Pyrrolidinium)MnBr3(1)、(Pyrrolidinium)MnCl3(2)和(3-Pyrrolinium)MnCl3(3)[15-17]。 這些配合物的Mn2+都屬于六配位的八面體構型,具有高效率的紅光發射及出色的鐵電性質。配合物1、2和3最大發射峰分別在635、640和640 nm,發光壽命分別為333.6、515和157 μs,發光機理歸屬于d-d電子躍遷(t2g)3(eg)2→(t2g)4(eg)1。它們在室溫下擁有很強的紅發發射,發光量子產率分別為28.2%、53.6%和28.5%。這一系列AMnX3配合物是非常好的發光鐵電材料,圖2、3和4分別顯示了配合物1、2和3的結構以及發光性能。
Huang等[26]設計合成了2種相似有機陽離子N-丁基-N-甲基吡咯烷鎓{[P14]+}和N-丁基-N-甲基哌啶{[PP14]+}的Mn2+配合物(圖5a),具有典型的綠光發射(圖5b)。結構相似的2個Mn(Ⅱ)配合物發光量子產率卻差別較大(圖5c),主要因為配合物[(P14)+]2[MnBr4]2-(4)比[(PP14)+]2[MnBr4]2-(5)具有更強的Br…H氫鍵作用(如圖5d所示),降低了非輻射躍遷能量的損失。這也能夠說明穩定的分子結構(剛性分子)有助于提高發光材料的量子產率。
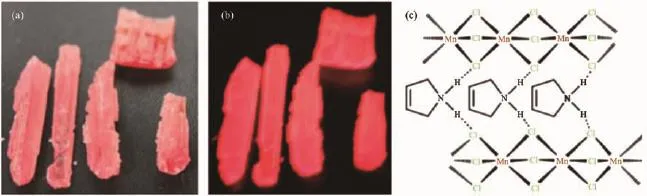
圖2 (a)在可見光下,配合物1的顏色;(b)紫外燈照射下,配合物1的發光顏色;(c)配合物1的結構示意圖[15]Fig.2 (a)Picture of crystals of compound 1 under ambient light;(b)Images of compound 1 under UV light;(c)Structural diagram of compound 1[15]
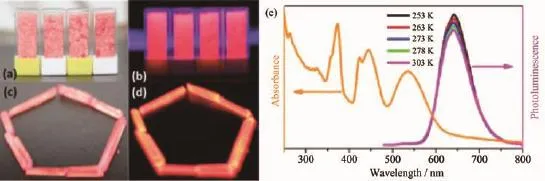
圖3 (a,c)可見光下配合物2的顏色;(b,d)紫外光照射下,配合物2的發光情況;(e)配合物2的室溫吸收光譜與變溫發射光譜[16]Fig.3 (a,c)Crystals of 2 under ambient light;(b,d)Crystals of 2 under UV light;(e)Absorption spectrum at ambient temperature and emission spectra of 2 at different temperatures[16]
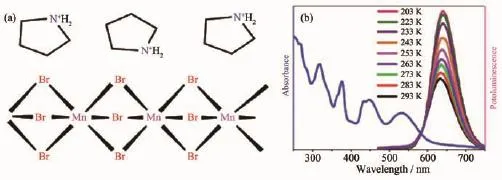
圖4 (a)配合物3的分子結構;(b)配合物3的室溫吸收光譜與不同溫度下的發射光譜[17]Fig.4 (a)Structural diagram of compound 3;(b)Absorption spectrum at ambient temperature and emission spectra of 3 at various temperatures[17]
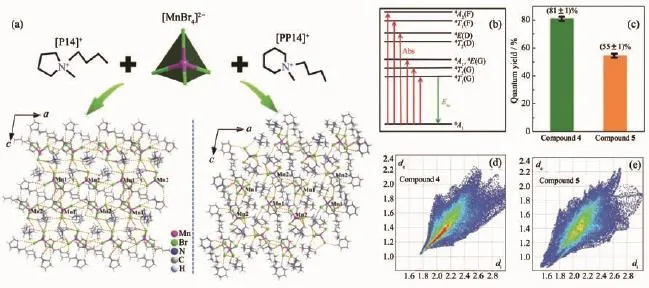
圖5 (a)配合物4和5的結構組成及各自的3D結構堆積圖;(b)四面體構型的Mn(Ⅱ)配合物電子吸收、躍遷以及發射過程示意圖;(c)配合物4和5的量子產率;(d)配合物4的二維指印圖;(e)配合物5的二維指印圖,顏色越深,表示氫鍵相互作用越強[26]Fig.5 (a)3D packing diagrams for 4(left)and 5(right)with anions[MnBr4]2-and organic cations in 4 and 5,respectively;(b)Diagram of the energy adsorption,migration,and emission processes of the tetrahedral Mn(Ⅱ)complexes;(c)Phosphorescence quantum yields for 4 and 5;(d)2D fingerprint plots of compound 4;(e)2D fingerprint plots of compound 5;More intense color,the stronger H-bonding interaction[26]
通過調控有機-無機雜化Mn(Ⅱ)配合物中的有機陽離子或鹵素原子,從而改變Mn(Ⅱ)離子的配位環境實現發光性質的多樣化。改變有機陽離子與鹵化錳的反應配比可以得到不同構型的配合物,吡啶基有機陽離子與溴化Mn(Ⅱ)按不同配比得到2個不同構型的配合物C10H12N2MnBr4(四面體配位場)和C5H6NMnBr3(八面體配位場)[29],分別發射綠光和紅光。保持有機陽離子不變,改變鹵素原子(氯、溴和碘)種類,同樣可以獲得具有多種構型的Mn(Ⅱ)配合物[30],相應的光物理性質也會有很大差別。
理論與實驗研究表明,Mn(Ⅱ)配合物的發光產生于自旋軌道禁阻的d-d躍遷(4T1→6A1),其發光性質取決于晶體場的類型與強度,其中四面體場主要發射綠光,而八面體場主要發射橙光或紅光。然而,在少數情況下,四面體晶體場的配合物也會發射紅光。Zhang等[31]報道配合物(N-methylpiperidinuium)MnCl4(6)和(N-methylpyrrolidinuium)MnCl4(7)(圖 6a 和 6b)都是四面體配位構型,但室溫下分別發射綠光和紅光(圖6c和6d)。Mn(Ⅱ)四面體構型呈現紅光發射屬于反常現象,需要更多實驗和理論計算研究以澄清其發光機理。
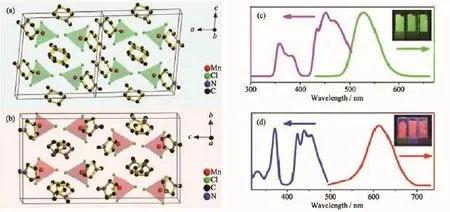
圖6 配合物6(a)和7(b)的三維結構堆積圖;配合物6(c)和7(d)激發發射光譜以及紫外光照射下對應配合物的發光顏色圖片[31]Fig.6 Packing diagram structures of 6(a)and 7(b),all hydrogen atoms are omitted for clarity;Excitation and emission spectra of 6(c)and 7(d)and the powder pictures under UV light[31]
1.3 氮、氧配體Mn(Ⅱ)螯合物
Mn2+離子對氧、氮原子有很強的親和力,由于具有較強的配位能力,氮、膦氧類配體可以螯合Mn2+得到穩定的Mn(Ⅱ)配合物[32-35]。螯合物對光熱穩定性好,發光效率高,因為多數螯合物的剛性較大,有利于減少非輻射躍遷能,增強發光效率。Zheng等[20]以DPEPO為配體合成了一系列含有氯、溴和碘的電中性四面體Mn(Ⅱ)配合物[MnX2(DPEPO)]{DPEPO=雙[2-(二苯基膦基)苯基]醚氧化物,X=Cl(8),Br(9)和 I(10)}。其最大發射峰在 505~530 nm 之間(圖 7a),3 個配合物都具有較高的量子產率,其中[MnBr2(DPEPO)]具有最高量子產率(70%)。DPEPO配體很好地起到螯合穩定作用,減少分子熱振動,降低了非輻射能損失。除此之外,配體還具有“天線”功能,DPEPO配體的三重態能量高于Mn2+(圖7b),吸收紫外光之后將能量傳遞給Mn2+,通過d-d躍遷 (4T1→6A1)產生高亮的綠光發射。
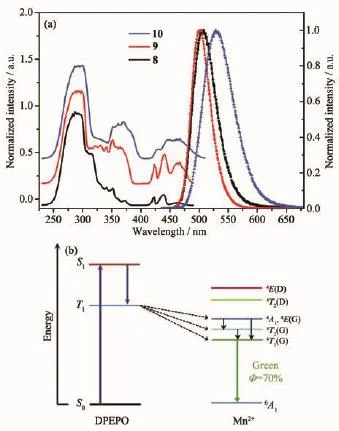
圖7 (a)室溫下配合物8~10固體激發(左)以及發射光譜(右)(303 nm激發);(b)Mn(Ⅱ)配合物的能量吸收、電子躍遷及發射過程示意圖[20]Fig.7 (a)Solid-state excitation spectra(left)and emission spectra(right)under irradiation at 303 nm for compounds 8~10 measured at 298 K;(b)Schematic diagram of the energy adsorption,migration and emission process of the Mn(Ⅱ)complexes[20]
不同的螯合配體對Mn(Ⅱ)的配位環境以及配位數的影響很大,甚至同一配體由于配位形式的多樣化產生了不同構型的Mn(Ⅱ)配合物[38]。有機-無機雜化Mn(Ⅱ)配合物發光主要是Mn2+離子d-d躍遷產生的,產生單一的寬發射峰;而有機螯合配體與Mn(Ⅱ)形成的配合物可以產生電荷轉移躍遷。如圖8a所示,Bushuev等[39]合成具有四齒氮配體的六配位Mn(Ⅱ)配合物[MnL2Cl2]·H2O[L=4-(3,5-二苯基-1H-吡唑-1-基)-6-(哌啶-1-基)嘧啶](11)。不同的激發波長對應不同的發射峰,從 380、440到 495 nm(圖 8b)。380和440 nm發射峰來源于π→π*和n→π*配體內的電子躍遷,位于495 nm處的發射峰壽命達到微秒級,這要歸屬于d-d躍遷、金屬到配體或鹵素到配體的電荷轉移躍遷。通常有機配體發射藍光,Mn2+離子發射綠光或紅光,因此通過調節激發波長有望得到白光材料。目前,在本研究組的研究工作中,發現了類似的配合物,配體發射的藍光和金屬離子發射的紅光復合形成白光。此外,Mn(Ⅱ)配合物的配位數還有五配位[40]和七配位[41],例如冠醚類Mn(Ⅱ)螯合物能夠形成七配位的Mn(Ⅱ)配合物,豐富了Mn(Ⅱ)配合物的配位幾何構型。
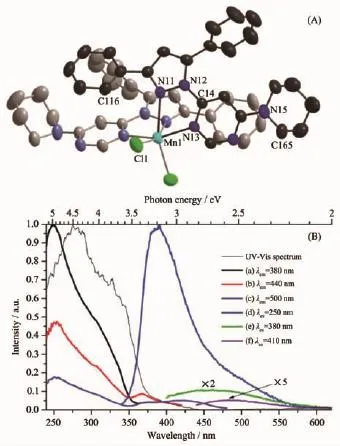
圖8 (A)配合物[MnL2Cl2]單晶結構的熱橢球形式,為精簡結構省去氫原子;(B)300 K溫度下,配合物 11 的激發(a、b、c)、發射(d、e、f)以及紫外吸收光譜[39]Fig.8 (A)Single crystal structure of the six-coordinated[MnL2Cl2]with thermal ellipsoid plot,hydrogen atoms are omitted for clarity;(B)Normalized excitation,emission and UV-Vis spectra of polycrystalline 11 at 300 K:λex=250 nm(a),380 nm(b)and 410 nm(c);λem=380 nm(d),440 nm(d)and 495 nm(f)[39]
2 發光變色Mn(Ⅱ)配合物
發光變色是指發光材料在機械力、溫度、蒸汽等外界刺激下產生發光變化響應的一種現象。刺激發光變色材料在光傳感器和防偽等領域具有重要應用價值。從前文敘述可知,Mn(Ⅱ)配合物的發光基于d-d躍遷(4T1→6A1),在外界刺激作用(壓力、蒸汽和溫度)下,Mn(Ⅱ)的晶體場可能發生改變,并直接影響其光物理性質,可實現發光顏色的可逆轉換與調控。配位構型多樣化導致不同的光物理性質,相關材料在熒光傳感領域具有較好的應用前景,引起了人們極大的研究興趣。
某些Mn(Ⅱ)配合物在外界壓力的作用下,晶體結構發生微小的畸變[36]或配位幾何構型較大的轉變[37]都可能會引起發射波長移動。Nataf等發現在外界壓力不斷增大過程中,有機-無機雜化四面體配合物 A2MnX4(A:[CH3]4N;X:Cl,Br)的發射波長發生明顯的紅移[37]。對于配合物[(CH3)4N]2MnBr4來說,當壓力為0.03、1.4和2.9 GPa時,對應的發射波長分別為520、530和550 nm。仔細檢查發射光譜圖發現,當壓力為2.9 GPa時,在650 nm左右還出現了新的發射峰(圖9c)。對比不同壓力下的粉末衍射圖不難發現,配合物逐漸從晶態向無定型轉變,而且伴隨著新的衍射峰出現(圖9b)。發射光譜和粉末衍射實驗證明配合物在高壓下可能發生分解,實現四配位到六配位構型的轉變。遺憾的是,目前不能通過XRD實驗確定高壓下配合物的組成及其晶體結構,因此這一結論有待于進一步證實。
近幾年,本研究組在Mn(Ⅱ)磷光變色領域取得了系列研究結果,利用雙膦氧配體Ph2(O)PXP(O)Ph2(X=(CH2)n,n=1,2,3;pyridyl) 設計合成了一系列具有四面體(四配位)、三角雙錐(五配位)和八面體(六配位)幾何構型的Mn(Ⅱ)寡核配合物和配位聚合物,室溫下固體呈現藍綠、綠、黃、橙、紅等顏色的磷光發射。發光顏色和能量取決于配體場(晶體場)類型和強度,且Mn(Ⅱ)配位場對溫度、有機蒸汽和機械力等外界刺激相當敏感,導致非常顯著的熱致磷光變色、蒸汽磷光變色和機械磷光變色等特殊的響應發光變色現象。這些研究結果豐富并推動了Mn(Ⅱ)配合物光化學和光物理實驗與理論的發展。
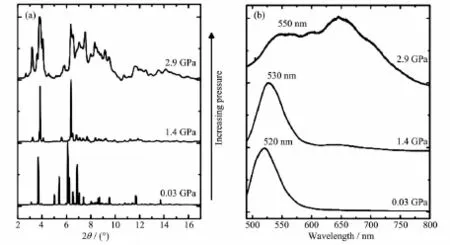
圖9 (a)配合物[(CH3)4N]2MnBr4在不同壓力下(0.03、1.4和2.9 GPa)的PXRD圖;(b)配合物[(CH3)4N]2MnBr4在不同壓力(0.03、1.4和2.9 GPa)下的發射光譜圖[37]Fig.9 (a)PXRD patterns of complex[(CH3)4N]2MnBr4under various pressures(0.03,1.4 and 2.9 GPa);(b)Emission spectra of complex[(CH3)4N]2MnBr4under various presure(0.03,1.4 and 2.9 GPa)at ambient temperatures[37]
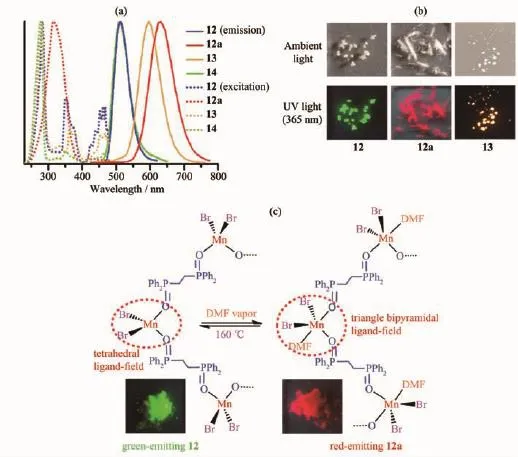
圖10 (a)化合物12、12a、13和14在固態下的激發(點線)和發射(實線)光譜;(b)化合物12、12a和13的晶體在可見光和365 nm紫外光照射下的照片;(c)配合物12和12a相互轉化的結構示意圖及365 nm紫外光下的發光照片[38]Fig.10 (a)Excitation(dot line)and emission(solid line)spectra of 12,12a,13 and 14 in solid states;(b)Photographs of the crystals of 12,12a and 13 upon irradiation at ambient and 365 nm light;(c)Reversible transformation between green complex 12 and red complex 12a together with luminescent images of 12 and 12a upon irradiation at 365 nm[38]
利用二齒膦氧配體 1,2-雙(二苯基膦氧)乙烷(dppeO2)與溴化錳(Ⅱ)在不同的反應條件下得到四種構型各異的配合物[MnBr2(dppeO2)]n(12)、[MnBr2(dppeO2)(DMF)]n(12a)、[Mn(dppeO2)3][MnBr4](13)以及Mn2Br4(dppeO2)2(14)[38]。圖10顯示了它們的發射光譜、激發光譜和發光照片。其中12、12a和14是動力學產物,在質子溶劑作用下能夠轉化為更穩定的離子型熱力學產物13。dppeO2在配合物12、12a和14中橋聯Mn(Ⅱ)原子,而在13中與Mn(Ⅱ)原子雙齒螯合形成七元配位環。12和12a為一維鏈狀結構,Mn(Ⅱ)分別呈現四面體和三角雙錐配位幾何構型,分別發射綠光(12)和紅光(12a);離子型化合物13是由八面體構型的陽離子[Mn(dppeO2)3]2+和四面體構型的陰離子[MnBr4]2-組成,呈現橙光發射;化合物14是一個雙核Mn(Ⅱ)配合物,呈現四面體構型,發射綠光。X射線粉末衍射實驗研究發現,動力學產物12和14在水蒸汽及甲醇、乙醇蒸汽下能夠轉變為更穩定的熱力學產物13,導致綠光到橙光的轉變。有趣的是,配合物12在DMF蒸汽作用下轉變為12a,發射波長從510 nm紅移至630 nm(圖10a),發光顏色由綠色變為紅色 (圖10b)。在高溫加熱條件下,配合物12a又可逆地轉化為12。單晶結構顯示,12和12a的可逆轉化經歷了從四面體到三角雙錐構型的相互轉換(圖10c),配體場的改變是引起發光變化的根本原因。經歷數次循環測試,它們的發光強度無明顯衰減,是一種穩定的蒸汽發光變色傳感材料。
與dppeO2相比,1,3-雙(二苯基膦氧)丙烷(dpppO2)分子尺寸更長,結構柔性更大,通常只橋聯配位而難于螯合配位Mn(Ⅱ)原子。dpppO2配體與MnBr2在不同的反應條件下得到2種構型的配合物[Mn(dpppO2)Br2]n(15)和[Mn2(dpppO2)4Br2]Br2·4CH3OH(16)[42]。配合物15呈現一維鏈狀結構,Mn(Ⅱ)為四配位,呈現四面體結構,發射綠光;配合物16是由4個dpppO2配體橋聯2個Mn(Ⅱ)原子形成的環狀配合物,擁有較大的分子空腔,可以容納幾個甲醇分子。甲醇分子與該Mn(Ⅱ)配位分子形成較強的O-H…O氫鍵作用。如圖11所示,化合物15暴露在甲醇蒸汽中,發生分子間重排形成16,同時最大發射峰從514 nm紅移到634 nm,伴隨著綠光到紅光的轉變;反過來,配合物16在150℃條件下失去甲醇后,整個分子結構坍塌重排形成配合物15,發光顏色又變回到綠光,由此實現了配合物15和16之間的相互轉化。將配合物15摻雜在PMMA中制成薄膜,實現了蒸汽和溫度雙向可逆調控磷光顏色。
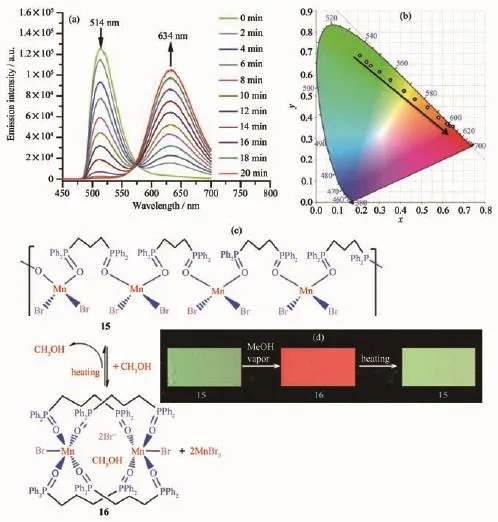
圖11 (a)15在甲醇蒸汽下的磷光發射光譜變化;(b)甲醇蒸汽作用下,15轉化為16過程中,色坐標(CIE)的變化趨勢;(c)配合物15和16可逆轉換的示意圖;(d)甲醇蒸汽作用下,配合物15轉變為16,隨后在150℃下加熱恢復到15的PMMA薄膜發光圖片[42]Fig.11 (a)Phosphorescence emission spectra change and(b)Variation in CIE colour coordinates diagram for 15 upon exposure to MeOH vapor;(c)Reversible conversion diagram of complexes 15 and 16;(d)Luminescence images in the conversion of 15 to 16 upon exposure to methanol vapor and then the reverting to 15 by heating at 150℃[42]
Zang等[43]以有機胺作為陽離子,合成了有機-無機雜化配合物(C4NOH10)5Mn2Cl9C2H5OH(17)和(C4NOH10)2MnCl4(18)。乙醇分子存在于(C4NOH10)5Mn2Cl9·C2H5OH(17)的晶格中,與鹵素形成分子間作用。加熱條件下,17失去乙醇同時分子結構發生重排,形成配合物18,同時八面體場轉變為四面體場(圖12a),實現了發光顏色從紅光到綠光的轉變(d-d躍遷(4T1→6A1)),而且60 s內完成紅光到綠光的完全轉變(圖12b),響應相當迅速。作為傳感器,響應時間是關鍵的性能指標,配合物18具有成為磷光傳感器的潛質。
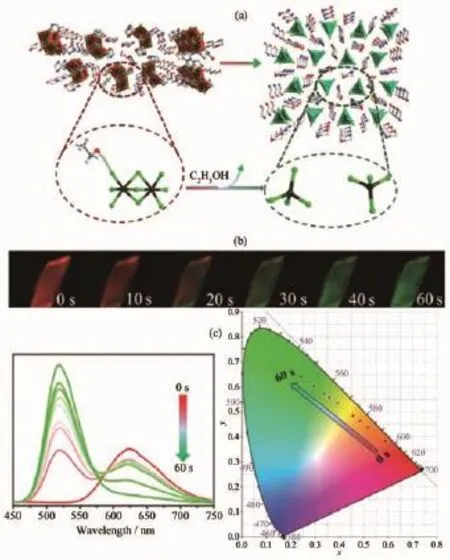
圖12 (a)配合物17到18的轉化反應過程;(b)在90℃加熱條件下,配合物的熱致變色性質及晶體發光顏色;(c)在90℃加熱條件下,磷光發射光譜以及CIE色坐標變化情況[43]Fig.12 (a)Reaction of the transition process from compound 17 to 18;(b)Time-dependent PL images of thermochromic luminescence for compound 17 under heating at 90℃;(c)Change of phosphorescent emission spectra and CIE colour coordinate diagram for compound 17 under heating at 90℃[43]
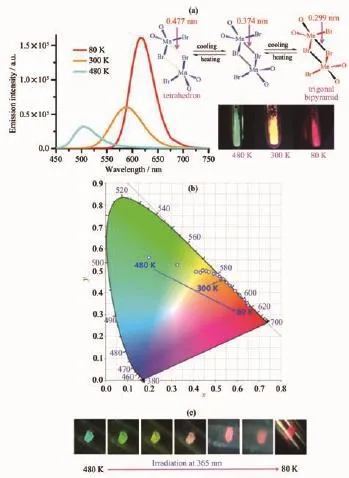
圖13 (a)配合物19在80、300和480 K溫度時的發射光譜、發光顏色和相鄰兩條一維鏈之間的Mn-Br間距,顯示Mn-Br距離隨著溫度的降低而不斷縮短;(b)不同溫度下發光顏色對應的CIE色坐標;(c)在365 nm照射下單晶發光顏色漸變圖[44]Fig.13 (a)Emission spectra,luminescent colors and Mn-Br distances between two adjacent chains for complex 19,showing gradually reduced Mn-Br distances between two adjacent chains with the lowering of temperature;(b)CIE color coordinates at different temperatures;(c)Luminescence images showing stepwise luminescence color change under irradiation at 365 nm[44]
在外界刺激因素中,溫度變化導致的發光變色具有更快的響應速度。利用吡啶-2,6-二苯基雙(二苯基氧化膦)(PNPO)與MnBr2在高溫下反應,本研究組合成了具有顯著熱致發光變色性質的配位聚合物[(PNPO)MnBr2]n(19)[44]。這種聚合物室溫下呈現明亮的橙光 (595 nm),液氮溫度下轉變為紅光發射(624 nm),當溫度升高130℃,則轉變為綠光發射(510 nm)。如圖13所示,溫度從80 K升高到480 K,該Mn(Ⅱ)配位聚合物的發光顏色從紅光(624 nm)逐漸轉變為綠光(510 nm)的,發射光譜峰值從624 nm逐步藍移到510 nm。其中在80~300 K,發光顏色變化是突變過程,而在300~480 K,發光顏色是漸變過程。為了澄清發光變色機理,對單晶進行了變溫X射線衍射測試。單晶在不同的溫度下都能得到很好的晶體數據,完美的實現了單晶到單晶的轉變。仔細比較不同溫度下的晶體結構數據可以發現,隨著溫度的變化,相鄰的兩條一維鏈之間的距離發生明顯變化。當溫度從80 K逐漸升高到480 K的過程中,由于相鄰兩條一維鏈之間的Mn-Br間距隨著溫度的升高而逐步增長,三角雙錐構型逐漸向四面體轉變(圖13a),發光顏色也隨之發生紅色→橙色→黃色→黃綠色→綠色→藍綠色的轉變(圖13b和13c)。配合物19是一種少見的響應溫度寬和色域變化大的熱致發光變色材料。
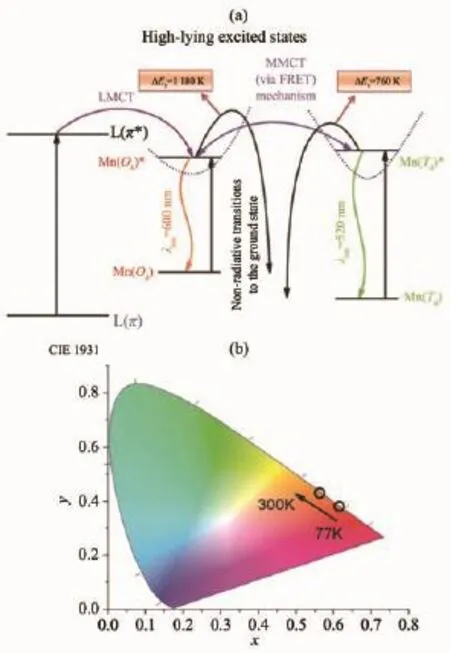
圖14 (a)配合物20光致發光激發、發射以及能量轉移的示意圖,Mn(Oh)和 Mn(Td)分別代表[Mn(L)3]2+和[MnBr4]2-離子;(b)配合物20由溫度誘導的發光顏色變化在CIE中的色坐標位置示意圖[15]Fig.14 (a)Schematic diagram for photoluminescence excitation,emission,and energy transfer in 20,Mn(Oh)and Mn(Td)refer to[Mn(L)3]2+and[MnBr4]2-species,respectively;(b)CIE chromaticity diagram showing the temperaturedependent color coordinates of 20(λex=250 nm)[15]
基于Mn(Ⅱ)配合物的發光機理,如上所述構型的轉變必然會引起光物理性質的變化。然而,某些化合物在外界刺激下沒有發生明顯的構型變化,而光物理性質卻出現顯著差異。Arteev等[15]報道了具有雙發射的有機-無機雜化Mn(Ⅱ)配合物20,配合物20陽離子為有機配體螯合的六配位[Mn(dppeO2)3]2+,陰離子為 [MnBr4]2-。[Mn(dppeO2)3]2+(八面體場)和[MnBr4]2-(四面體場)分別發射橙光和綠光,兩者發光機理都歸屬于d-d躍遷,Mn(八面體場)激發態能量來源于 LMCT,Mn(八面體場)與 Mn(四面體場)又可以通過金屬偶極作用產生離子間的電荷轉移(MMCT)或能量轉移(圖14a)。但是它們對熱淬滅的響應程度有所差異,因此在不同溫度下,表現不同發光顏色(圖 14b)。
3 Mn(Ⅱ)配合物電致發光器件
電致發光在平板顯示和照明領域商業應用前景廣闊。目前,商用有機發光二極管 (Organic Light-Emitting Diodes,OLEDs)的紅光和綠光材料主要是磷光貴金屬Ir(Ⅲ)和Pt(Ⅱ)配合物,存在著資源短缺和價格昂貴等挑戰性問題。最近,本研究組首先嘗試利用低成本Mn(Ⅱ)配合物為發光材料組裝有機發光二極管,開展了離子型四溴化錳配合物(Ph4P)2[MnBr4](21)在有機發光二極管器件中的應用探索[18]。鑒于配合物21呈現高效率的d-d躍遷純綠光發射(圖15a,15b),其晶體和粉末樣品的磷光效率高達98%,熱穩定性高達400℃,且溶解于二氯甲烷等鹵代烴溶劑。為此,我們利用低成本Mn(Ⅱ)配合物(Ph4P)2[MnBr4]為發光材料,采用溶液旋涂法分別制備了四層非摻雜有機發光二極管和三層摻雜發光器件(圖15c)。
對于非摻雜有機發光二極管,器件結構為ITO/PEDOT:PSS(50 nm)/TCTA(50 nm)/Mn(Ⅱ)配合物(50 nm)/TPBi(50 nm)/LiF(1 nm)/Al(100 nm)。器件的啟亮電壓為3.5 V,最大電流效率、功率效率和外量子效率分別為 25.4 cd·A-1、18.3 lm·W-1和 7.2%。 對于摻雜有機發光二極管,器件結構為ITO/PEDOT:PSS(50 nm)/40%TCTA:40%2,6-DCZPPY:20%Mn(Ⅱ)配合物(50 nm)/TPBi(50 nm)/LiF(1 nm)/Al(100 nm)。 在具有實際應用價值的亮度556 cd·m-2(電壓6.3 V)時,器件的電流效率、功率效率和外量子效率分別為32.0 cd·A-1、16.2 lm·W-1和 9.6%(圖 14d)。
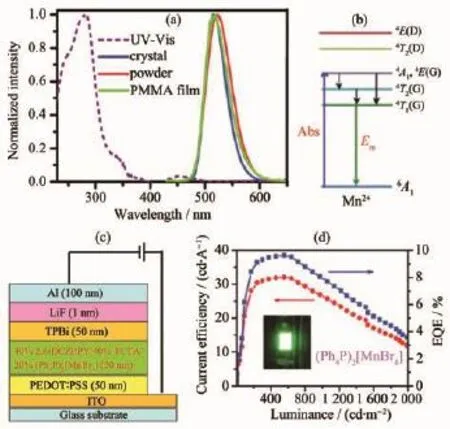
圖15 (a)配合物21的固態吸收光譜及其在晶體、粉末和PMMA薄膜狀態的發射光譜;(b)Mn(Ⅱ)在吸收態和發射態的d-d躍遷能級示意圖;(c)配合物21的有機發光二極管器件結構示意圖;(d)器件的電流效率和外量子效率(EQE)隨亮度的變化[18]Fig.15 (a)Solid-state absorption spectrum of complex 21 together with the emission spectra in crystal,powder and PMMA doping film;(b)Schematic energy diagram of d-d transitions in absorption and emission states;(c)Device structure of organic light emitting diode based on complex 21;(d)External quantum efficiency(EQE)/current efficiency versus luminance for the device[18]
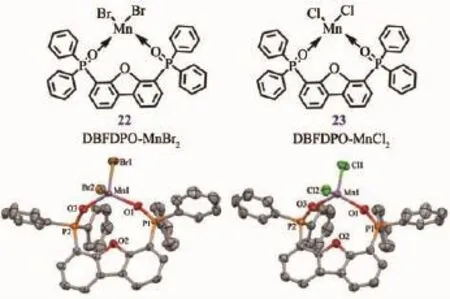
圖16 配合物22和23的結構示意圖和結構透視圖[45]Fig.16 Chemical diagrams and perspective views of complexes 22 and 23[45]
Zhao和Huang等[45]利用二苯并呋喃氧膦衍生物DBFDPO為有機螯合配體設計合成了四面體構型的 Mn(Ⅱ)配合物 DBFDPO-MnX2(X=Br 22,or Cl 23)。采用真空蒸鍍法制備有機發光二極管,具有較低的啟亮電壓(3.0 V),最高外量子效率值可以達到10.49%,最大電流效率和功率效率值分別為35.47 cd·A-1和 34.35 lm·W-1。 雙[2-(2-羥苯基)吡啶]鈹(Bepp2)或 1,3,5-三(2-N-苯基苯并咪唑基)苯(TPBi)主體材料和DBFDPO-MnBr2發光材料復合得到發射紅光的激基復合物,其最大電流效率和功率效率值分別為 18.64 cd·A-1和 17.92 lm·W-1,這也是迄今為止報道的紅光激基復合物中電流效率和功率效率的最高值。Mn(Ⅱ)配合物具有高效發光和低成本的優勢,無論是有機-無機雜化的Mn(Ⅱ)配合物還是中性的配合物,在磷光OLEDs器件領域都擁有巨大的應用潛力。
4 總結與展望
鑒于d5電子結構的Mn(Ⅱ)具有高順磁性,在特定條件下其d-d躍遷激發態可形成高效率輻射發光。然而,與其在磁學與磁性材料領域的快速發展相比,對Mn(Ⅱ)發光特性的基礎與應用研究尚處于起步階段。
本論文綜述了近年來關于Mn2+摻雜的配位發光體系、有機-無機雜化Mn(Ⅱ)配合物以及Mn(Ⅱ)-有機配體配位體系的磷光性質、刺激響應發光變色及其電致發光器件方面的研究進展。Mn(Ⅱ)發光材料具有低成本、高發光效率、高穩定性及低毒等優點,在發光應用領域擁有巨大的發展前景。
Mn2+摻雜能夠改變本征材料的發光性質,調節發射波長和發光色度并提升發光效率,但是摻雜比例過高和過低都難于獲得理想的發光性能,如何通過控制摻雜比例來達到預期效果仍然需要不斷摸索。對于離子型鹵化錳(Ⅱ)配合物,有機陽離子起到關鍵作用,它在晶格中的分布以及與鹵素和金屬離子間相互作用在很大程度上影響發光性質,因此尋找合適的有機陽離子至關重要。對于有機配體Mn(Ⅱ)配合物,由于螯合配位能夠提升Mn(Ⅱ)配合物的剛性、穩定性及發光效率,設計合成具有強螯合配位能力的多齒有機配體至關重要。鑒于Mn(Ⅱ)配合物發光不僅僅來自于d-d躍遷,還可能來自于配體參與的分子內與分子間的電荷轉移躍遷等,加強理論計算研究有助于深層次理解其發光激發態的本質。
為探討Mn(Ⅱ)配位結構的多樣化及其發光性能構效關系規律,需要設計更多不同配位數及不規則配位幾何構型的配合物以獲得跨越整個可見區的各種顏色的、高色純度的發光,以滿足其在不同領域的應用需求。另一方面,Mn(Ⅱ)配位構型可逆轉化所產生的發光變色現象值得深入研究,以期獲得實際應用。
目前報道的Mn(Ⅱ)發光材料絕大部分在晶態下發光,而在溶液和薄膜態通常發光較弱,甚至不發光,嚴重制約了其實際應用價值。鑒于d-d躍遷激發態對溶劑和基質極度敏感,易于非輻射去活化,在室溫下如何獲得基于Mn(Ⅱ)d-d躍遷的高效率溶液發光和摻雜薄膜發光是一個富有挑戰性的研究課題。
Mn(Ⅱ)發光產生于d-d禁阻躍遷,導致發光壽命通常達到數十到數百微秒,甚至長達數毫秒,導致電致發光效率隨著電流密度提高而迅速衰減。迫切需要通過篩選有機配體或有機陽離子來縮短發光壽命,提升器件效率指標,最終實現以廉價Mn(Ⅱ)材料替代貴金屬發光材料。
- 無機化學學報的其它文章
- 《無機化學學報》投稿須知(NOTICE TO AUTHORS)
- An N-Alkylated 2-(5-Bromo-4-methylthiophen-2-yl)-imidazo[4,5-f]-[1,10]-phenanthroline Rhenium(Ⅰ)Tricarbonyl Compound Showing Aggregation-Induced Emission Enhancement
- Syntheses,Structures and Magnetic Properties of Manganese Phosphonates
- Two Zn(Ⅱ) and Cd(Ⅱ) Metal-Organic Frameworks with Mixed Ligands:Synthesis,Structure,Sorption and Luminescent Properties
- Syntheses and Crystal Structures of Two Copper Complexes Based on Quinolyl and Pyridyl Substituted Triaryltriazoles
- Plasma-Assisted Fabrication of Ferroelectric Flakes with Single-Unit-Cell Thickness and Characterization of Ferroelectricity

