仿生礦化與硬組織修復
金曄麗 潘海華 唐睿康*,
(1浙江大學化學系,杭州 310027)
(2浙江大學求是高等研究院,杭州 310027)
0 引 言
生物硬組織如脊椎動物的牙和骨,軟體動物的外殼等具有分層有序的結構特征、優異的機械性能,在生物體內發揮防護、支撐、運動和咀嚼攝食等重要生理功能。生物硬組織是通過生物礦化過程形成的。35億年前,生物礦化現象就普遍存在于動物、植物以及微生物中[1],經過漫長的生物進化,生物體可通過碳酸鈣、磷酸鈣等常見礦物晶體裝配出具有多層次有序結構的牙齒、骨骼等硬組織。生物礦化學科就是研究生物分子和生物基質如何調控礦物晶體的形成機制,包括生物礦物的組成、結構和形成過程,生物礦化相關蛋白質的功能,如蛋白質對礦物晶體的作用、識別和對礦物結晶的調控等。
受生物礦化啟發,仿生礦化利用生物礦化原理在體外制備類似生物礦物的有機-無機復合結構材料,或者模擬生物礦化環境,研究有機分子調控礦物結晶的機制。通過仿生礦化研究,人們已成功制備出類牙、類骨和類貝殼等有機-無機分層結構材料,有助于高性能儲能、催化、分離以及高強增韌和硬組織替代材料的制備。
近年來,隨著我國人口老齡化和飲食結構改變,有關牙和骨的健康問題日漸凸顯,比如齲齒問題、骨缺損、普遍存在于老年人群中的骨質疏松問題,這些硬組織損害和疾病往往是不可逆的,需要硬組織替代生物材料的植入來輔助生物體的修復。仿生礦化研究為體內外硬組織制備和修復提供思路,對于硬組織的修復具有十分重要的意義。我們將重點綜述生物礦化從機理到硬組織仿生修復的相關內容,具體包括生物礦化的基本原理和主要礦物、無機礦物結晶調控原理和新認識、與牙骨硬組織修復密切相關的膠原礦化機制和最新進展、硬組織材料的多級結構特征以及仿生礦化在硬組織修復中的前沿進展。
1 生物礦化與仿生
生物體內無機礦物在形成過程中受到了細胞、蛋白質、有機基質及無機離子的影響[2],生物礦化的核心是在水介質中和有機物的調控下,無機礦物的成核、生長和組裝的過程。除正常生物礦外,在一些代謝異常,炎癥和生物信號或激素失調等異常生理情況下也會在非硬組織部位產生礦化,稱為病理性礦化,如血管鈣化、腎結石、牙結石、軟骨鈣化、肌腱鈣化和基底神經元鈣化等,這些病理性生物礦化過程對人體健康十分不利。無論是促進硬組織修復還是消除病理性礦化都需要深入了解生物礦化過程。
根據生物礦化的途徑,可以分為生物誘導(biologically induced)礦化和生物控制(biologically controlled)礦化[3]。生物誘導礦化是指由于生物代謝過程引起細胞內外環境的離子富集、pH變化等誘導礦物向沉淀反應方向移動的過程。在這一過程生物不主動參與調控礦物的沉積和結構,生物誘導礦化一般多見于藻類、細菌等低等生物[4]。大多數病理性礦化也是屬于生物誘導礦化。生物控制礦化是指生物對礦物顆粒的成核和生長起著直接的化學控制作用。在大多數情況下,這些礦物質是在細胞內或細胞上的特定位置,在特定條件下直接合成的。生物控制礦化是生物體內基因直接程序化控制礦化過程,并且生物體營造特殊礦化環境,使礦化過程與外界環境隔絕。在這種情況下產生的礦物顆粒往往是有序的晶體,其尺寸分布窄,顆粒形態具有特異性和一致性。貝殼、牙、骨的形成過程主要涉及到生物控制礦化。
根據生物礦化中的無機礦物類型,一般可將生物礦物分為兩大類:一類是鈣化礦物,一類是非鈣化礦物。鈣化礦物主要有磷酸鈣和碳酸鈣,在細胞代謝中起到了重要的作用[5]。非鈣化礦物主要有硅礦物和鐵礦物。
碳酸鈣礦物主要有6種不同的結構[2],分別是:方解石、文石、球霰石、一水合碳酸鈣(CaCO3·H2O)、六水合碳酸鈣(CaCO3·6H2O)和無定形碳酸鈣(amorphous calcium carbonate,ACC)。 最近 Zou 等[6]在研究ACC結晶過程中加入鎂離子,發現了具有單斜結構的半水合碳酸鈣(CaCO3·1/2H2O)。生物體內最廣泛存在的是方解石和文石[4]。方解石、文石、球霰石都是結晶態的碳酸鈣,而ACC是非晶態碳酸鈣,具有熱力學不穩定性[7]。Addadi[8]課題組把ACC分成亞穩態的含水ACC和不穩定的脫水ACC。
磷酸鈣是哺乳動物生物礦化研究的主要無機礦物,可以分為穩定的磷酸鈣晶體礦物和不穩定的無定形磷酸鈣礦物 (amorphous calcium phosphate,ACP)。生物體內最穩定和常見的磷酸鈣晶體是磷灰石,結構上接近羥基磷灰石(hydroxyapatite,HAP,Ca10(PO4)6(OH)2),在生物體環境中,羥基可以被氟離子、氯離子、碳酸根等取代。生物體內其他結晶態磷酸鈣還有磷酸氫鈣(dicalcium phosphate,DCP)、磷酸八鈣(octacalcium phosphate,OCP)和二水磷酸氫鈣(dicalcium phosphate dihydrate,DCPD), 被認為是骨形成的前體相[9]。一些病理性礦化組織中,如鈣化血管、腎結石和牙結石等,也含有不同晶型的磷酸鈣。
生物礦物與生物有機基質復合在一起,具有精巧的多級分層結構,賦予了其優異的力學性能[10],這啟發了科學家們模擬生物礦物的多級分層結構,制備高性能材料。從不同角度模擬生物礦化,可以初步將仿生礦化研究分為過程仿生、功能仿生和結構仿生。通過仿生礦化可以合成各種類貝殼[11]、類牙[12]和類骨[13]材料,具有優異的力學性能或者特殊的功能,有望在臨床治療、軍事、建筑材料等方面發揮重要作用。
2 礦物的結晶
2.1 晶體的經典成核和生長模型
礦物結晶是生物礦化的重要過程,一般的結晶過程包括晶體成核和晶體生長。根據經典成核理論(classical nucleation theory,CNT),成核是溶質分子從溶液中凝聚形成穩定晶核種子的過程。經典成核理論認為,在過飽和溶液晶體成核雖然是體相自由能(ΔGv)降低的過程,但隨著晶體-溶液界面形成,又增加了界面總自由能(ΔGs)。這二者與晶核尺寸相關,但由于冪次不同,這導致總自由能(ΔG)先增加后降低(圖1)[14]。當晶核半徑(r)到達臨界晶核半徑(rc)后,此時晶體成核過程達到最大自由能(臨界能,Gcrit)。過飽和度和固-液界面能均會影響成核能壘,是結晶的熱力學驅動因素,但晶體-溶液界面能可在動力學上調控成核能壘,對成核起關鍵的調控作用[15]。
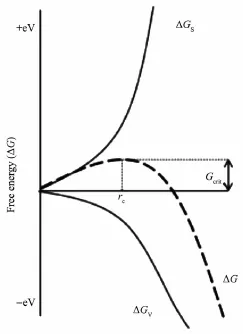
圖1 均相成核自由能與尺寸關系圖[14]Fig.1 Relationship between free energy and size[14]
根據溶液含異質的狀況,可以分為均相成核(homogeneous nucleation)和異相成核(heterogeneous nucleation)[16]。均相成核是指在沒有外界干擾的均勻單一體系中形成晶核的過程,該過程需要借助過飽和度的高化學位驅動跨越成核能壘才形成穩定晶核,也稱為臨界核[17]。而異相成核過程一般發生在不同的相表面、雜質、晶界或者位錯上[18]。對于異相成核體系,結晶相在基質上形成時,增加了晶體-溶液界面,但同時減少了基質-溶液界面,所以界面自由能項要采用有效界面能,與溶液-基質-晶體三相界面的接觸角(θ)有關[14]。一般異相成核的有效界面能要小于晶體-溶液界面能,所以在溶液體系中,由于存在多種雜質或表面,可大大降低成核能壘,異相成核相對更容易發生[19]。CNT有助于理解生物礦化過程,可以認為生物礦化中的有機基質是礦化過程的異相成核位點,可誘導礦物成核并控制礦物的物相、成核空間分布和晶體取向。
晶體成核后,在過飽和溶液中會繼續生長。對于傳統晶體生長的理解是晶體的離子單體首先擴散至晶體表面,然后進入晶格,實現在晶體表面生長[14]。隨著原位原子力顯微鏡技術的發展,科學家們發現晶體主要是通過表面的臺階生長來實現晶體的長大[20]。晶體表面的平面區域被稱作臺階平臺(Terrace),臺階平臺的凸起稱作臺階(Step),臺階上還有許多折角,稱作扭折(Kink)。晶體生長過程中最可能的途徑是首先擴散到晶面進行吸附,然后擴散到臺階,最后進入扭折。相反,晶體溶解時,晶體組成的分子更容易從扭折處脫離[21]。晶體表面臺階的來源主要有2種,一種是螺旋位錯,另一種是島狀臺階。與此相對應的晶體生長模式為螺旋生長和島狀生長[22]。螺旋生長是晶格產生螺旋位錯,并以此為中心產生連續的臺階而生長;島狀生長是在晶體平面上通過二維成核形成臺階源然后生長的方式[20]。螺旋臺階是由于晶體成核或生長過程中雜質分子嵌入或分子錯誤堆疊引起的,形成過程與過飽和度的關系不大;但島狀臺階的形成是二維成核,需要一定的過飽和度來克服成核能壘。所以在溶液過飽和度較低時,晶體一般按照螺旋生長方式進行;而過飽和度較高時,按照島狀形式生長。
2.2 生物礦化和仿生礦化中的非經典晶體成核與生長
生物礦物在結晶過程中受到多方面因素的影響,如蛋白質、細胞、基因、有機分子和無機離子[23],但生物礦化是一個復雜的礦物形成過程,一些礦化途徑不符合經典結晶理論所假設的通過單體附著的晶體生長過程。在仿生礦化體系中發現了許多通過顆粒的附著(particle attachment,CPA)的非經典結晶途徑,其中包括寡聚體、多離子復合物、液態前驅體、無定形顆粒、納米顆粒等結晶前驅體或生長單元[24]。在生物礦化體系中,也發現大量經由亞穩態的無定形相相變轉化為最終礦物結晶相的非經典結晶過程。例如,海膽胚胎針狀體的礦化過程是通過聚集ACC前體的納米顆粒,然后轉化為方解石單晶[25]。類似的無定形到晶體的轉化途徑廣泛存在于各種生物礦物中,包括海膽的脊刺[26]和牙[27]、哺乳動物的牙釉質[28]、脊椎動物的骨骼[29]、甲殼動物的外骨骼[30]、環節動物的石灰質結石[31]和軟體動物的幼體殼[32]。這種無定形相的相變過程受許多因素影響,如水和添加劑等。無定形相在水溶液中會很快轉變成結晶相,Ihli等[33]發現如果除去早期形成的 ACC的游離水,可以使其穩定保存很久。無定形相的相變過程也會受添加劑的影響。Tao等[34]研究了球鼠婦(西瓜蟲)的換殼機制,發現其外殼的相變過程是鎂離子和富天冬氨酸(Aspartic acid,Asp)共同作用的結果。鎂和富含Asp的化合物的協同作用可以穩定ACC防止其相變,而球鼠婦換殼時,這2種添加劑的含量會減少。
仿生礦化體系發現了更豐富的非經典結晶途徑,有助于全面理解生物礦化過程。Gower課題組[35]最早觀察到加入聚丙烯酸(polyacrylic acid,PAA)及聚天冬氨酸(polyaspartic acid,pAsp)后具有液態性質的碳酸鈣液滴。Gebauer[36]等證明了碳酸鈣礦化初期含有穩定的預成核離子簇,然后這個離子簇通過液-液相分離形成致密的納米級液滴,可繼續聚結形成無定形相。這種團簇不僅存在于碳酸鈣礦化過程中,也存在于磷酸鈣結晶過程中。Dey等[37]通過冷凍電鏡技術在磷酸鈣結晶早期觀察到了松散且尺寸僅為1 nm左右的團簇,他們認為這種團簇是ACP的前驅體。這個穩定的團簇不同于經典成核理論預測的小于臨界尺寸的不穩定離子聚集體,即使在不飽和的溶液中也能形成。由此提出的團簇成核前體(Pre-nucleation clusters,PNCs)、液-液相分離(Liquidliquid phase separation)及液態前驅體假說(polymerinduced liquid precursors,PILP)是仿生礦化研究的重要發現,引起了生物礦化領域學者的廣泛關注。
3 膠原礦化
牙和骨中含有豐富的Ⅰ型膠原纖維,牙本質修復和骨修復的一個重要過程就是膠原礦化,因此研究膠原礦化對于硬組織修復具有重要的臨床意義。膠原纖維具有天然帶狀結構,是由于纖維在不同區域所含電荷密度分布不同造成的[38]。在骨膠原纖維內分布的是沿膠原纖維方向生長的HAP晶體[39]。在膠原礦化的過程中,有機基質對HAP晶體成核和生長的調控是膠原礦化研究的關鍵科學問題。在有機基質中,除膠原蛋白外,還存在非膠原蛋白(noncollagen proteins,NCPs),在調控和誘導膠原纖維礦化中起重要作用。常見的NCPs有牙本質磷蛋白(dentin phosphoprotein,DPP)、成牙本質基質蛋白(dentin matrix protein 1,DMP1)、骨涎蛋白(bone sialoprotein)、骨鈣素(osteocalcin)、骨形態發生蛋白2(bone morphogeneticprotein,BMP-2)和骨橋蛋白(osteopontin)等[40-41]。NCPs在體內膠原礦化過程中起重要作用已經得到了普遍的認可[42]。Boskey[43]認為NCPs可能為磷酸鈣礦化提供成核位點,也可能用于調控晶體的大小、取向或晶形,或用于提供鈣、磷離子。膠原礦化的仿生礦化研究中,常使用帶電的大分子有機物如聚天冬氨酸、聚丙烯酸代替NCPs質來誘導和調控膠原礦化,然而膠原纖維內實現礦化的原因至今存在很多爭議。
3.1 聚合物誘導的液態前驅體假說
Olszta等[10]提出了膠原在骨形成過程中是通過聚合物誘導的液態前驅體實現礦化的。PILP可以通過毛細作用吸入膠原纖維的間隙中,然后轉化為HAP。PILP工藝可以看作利用酸性聚合物來簡單模擬NCPs功能誘導液-液相分離,抑制磷酸鈣結晶成核,形成亞穩態PILP。PILP工藝首次實現膠原纖維內穩定可靠的有序礦化,是目前膠原礦化實驗采用最多的工藝。但目前關于PILP的液態性仍缺乏相關直接證據,通過毛細作用吸入膠原纖維空隙的假說仍有待證明。
3.2 抑制劑排除假說
Toroian等[44]提出了抑制劑排除假說,考慮了膠原纖維內空間可容納分子的大小對膠原礦化的可能影響。他們認為小于6 kDa的分子和磷灰石晶體可以擴散到纖維內,從而導致礦化或直接影響礦化。雖然大于40 kDa的分子被排除在纖維外,但它們可以通過促進磷灰石晶核形成,然后擴散到纖維內實現礦化,或者通過抑制纖維外溶液中的磷灰石晶核的生長來促進纖維內礦化(小于6 kDa的磷灰石晶體只有幾個晶胞大小,可以當作晶核看待)。但假說中提及的磷灰石晶核進入膠原纖維,以及蛋白分子可抑制溶液中的磷灰石晶核的繼續生長還有待實驗證明。此外,膠原本身對礦化的直接調控作用也被忽略,不符合后來實驗發現的膠原本身對礦化有調控作用[45-46]。
3.3 庫侖引力誘導礦化假說
Landis等[45]根據膠原分子的不同染色條帶(bands)的序列分析提出了膠原分子的富含電荷殘基的區域可能是礦化的成核位點。Nudelman等[47]結合冷凍電鏡觀察發現,礦化首先發生在富含正電荷的a條帶(a-band)(靠近重疊區和空隙區的交界處),支持庫侖引力誘導礦化假說。根據該假說可以解釋為何酸性聚合物穩定的ACP優先發生在a條帶。但該論文沒有對堿性聚合物穩定ACP誘導膠原礦化的優先發生區域進行分析,庫侖引力誘導礦化假說還有待更系統的評估。
3.4 協同組裝礦化假說
Wang等[46]發現Ⅰ型膠原在體外可以在沒有添加任何有機大分子的情況下誘導HAP取向結晶。作者首先采用反滲透法得到高濃度的膠原蛋白基質,然后通過調節pH誘導膠原蛋白自組裝成液晶態有序排列的膠原纖維凝膠。如果在高濃度酸性膠原溶液中引入高濃度的磷酸鈣酸性溶液,可以使膠原組裝過程和礦化過程協同進行,得到有序礦化的膠原基質。由于膠原協同組裝礦化的方法不含聚電解質,充分支持了膠原本身對礦化的調控作用。該假說推測NCPs在體內的可能作用是提高膠原基質的局部離子濃度。由于形成液晶態膠原基質和膠原礦化工藝的操作復雜性,加上膠原有序礦化的實現對膠原濃度、礦化液配方比較嚴苛,目前采用協同組裝礦化方法的研究并不多見。
3.5 滲透壓/電荷雙平衡誘導礦化假說
在仿生礦化領域中,大部分研究都是使用聚陰離子電解質來模擬NCPs的作用。然而,Niu等[48]發現聚陽離子電解質也能促進膠原纖維內礦化,對庫侖引力誘導礦化假說提出了質疑并進行了完善。作者發現,膠原纖維經聚丙烯胺(poly allyamine hydrochloride,PAH)穩定ACP礦化,未發現a條帶優先礦化的跡象,并且重疊區和空隙區的電子密度類似,也就是未發現膠原纖維內有優先礦化的區域。作者還發現,膠原纖維經聚陽離子電解質修飾后,仍可通過聚正電解質穩定ACP礦化,卻不能被聚負電解質穩定ACP礦化。這些發現不符合庫侖引力誘導礦化假說的預判。由此,作者認為膠原纖維內外需維持Gibbs-Donnan平衡。溶液中添加聚電解質時,纖維外的滲透壓更高,導致膠原纖維內的水分子向外滲透,原子力顯微鏡原位觀測到膠原纖維的尺寸在變小。由于膠原纖維的粘彈性,因脫水壓縮的膠原纖維具有恢復原貌的內驅力,作者由此猜想,含聚合物的礦化前驅體會因此進入膠原纖維內部,使壓縮的膠原纖維得到恢復。雖然基于Gibbs-Donnan平衡的滲透壓/電荷雙平衡假說豐富了膠原礦化中礦化前驅體進入膠原機制的理解,但該假說最關鍵的部分(礦化前驅體進入膠原纖維的驅動力)屬于猜測,目前只有分子模擬的支持,需要更多實驗來佐證。
4 牙和骨的多級結構
4.1 骨的多級結構
骨是有機-無機的復合材料,其中,以HAP和碳酸磷灰石為主的無機成分約占總質量的65%,以Ⅰ型膠原為主的有機質約占總質量的34%[49]。Nair等[50]將骨分成六級結構(圖2),從微觀到宏觀分別是:第一級是磷灰石,膠原纖維(fibre)和其他微量成分;第二級是具有磷灰石/膠原纖維有序復合結構的礦化膠原纖維;第三級是由膠原纖維有序排列形成的膠原纖維束(fibril);第四級是骨中發現的4種膠原纖維束有序堆疊模型;第五級是哈弗氏管,即骨單位,第六級是整體骨。Weiner等[51]將整體骨進一步分成皮質骨和松質骨。Reznikov等[52-53]基于先進的掃描透射電鏡的3D成像技術將骨的結構分成十二級結構。膠原纖維本身就具有多級結構,膠原纖維由微纖維(micro-fibril)按準六邊形錯位堆疊形成,每個微纖維由3條鏈形成的三重螺旋結構蛋白,而這些螺旋結構又是由含G-X-Y的殘基序列單元重復形成。
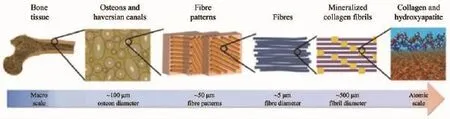
圖2 骨的多級結構[50]Fig.2 Multistage structure of bone[50]
4.2 牙的多級結構
牙本質中無機礦物質約占總質量的70%,以膠原蛋白為主的有機質約占20%,其余是水[54]。在解剖學結構上,牙本質由牙本質小管、成牙本質細胞突起和細胞間質組成,其中細胞間質中的管間牙本質富含網狀礦化膠原纖維,其結構與骨礦化膠原纖維類似。牙本質與牙釉質之間有一層牙本質-牙釉質邊界(dentin-enamel boundary,DEB),將二者牢固地結合在一起,其中同時含有膠原蛋白和牙釉蛋白[55]。和牙本質相比,牙釉質的有機物含量更低,由96%(w/w)的磷灰石,1%(w/w)的有機物和3%(w/w)的水組成[56],其結構也與牙本質有很大的不同。Cui等[57]將牙釉質分為7級結構(圖3),牙釉質的主要成分是六方羥基磷灰石晶體,其晶胞單元是最基本結構(1級)。磷灰石晶胞按晶體c軸方向擇優堆疊形成磷灰石納米纖維(直徑約為30 nm)(2級)。由磷灰石晶體納米纖維聚集組裝而成晶體微纖維(直徑約為100 nm)(3級)。微纖維繼續組裝形成更粗的晶體纖維束(直徑約為800 nm)(4級)。晶體纖維束按不同方向擇優排列,垂直于牙釉面的纖維束組成釉柱,按一定夾角傾斜的纖維束組成釉柱間質,釉柱與釉柱間質的結構不連續處為釉質鞘。釉柱、釉柱間質、釉質鞘形成連續體,呈鎖孔或鱗片狀結構(直徑為6~8 μm)(5級)。鎖孔連續體緊密排列,形成魚鱗狀斑圖的釉柱群(6級)。其中牙釉外層的釉柱群呈放射狀排列,牙釉內部的釉柱之間交錯編織,呈交叉式排列,釉柱以不同排列方式最終構成覆蓋在整個牙冠表面的釉質層(7 級)。
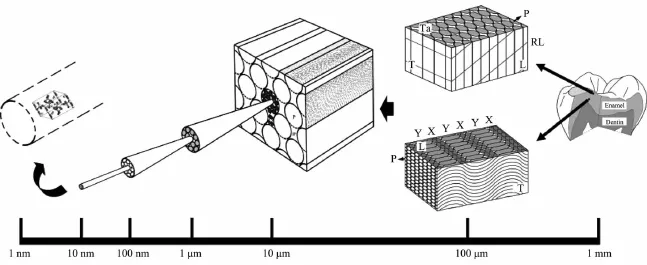
圖3 從納米級到毫米級的牙釉質結構示意圖(未按比例)[57]Fig.3 Schematic illustration(not drawn to scale)of the hierarchical assembly of enamel structure,from the millimetre to the nanometre scale[57]
5 硬組織修復
硬組織是生物體通過礦化形成的組織,如脊椎動物的牙和骨、軟體動物的外殼和棘皮動物外骨骼等,對生物體起重要的保護、支撐、運動和攝食等功能。隨著人口的老齡化,由硬組織老化或損傷引起的健康問題,如牙齲、牙缺損、骨質疏松和骨折等,會嚴重影響生存質量,甚至威脅生命。研究硬組織修復,對于幫助人體重建硬組織生理功能起著重要的作用。本節將主要介紹牙釉質的體外修復,牙本質再礦化修復和骨修復方面的研究進展。
5.1 牙釉質的修復
齲齒是一種生物膜介導的、糖代謝驅動的、多因素(基因,菌群口腔環境,飲食衛生習慣等)誘發的進行性不可逆疾病[58]。例如,口腔中發酵的碳水化合物和一些細菌的酸性代謝產物會對牙釉質產生直接腐蝕[59]。在沒有細菌參與下,長期飲食酸性物質會腐蝕牙齒,加速磨損[60]。牙齒處于連續的脫礦和再礦化平衡,如果平衡被打斷,脫礦大于再礦化會導致牙釉質本體受到侵蝕,引起牙釉質有序結構破壞,機械性能下降,進而導致磨損加速,齲壞將進一步向內推進[61]。牙釉質是牙齒最重要的第一保護層,齲齒的原發部位往往起始于釉質層。因此牙釉質的再礦化對于牙齒初齲的修復具有重大意義。
目前臨床醫學上修復齲齒的手段主要是通過人工材料修補,所采用的齲齒修復材料主要有銀汞合金和樹脂材料等。銀汞合金修復齲齒操作簡單、價格經濟實惠,但存在美觀性欠佳、潛在的汞毒性以及重金屬污染等問題,目前已逐步被樹脂材料取代。樹脂材料經調色可減小與殘留牙體的色差,但樹脂材料機械強度較差,且具有固化收縮性,修復后與牙體存在明顯的間隙,易發生界面材料的生物降解,長期有效性不佳[62]。這些人工材料無論是從材質,結構還是性能上都與天然牙體有很大的差距。因此利用仿生礦化手段,在受損牙體表面再礦化一層與天然牙齒結構相近的材料,對于修復牙齲具有重要的臨床意義。
目前,牙釉質的修復和再礦化的仿生礦化實驗主要是在體外模擬口腔或體液環境,對酸蝕后的牙釉質進行修復。通過模擬牙釉蛋白和其他礦化功能蛋白促進牙釉質形成的功能,仿生礦化實驗中常加入礦化功能蛋白或其模擬物(多肽,雙親分子或高分子等)。Fan等[63]將水凝膠在添加了牙釉蛋白和氟離子的人工唾液中培養,然后對酸蝕后的牙釉質表面進行再礦化修復,發現牙釉質表面形成了含有針狀氟化羥基磷灰石晶體的礦物層。由于礦化功能蛋白獲取困難,研究者們發現一些多肽殘基也具有類似功能蛋白的活性。Kirkham等[64]發現一種可自組裝成纖維的酸性多肽(P11-4)可以促進牙釉質的再礦化和抑制脫礦。除多肽外,一些合成高分子也具有促進礦化功能,其中富含電荷基團和衍生化能力的聚酰胺-胺型樹枝狀高分子(PAMAM)吸引了研究者的廣泛關注。Yang等[65]合成了天冬氨酸和硬脂酸修飾的PAMAM雙親分子,發現具有類牙釉蛋白的組裝功能,并可誘導磷灰石取向生長。Wu等[66]合成了阿倫磷酸(ALN)改性的羧酸化聚酰胺-胺樹枝狀高分子,發現其具有原位誘導牙釉質再礦化的功能,并對磷灰石有強特異吸附和誘導再礦化的功能,礦化生成的棒狀磷灰石具有與人牙釉質類似的納米結構。
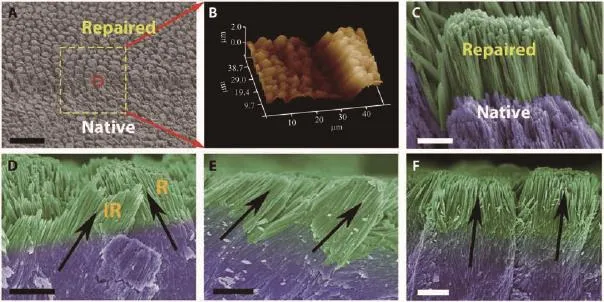
圖4 復制復雜的牙釉質結構:(A)酸蝕和修復后的牙釉質的掃描電鏡圖;(B)修復后牙釉質的三維原子力顯微鏡圖;(C)(A)中紅色圓圈的高倍掃描電鏡圖像;(D)修復后的牙釉質的橫截面圖,牙釉質棒和牙釉質棒之間都修復了;R和IR分別代表牙釉柱和釉柱間質;(E,F)具有不同方向的可以修復的牙釉質棒[71]Fig.4 Replication of the complicated structure of enamel:(A)Scanning electron microscope image showing both acid-etched enamel and repaired enamel;(B)A three-dimensional atomic force microscope image of repaired enamel;(C)Highmagnification scanning electron microscope image of the red circle in(A);(D)Cross-sectional view of final repaired enamel,where both enamel rods and inter-rods were repaired,R and IR represent for enamel rod and inter-rod,respectively;(E,F)Enamel rods with different orientations which can be repaired[71]
上述牙釉質再礦化過程的礦物來源是礦化液中的鈣磷離子,但在實際牙釉質修復時,不可能在口腔中引入大量的鈣磷液。針對該難題,仿生礦化同樣從生物礦化過程找到了靈感:生物礦化不是從溶液中的鈣磷離子直接礦化,而是將ACP作為牙和骨礦化的前驅體。因此,有一些仿生礦化研究工作將ACP納米顆粒作為鈣磷來源用于牙釉質的修復。然而,ACP是磷酸鈣的亞穩態,在溶液中很容易發生相變,不易保存,極大地限制了它的臨床應用。為此,研究者通過添加穩定劑穩定ACP復合物應用于牙釉質的修復。Reynolds等[67]通過酪蛋白磷酸肽(casein phosphopeptides,CPP)穩定 ACP,實現了齲壞釉質表層的再礦化。Zhang等[68]發現磷酸化殼聚糖-ACP處理釉質可以快速修復釉質層。除ACP外,HAP納米顆粒也可用于牙釉質的修復的裝配單元。Li等[69]合成了20 nm的納米羥基磷灰石顆粒,該尺寸與牙釉質的基本組成類似,可以很好地吸附在脫礦的牙釉質表面,形成致密礦化層,恢復了酸蝕牙齲的機械性能。雖然合成的納米羥基磷灰石顆粒可以修復牙釉質,但沒有實現牙釉質表面的磷灰石取向排列結構。在此基礎上,Li等[70]利用谷氨酸調控20 nm磷酸鈣顆粒組裝,脫礦的牙釉質表面在修復后得到了具有良好機械性能的類牙釉修復層,并且在礦化修復層可以看到納米磷灰石晶體的取向排列和牙釉質的“魚鱗”釉柱群特征。
雖然以上仿生修復手段可以得到和牙釉質的機械性能相似的修復層,但是要得到具有天然層級結構的牙釉質再礦化層仍是一個巨大的挑戰。近期,Shao等[71]基于納米簇材料為生物礦化最基本單元的認識,以及生物礦化中大量存在的晶體/無定形礦物緊密結合礦化前沿界面,大規模制備了磷酸鈣寡聚體,并以此作為牙釉質再礦化的裝配單元。研究發現,將該材料直接滴在酸蝕的牙釉質上可形成致密ACP層,模仿生物礦化前沿,可以誘導牙釉質上棒狀磷灰石的外延晶體生長,成功使牙釉質長出了2~10 μm的再礦化釉質層。修復層與原始釉質層沒有明顯的界面和縫隙,實現了牙釉質晶格連續修復,并且牙釉質的多級結構得以保留。修復后機械性能與天然牙釉質相同。由于是晶格連續的外延生長修復,磷酸鈣寡聚體可以實現不同取向的牙釉柱和釉柱間質的再生,以及大尺度的全牙釉質層修復,這在仿生礦化修復牙釉質領域取得了重大突破,有望將牙齒修復從“填料填補”帶入“仿生再生”時代。
5.2 牙本質的修復
牙釉質內部是牙本質,他們通過DEB緊密相連。牙齲進展突破牙釉質層后,牙本質將直接裸露在口腔環境。同時,牙本質暴露后,細菌及其代謝產物、口腔殘留物質等將侵入并擴散到牙本質內部,并且難以通過自行清除或沖刷清除,齲病發展將大大加速。該階段可能伴隨著牙齒劇烈疼痛,患者往往在這個階段就醫,急需對齲壞部位進行修補和封閉。
牙本質具有和牙釉質截然不同的組成和結構,它的主體部分是礦化膠原網絡。在傳統牙修復過程中,一般將齲壞部位挖除后,通過酸蝕對周圍牙本質膠原進行脫礦以促進粘結劑滲入膠原纖維網絡,增加粘結劑/樹脂與牙本質之間的鉚合作用,增強粘結強度。但粘結劑/樹脂很難進入膠原纖維內部并且將膠原纖維緊密封閉。牙本質膠原纖維與粘結劑之間具有縫隙,脫礦膠原纖維在膠原酶的作用下會自然降解,粘結劑/樹脂與牙本質之間的鉚合作用將大大降低,因此,粘結的長期有效性受到嚴重影響。針對該問題,研究者們探索了通過仿生礦化對牙本質膠原進行再礦化以重構牙本質和防止膠原纖維的生物降解。
在牙本質礦化中,NCPs起到關鍵作用。Gower課題組通過使用pAsp、PAA等功能聚陰離子電解質來模擬NCPs,在膠原基質礦化方面取得了很多突破性成果。Olszta等[10]通過基于PAA首次實現了膠原纖維內部礦化(碳酸鈣),并提出PILP促進膠原礦化的假說。后來,又通過pAsp陰離子多肽模擬NCPs,基于PILP技術實現了膠原纖維的磷酸鈣有序礦化[72]。在牙本質形成過程中,堿性磷酸酶是反映牙礦化生物活性的重要標志物。受此啟發,Jee等[73]通過堿性磷酸酶來提供緩慢釋放的無機磷酸鹽離子,模擬了牙礦化的生物調控過程,結合PILP技術,實現膠原海綿礦化。PILP技術還可以實現天然膠原基質的礦化。Jee等[74]發現通過從火雞肌腱中獲得的生物膠原支架也可以通過PILP過程礦化。此外,他們還發現骨橋蛋白(osteopontin,OPN)交聯膠原纖維可以促進膠原的纖維內礦化[75],進一步理解了NCPs調控礦化的途徑。
早期的實驗中,Gower課題組發現PAA難以實現膠原纖維的礦化,轉而采用pAsp。我們發現聚電解質的濃度也是影響牙本質再礦化的關鍵參數。Wang 等[76]發現低濃度的 PAA(100 mg·mL-1)不能保持PILP的流動性,因此發生的是纖維外礦化。相反,高濃度的 PAA(1 000 mg·mL-1)可以穩定 ACP,防止其相變,纖維可以內礦化但是其礦化時間會延長,而300~500 mg·mL-1是個合適的濃度范圍。
通過PILP可實現牙本質膠原的再礦化,但礦化修復時間往往以周為單位,需要2周甚至1~2個月的時間,這對于通過仿生礦化修復牙本質的臨床應用而言是個極大的限制因素,因此找到快速礦化的方法具有重要的意義。唐睿康課題組與牙醫研究團隊合作,對該問題進行了持續的探索。Chen等[77]研究發現牙本質膠原蛋白和戊二醛交聯能促進牙本質的仿生再礦化,提高牙本質的力學性能和生物穩定性。戊二醛預處理后再礦化時間從7 d縮短到2 d。戊二醛等雖然可以促進膠原纖維礦化,但是其對生物體存在一定的毒性。我們發現生物硬組織中含有極高水平的檸檬酸鹽,受此啟發,Shao等[78]發現經過檸檬酸預處理膠原可以縮短膠原纖維的礦化時間和顯著提高膠原纖維的礦化度,并從礦化前驅體與膠原纖維的界面浸潤角度進行了解釋。從圖5中可以看到膠原纖維上吸附的檸檬酸可以顯著降低膠原纖維與ACP前體之間的界面能,以增強它們在生物礦化早期的潤濕效果,從而促進纖維內的礦物形成。除檸檬酸外,硫酸軟骨素也廣泛存在于礦化組織中,在礦化過程中起著重要作用。He等[79]通過隨機光學重建顯微鏡發現了固定化的硫酸軟骨素提供了磷酸鈣的特異性成核位點,加速磷酸鈣成核,并通過積累膠原纖維中的鈣離子而顯著促進膠原礦化,使礦化時間縮短到2 d。
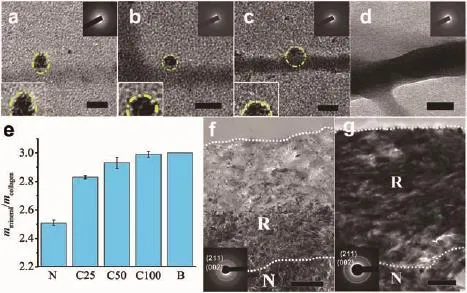
圖5 (a~d)檸檬酸預處理/未檸檬酸預處理的膠原蛋白原纖維上沉積的ACP的TEM圖;比例尺:50 nm;(a)未處理膠原纖維,θ=106.7°±8.7°(平均值±SD,n=30);(b)膠原原纖維(用 2.5×10-2mol·L-1檸檬酸鹽預處理),θ=83.3°±4.3°(n=30);(c)膠原原纖維(用 5×10-2mol·L-1檸檬酸鹽預處理),θ=66.8°±7.7°(n=30);(d)由于 ACP 潤濕(θ=0°)而導致的溶脹的 C 膠原原纖維(用 0.1 mol·L-1檸檬酸鹽預處理)((a~d)插圖:SAED模式表示非晶相);(e)膠原纖維的礦物質含量(N:N-膠原纖維;C25,C50,C100:分別用檸檬酸2.5×10-2、5×10-2和 0.1 mol·L-1預處理的膠原原纖維;B:豬骨);(f)不含和(g)含 0.1 mol·L-1檸檬酸鹽預處理的再礦化牙本質超薄切片的TEM圖(虛線是和礦化牙本質(R)/完整天然牙本質(N)的邊界,插圖為與HAP模式匹配的SAED模式,比例尺為1 μm)[78]Fig.5 (a~d)Representative TEM images of the deposited ACP on the collagen fibrils with/without citrate pretreatment;scale bar:50 nm;(a)N-collagen fibrils,θ=106.7°±8.7°(mean±SD,n=30);(b)C-collagen fibrils(pretreated with 2.5×10-2mol·L-1citrate),θ=83.3°±4.3°(n=30);(c)C-collagen fibrils(pretreated with 5×10-2mol·L-1citrate),θ=66.8°±7.7°(n=30);(d)Swelled C-collagen fibrils(pretreated with 0.1 mol·L-1citrate)as the result of ACP wetting(θ=0°).Insets of(a~d):SAED patterns indicate the amorphous phase;(e)Mineral contents of collagen fibrils(N:N-collagen fibrils;C25,C50,C100:collagen fibrils pretreated by 2.5×10-2,5×10-2,and 0.1 mol·L-1 citrate,respectively;B:pig bone);TEM image of ultrathin section of remineralized dentin without citrate pretreatment(f)and that with 0.1 mol·L-1citrate pretreatment(g)dotted lines to guide the eye for the boundary of resin/collagen and remineralized dentin(R)/intact natural dentin(N)(Insets:SAED patterns matching that of HAP;Scale bar:1 μm)[78]
樹脂粘接劑修復齲齒是臨床的成熟技術,但自酸蝕粘結劑使膠原脫礦,會導致膠原纖維的酶促降解,影響粘結的長期有效性。研究者通過開發可礦化樹脂粘接劑了解決這一難題。Gu等[80]用樹脂粘接劑作為載體,在波特蘭水泥模擬體液系統中成功再礦化了牙本質。但考慮粘結劑的臨床實際流程,粘結劑固化封閉牙本質后,與口腔環境進行了隔斷,牙本質難以持續從體液中獲得低濃度鈣磷離子來再礦化牙本質。基于無定形為前驅相的生物礦化過程給該課題帶來了啟發,通過在粘結劑體系引入無定形前驅體,降低了牙本質礦化對溶液離子來源的依賴性。Wu等[81]合成了pAsp穩定的Si-ACP粒子,以樹脂粘結體為載體,負載Si-ACP顆粒,關照固化后,依然可以實現Ⅰ型膠原的再礦化和脫礦牙本質的再礦化。Tay課題組[82]采用藥物載體的輸送的方法來引入礦化前驅體,他們通過多孔介孔二氧化硅來包裹和傳遞PILP,成功礦化了膠原纖維。這些前瞻性研究為膠原仿生礦化到牙本質修復的臨床應用之間架起了橋梁,對未來牙本質修復具有重要的意義。
5.3 骨修復
不同于牙,骨在人體具有自修復功能(骨重構)。但在一些情況下,骨不能實現完全自修復,比如骨內富集或殘留毒素引起的骨髓壞死或干細胞分化干擾,大尺寸的骨缺損,骨質疏松等。目前骨修復的主要研究對象包括骨缺損以及骨質疏松。骨缺損是指由創傷、腫瘤或感染引起的骨粉碎或者降解。如果不進行干預,骨缺損是無法愈合的[83]。骨質疏松是由于骨生長和骨吸收失衡造成的。懷孕、哺乳期、絕經、老齡化以及激素水平失調都會引起骨質疏松。骨缺損不愈和骨質疏松都可引起慢性疼痛、行動能力下降、抑郁、睡眠喪失等[84],嚴重影響患者的生活質量和生存能力,需要通過骨修復來幫助骨重建。
骨修復的最佳方法是自體骨移植,但存在二次手術和來源有限的風險和限制。采用異體骨移植存在排異反應和病毒/細菌感染的風險。所以骨修復材料的研究引起了廣泛關注。目前,臨床上采用較多的骨修復材料主要是組織耐受性好和可生物降解的材料[3]。我們主要介紹與仿生礦化密切相關的磷酸鈣材料的生物效應,骨水泥材料、有機-無機復合材料、骨粘膠材料以及一些“軟的”和“活的”的材料以及仿生礦化骨再生研究。
HAP除作為骨礦物增強機械性能外,還被認為具有一定的生物活性,具有誘導骨形成能力。唐睿康課題組對磷酸鈣礦物的骨誘導能力開展了細胞學研究,發現不同尺寸和形貌的HAP在修復骨時具有不同的調節作用。Cai等[85]制備了不同尺寸的HAP納米顆粒,并研究了它們對骨髓間充質干細胞(mesenchymal stem cell,MSCs)和骨肉瘤細胞(U2OS)增殖的影響,發現HAP納米顆粒可以促進MSCs的增殖,同時抑制了U2OS的生長。上述納米級棒狀HAP雖然可以促進骨干細胞生長,但形貌不同于骨中的片狀磷灰石,其中大量暴露的是(100)晶面。為了探究類磷灰石的生物學效應,Liu等[86]合成了類骨片狀HAP(p-HAP)和棒狀HAP,研究它們的細胞生物活性和對骨生成的調節作用。研究發現與棒狀HAP相比,具有(100)面的片狀HAP更顯著促進了間充質干細胞(MSCs)的細胞活力和成骨分化。這些研究對于全面理解骨中的納米磷灰石的生物學效應具有重要的參考意義。
基于磷酸鈣礦物的磷酸鈣骨水泥材料具有良好的降解性和骨誘導能力,是骨修復的重要替代材料,但存在機械性能不足的問題。Moussa等[87]發現在制備磷酸鈣生物陶瓷中引入左旋酒石酸可以減少晶體尺寸,增強生物陶瓷的機械性能,對骨修復具有潛在的應用價值。
除無機礦物作為主要成分外,骨中還存在一定有機物質,是有機-無機復合材料。模仿骨的有機-無機復合材料也是修復骨缺損的理想材料。Li等[88]合成了聚酰胺6(PA6)/HAP納米復合材料,結合了HAP的生物活性、生物相容性和PA6優異的機械增強增韌性能的納米復合材料,在化學和機械性能上接近天然骨。除聚酰胺、聚乳酸等人工合成高分子外,一些生物相容性好、機械性能優良的天然生物高分子,如纖維素、絲素等,也得到廣泛關注,可用于制備良好的骨修復材料。例如細菌纖維素(bacterial cellulose,BC)具有良好的生物相容性和濕態機械性能,Hu等[89]制備了BC/HAP復合材料,實現了骨缺損的修復。
上述骨植入材料雖然具有足夠的強度,但與原骨骼系統的對接還需要依靠骨釘來鉚定,骨愈合后需要二次手術取出。受沙堡蠕蟲膠水下粘結性啟發,Kirillova等[90]制備了基于磷酸四鈣(tetracalcium phosphate)和磷酸絲氨酸復合的一種新型骨粘合劑,可在潮濕的環境中實現骨和骨的高粘合強度,可在幾分鐘內解決骨折修復問題,并可降解吸收,具有很好的骨整合能力。
硬的骨修復材料具有很好的機械支撐作用,但骨形成的早期是一些“軟的”和“活的”凝膠材料。“軟的”水凝膠材料也可應用于骨修復,具有很多獨到的優勢:除了其潛在的骨傳導性和生物降解性外,還可利用可控生長因子釋放和細胞封裝等增加其骨誘導性[91]。Nonoyama等[92]開發了一種新型的雙網絡水凝膠系統,經HAP納米球礦化后的水凝膠具有可滲透性,可用于修復骨缺損。骨形成早期是膠原基質水凝膠材料,但其中含有多種干細胞和功能細胞,是一種“活的”材料。受此啟發,Thrivikraman等[93]在膠原纖維凝膠中內封裝干細胞(hMSCs)、血管和神經細胞,并借鑒PILP的仿生礦化技術,在含NCPs的礦化液中培養,使膠原基質礦化,可在體外得到具有骨樣組織特征的材料,是研究骨再生的很好體外模型。
傳統骨修復材料一般是在體外構筑好,再移植到體內進行骨整合。而骨形成過程,是利用礦化前驅體實現膠原基質礦化的過程。唐睿康課題組的Yao等[94-95]受此啟發,對骨修復進行了一種創新嘗試:向生物活體提供裝配所需的原料(礦化前驅體),而不是在體外進行材料裝配,讓生物利用這些礦化前驅體來幫助骨再生。仿生礦化研究表明磷酸鈣納米團簇是磷酸鈣形成的前驅體,但在溶液中含量極少且容易聚集,不易分離獲取和宏量制備[37]。他們通過借鑒和改進PILP方法,得到了宏觀體量的磷酸鈣聚合物液態前體納米簇(CaP-PILP)材料。該材料富含礦物,呈粘稠狀態,具有較好的流動性。CaP-PILP中富含1 nm大小的磷酸鈣團簇,能實現膠原纖維的礦化,是一種礦化前驅體材料。Yao等[94]將該材料應用于動物顱骨缺損骨修復,取得了良好效果。從圖6中可以看到10周后納米簇在骨缺損內產生了與周圍組織結合良好的修復層。由于CaP-PILP具有流動性,他們還將納米簇材料注射入骨質疏松骨的骨髓腔,發現可以完全治療骨質疏松[95]。該研究是一個重要突破,因為骨質疏松一般認為是不可逆的過程,臨床治療往往以延緩進展為主。在這些研究中,我們是從生物礦化中學習,發展仿生礦化技術,并通過仿生礦化技術得到材料,反過來應用于生物礦化體系中,實現骨再生修復。
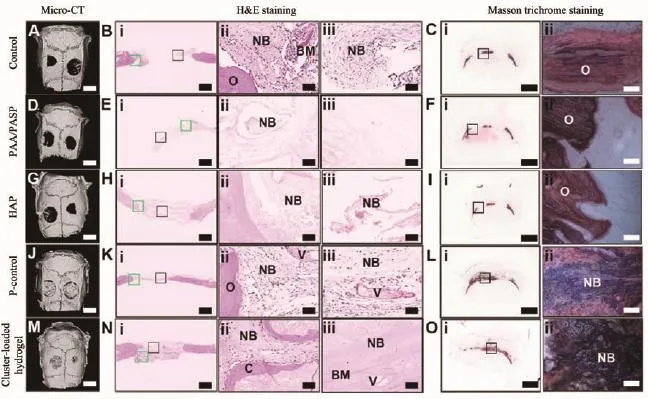
圖6 10周后,對照組、PAA/pAsp、HAP、P-control和納米簇的體內骨再生;(A,D,G,J,M)代表性重建的微CT圖像;(B,E,H,K,N)代表性的HE染色結果,其中包括骨缺損邊緣(綠色矩形)和缺損中心(黑色矩形)的放大圖像;(C,F,I,L,O)具有代表性的Masson三色染色結果,以及骨缺損區域(黑色矩形)的放大圖像[94]Fig.6 In vivo bone regeneration of control,PAA/pAsp,HAP,P-control,and cluster-loaded hydrogel group after 10 weeks:(A,D,G,J,M)Representative reconstructed micro-CT images;(B,E,H,K,N)Representative HE staining results,with zoom-in images of the bone defect margins(green rectangles)and defect center(black rectangles);(C,F,I,L,O)Representative Masson trichrome staining results,with zoom-in images of the bone defect regions(black rectangles)[94]
6 結 論
我國已成為人口老齡化國家,由硬組織老化和損傷引起的健康問題日益嚴重,健康中國已成為國家發展基本方略中的重要內容。硬組織本身是生物礦化的產物,深入學習生物礦化中的生物組織結構、礦化結晶過程和礦化原理、層次結構調控策略以及結構與功能之間的關系,可以啟發仿生礦化研究。發展材料構筑的工程策略以及制備類似生物礦物結構和生物功能的活性材料,有助于人體硬組織修復、幫助硬組織重建、恢復其生理功能甚至強化其生理機能。
近些年,在生物礦化和仿生礦化研究中所發現的非經典結晶途徑、多級有序結構材料的仿生構筑工程策略以及膠原礦化的機制,對于深入理解生物礦化過程和調控機制、硬組織植入材料和誘導再生材料的設計和制備具有重要意義。其中,本課題組基于生物礦化前驅體的礦化策略發展了一些全新的仿生礦化技術,并應用于牙釉質修復、牙本質修復和骨修復等方面,取得了初步的創新成果。特別是最近發展的基于寡聚體和磷酸鈣納米簇材料的礦化方法,可實現全牙釉質的外延修復以及骨缺損和骨質疏松的體內修復,具有很好的應用前景,已引起社會的關注。在膠原礦化仿生研究中,與牙科團隊合作,我們重點解決加速牙本質礦化,提高礦化度以及與粘結劑體系復配使用等臨床應用亟需解決的重要難題,為仿生礦化的研究從基礎走向應用奠定基礎。我們相信,隨著對生物礦化過程和礦化機制的更深入和全面的認識,生物“活”體系的仿生礦化將迎來新的突破,并期待仿生礦化從理論走向應用,從學習走向創新,從“仿生”(體外燒杯實驗)走向“再生”(細胞或體內組織實驗)。
- 無機化學學報的其它文章
- 《無機化學學報》投稿須知(NOTICE TO AUTHORS)
- An N-Alkylated 2-(5-Bromo-4-methylthiophen-2-yl)-imidazo[4,5-f]-[1,10]-phenanthroline Rhenium(Ⅰ)Tricarbonyl Compound Showing Aggregation-Induced Emission Enhancement
- Syntheses,Structures and Magnetic Properties of Manganese Phosphonates
- Two Zn(Ⅱ) and Cd(Ⅱ) Metal-Organic Frameworks with Mixed Ligands:Synthesis,Structure,Sorption and Luminescent Properties
- Syntheses and Crystal Structures of Two Copper Complexes Based on Quinolyl and Pyridyl Substituted Triaryltriazoles
- Plasma-Assisted Fabrication of Ferroelectric Flakes with Single-Unit-Cell Thickness and Characterization of Ferroelectricity

