子宮內膜缺血預處理在EMs細胞凋亡中的抑制作用
王 維,孫 玲,陳麗瓊,孫 燕,高 峰
(巴中市中醫院婦產科,四川 巴中 636000)
子宮內膜異位癥(endometriosis,EMs)是一種臨床常見的婦科病,是雌激素依賴的婦科良性疾病之一,其主要臨床癥狀表現在不孕、慢性盆腔痛、痛經、性交痛等,甚至可誘發惡性腫瘤,對女性身心健康造成極大的影響[1]。目前,有關EMs的具體發病機制仍未完全定論,但血管生成是該病發生和發展的主要環節,而血管內皮生長因子是參與血管生成的主要調節因子[2]。既往研究報道,血管內皮生長因子在缺血缺氧模型組織中的表達水平明顯升高[3-4]。EMs患者在月經前期或早、中期可出現子宮收縮,而子宮收縮可使子宮內膜發生短暫性缺血或處在低灌注狀態,使得局部組織發生短暫性缺血、缺氧,而短暫性缺血、缺氧可影響細胞生存,使子宮內膜增厚,進而導致病變。出于倫理學等方面的考慮,目前是通過建立動物模型展開EMs的研究,特別是相關機制的研究,該類模型類型多樣,但“腹腔注射內膜法”是目前較為符合“經血逆流內膜種植”學說的方法[5],然而目前仍未完全明確“腹腔注射內膜法”構建的子宮內膜缺血模型在EMs中的作用及其可能機制。為此,本研究旨在通過構建子宮內膜缺血預處理和缺血小鼠模型,研究子宮內膜缺血預處理對EMs模型小鼠異位內膜細胞的凋亡抑制作用機制。
1材料與方法
1.1實驗動物
2018年9月至2019年6月于巴中市中醫院動物實驗室展開研究,選擇SPF級C57BL/6雌性小鼠,8~10周齡,體重20~28g,性周期3~5周,由南京君科生物工程有限公司提供,于實驗室進行常規飼養,及時給予飼料和水分。
1.2方法
1.2.1動物模型的構建
以動情期雌性小鼠(經陰道涂片檢測)為供體鼠,肌肉注射卡前列素氨丁三醇注射液(國藥準字H20094183)0.5mg/kg進行缺血預處理,或給予生理鹽水0.1mL,每日1次,共3天;4天后,用5%水合氯醛0.01mL/g經腹腔麻醉,麻醉成功后通過開腹結扎子宮動脈宮端支和卵巢端進行缺血處理,2h后將小鼠處死(用頸椎脫臼法),之后收集子宮內膜并切成大小一致8片(1mm×1mm)。以動情期雌性小鼠(經陰道涂片檢測)為受體鼠,將供體鼠預處理完畢后第4天采集的內膜組織注射至受體鼠腹腔內,每只小鼠腹腔內注入8片內膜,記錄小鼠造模成功率。
1.2.2實驗分組
按照處理方式的不同,將80只受體鼠分為A組(未處理,作為對照)、B組(缺血預處理)、C組(缺血處理)、D組(缺血預處理+缺血處理)、E組(給予Akt抑制劑處理的缺血預處理+缺血處理),每組各16只。將60只供體雌性小鼠隨機分為五組,每組各12只。在受體鼠中,A組不作缺血預處理,第4天后腹腔內不作缺血處理;B組作缺血預處理,第4天后腹腔內未進行缺血處理;C組不作缺血預處理,第4天時開腹進行缺血處理,處理方法與供體鼠相同;D組作缺血預處理,第4天時開腹進行缺血處理;E組肌肉注射卡前列素氨丁三醇注射液前10~15min,靜脈注射Akt抑制劑(LY294002)10μmol/kg,其余處理方法與D組相同。
1.2.3移植內膜存活的測定
留取各供體鼠造模前部分內膜組織為造模前對照組織,根據頸椎脫臼法于造模后第7天將受體鼠處死,觀察受體鼠腹腔移植內膜形態狀況,并對其存活率進行計算。剖腹探查,觀察小鼠異位子宮內膜生長狀況,經HE染色證實造模是否成功,并根據改良的Ishak組織學評分判定病灶是否存活。
1.2.4移植內膜組織形態的觀察
收集受體鼠腹腔移植內膜組織標本,采用4%多聚甲醛固定1天,之后進行常規石蠟切片,切片厚度為3μm,對切片組織進行二甲苯脫蠟和梯度乙醇脫水,之后進行HE染色,于光學顯微鏡下對受體鼠移植內膜組織形態進行觀察。
1.2.5細胞凋亡的檢測
收集造模前和造模后第7天小鼠腹腔移植內膜,嚴格根據TUNEL細胞凋亡檢測試劑盒(購自德國羅氏公司)說明書指示進行細胞凋亡的檢測。將標本切片置于高倍光鏡下進行觀察,隨機選取10個視野,根據棕黃色為凋亡細胞、藍色為正常細胞,對細胞凋亡數進行計算。
1.2.6 Bax、Bcl-2及Akt蛋白表達的檢測
分別取各組受體鼠移植內膜組織100mg,加入細胞裂解液100μL和苯甲基磺酰氟10μL進行勻漿,之后將所得液體置于冰上裂解30min;于4℃下,采用高速離心機以10 000r/min離心15min,棄其上清,將蛋白質樣品進行聚丙烯酰胺凝膠電泳。通過灰度值掃描檢測各組受體鼠移植內膜組織中Bax、Bcl-2及Akt蛋白水平,并與-actin進行比較后得到灰度值比。
1.2.7 Bax mRNA、Bcl-2 mRNA及Akt mRNA的檢測
實時熒光定量PCR儀購自羅氏診斷公司(型號為z480)。Bax、Bcl-2及Akt單克隆抗體均購自美國Santa Cruz公司。采用Trizol試劑盒(美國Invitrogen公司)對造模前內膜組織和受體鼠造模后移植內膜組織總RNA進行提取,之后進行逆轉錄,采用PCR擴增儀(購自美國ABI公司,型號為2720型)對Bax、Bcl-2及Akt基因進行PCR擴增,以擴增-actin為內參物。將5μL Buffer、3μL RT引物及100ng總RNA加入逆轉錄反應體系(逆轉錄酶1μL,0.5μL RNase抑制劑,無RNA酶無菌雙蒸水15μL)中,取逆轉錄產物上、下游引物,加無菌雙蒸水至25μL。于95℃下進行預變性3min,以相同溫度變性30s,50℃退火30s,72℃進行延伸30s,共進行30個循環;72℃延伸3min。實驗重復3次后取其均值為最終所測值。
1.3統計學方法
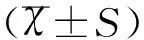
2結果
2.1各組受體鼠移植內膜組織形態觀察結果
于造模后第7天經肉眼觀察可見各組受體鼠均出現病灶;經剖腹探查,可見病灶形成,HR染色鏡下觀察可見血管形成,見圖1。
五組小鼠造模成功率及移植內膜存活率的比較差異均有統計學意義(均P<0.05);B組小鼠造模成功率和移植內膜存活率較A組均明顯上升(均P<0.05),C組小鼠造模成功率和內膜存活率較B組均明顯下降(均P<0.05),D組小鼠造模成功率和內膜存活率較C組均明顯上升(均P<0.05),E組小鼠造模成功率和內膜存活率與D組比較,差異均無統計學意義(均P>0.05),見表1。

注:每幅左下角小圖為HE染色(×200)。
圖1 各組受體鼠移植內膜組織形態觀察結果
Fig.1 Histological observation of transplanted endometria of recipient mice in each group

表1 各組小鼠造模成功率及移植內膜存活率的比較結果[n(%)]Table 1 Comparison of success rate and survival rate of transplantedendometria in mice of each group[n(%)]
注:a與A組比較,P<0.05;b與B組比較,P<0.05;c與C組比較,P<0.05;*每只小鼠腹腔內注入8片內膜。
2.2各組小鼠移植內膜細胞凋亡率的比較
五組小鼠移植內膜細胞凋亡率比較差異具有統計學意義(F=54.95,P<0.05)。B組移植內膜細胞凋亡率為(14.93±3.66)%,A組為(15.97±3.05)%,兩組比較差異無統計學意義(t=0.87,P>0.05);C組移植內膜細胞凋亡率為(84.06±9.36)%,明顯高于B組(t=27.51,P<0.05);D組移植內膜細胞凋亡率為(58.08±8.25)%,明顯低于C組(t=8.33,P<0.05);E組移植內膜細胞凋亡率為(84.13±7.86)%,明顯高于D組(t=9.14,P<0.05)。
2.3各組小鼠Bax、Bcl-2及Akt蛋白表達水平的比較
五組小鼠Bax、Bcl-2及Akt蛋白表達水平比較差異均有統計學意義(均P<0.05)。經Western blot法檢測結果發現,B組Bax、Bcl-2和Akt蛋白表達水平較A組均顯著上升(均P<0.05);C組Bcl-2和Akt蛋白表達水平較B組均顯著下降(均P<0.05);D組Bax蛋白表達水平較C組顯著下降,而Bcl-2和Akt蛋白表達水平較C組均顯著上升(均P<0.05);E組Bax蛋白表達水平較D組顯著上升,而Bcl-2和Akt蛋白表達水平較D組均顯著下降(均P<0.05),見表2。
2.4各組小鼠Bax mRNA、Bcl-2 mRNA及Akt mRNA相對表達量的比較
五組小鼠Bax mRNA、Bcl-2 mRNA及Akt mRNA相對表達量比較,差異均有統計學意義(均P<0.05)。經實時熒光定量PCR檢測結果發現,B組Bax mRNA、Bcl-2 mRNA及Akt mRNA相對表達量較A組均明顯上升(均P<0.05);C組Bax mRNA相對表達量較B組明顯上升,而Bcl-2 mRNA和Akt mRNA相對表達量較B組均顯著下降(均P<0.05);D組Bcl-2 mRNA相對表達量較C組顯著上升(P<0.05);E組Bax mRNA相對表達量較D組顯著上升,而Bcl-2 mRNA和Akt mRNA相對表達量較D組均顯著下降(均P<0.05),見表3。

表2 各組小鼠Bax、Bcl-2和Akt灰度值比的比較結果Table 2 Comparisons of Bax,Bcl-2 and Akt gray scale ratios of mice in each
注:a與A組比較,P<0.05;b與B組比較,P<0.05;c與C組比較,P<0.05;d與D組比較,P<0.05。
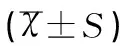
表3 各組小鼠Bax mRNA、Bcl-2 mRNA和Akt mRNA相對表達量的比較結果Table 3 Comparison of relative expression of Bax,Bcl-2 and Akt in mice of each
注:a與A組比較,P<0.05;b與B組比較,P<0.05;c與C組比較,P<0.05;d與D組比較,P<0.05。
3討論
3.1 PI3K/Akt信號通路對EMs研究的作用
目前,存在多種有關EMs的學說,其中“經血逆流內膜種植學說”可較好地解釋這一臨床現象,但此學說未能說明“為何超出90%的女性發生經血逆流,僅有15%的婦女發生EMs”這一狀況[6-7]。EMs除了受p53、白介素-8及腫瘤壞死因子-等多種凋亡及抗凋亡蛋白影響外,Akt等多種信號轉導通路亦參與其病理過程[8-9]。有研究表明,PI3K/Akt信號通路與血管新生存在顯著關系[10]。另有研究認為,PI3K/Akt信號通路與EMs的發生及發展密切相關,并且在磷脂酰肌醇依賴的蛋白激酶協同作用下,PI3K蛋白可通過結合Akt誘導其Thr308位點或Ser73位點發生磷酸化,繼而促使該通路激活并誘導下游蛋白或靶向因子的表達[11-12]。這也是本研究以PI3K/Akt信號通路為研究對象的原因所在。
3.2 PI3K/Akt信號通路與本研究缺血預處理兩者間的關系
有研究表明,常規缺血預處理具有誘導血管內皮生長因子表達的作用[13]。本研究發現,B組小鼠造模成功率較A組明顯升高,D組造模成功率和內膜存活率較C組均明顯升高。此外,本研究顯示,B組移植內膜細胞凋亡數與A組比較并無顯著性差異,其原因有待今后進一步解釋;D組移植內膜細胞凋亡數較B組明顯升高,但較C組明顯下降,提示缺血預處理可提高組織對嚴重缺血缺氧的耐受能力,分析其原因,可能缺血預處理可激活血管新生通路,進而發揮阻滯細胞凋亡的作用。本研究表明,采取“腹腔注射內膜法”具有較高的造模成功率,但C組造模成功率相對較低的原因可能是在對子宮動脈宮端支和卵巢端進行結扎時,因缺血使得血供減少,導致供體鼠體內內膜壞死,所以將內膜組織經腹腔注射至受體鼠后的存活率較低引起。
PI3K/Akt信號通路與促進細胞存活和阻滯細胞凋亡密切相關,而Bax和Bcl-2等均是其下游重要信號分子[14]。有研究顯示,Bcl-2/Bax比例降低而誘導細胞凋亡,而Bcl-2/Bax比例上升可阻滯細胞凋亡[15-16]。本研究表明,經缺血預處理可誘導Bax和Bcl-2蛋白表達改變,并且采用“腹腔注射內膜法”產生的EMs病灶可能是通過激活Akt磷酸化,進而促使其下游靶蛋白Bax和Bcl-2活化,最終起到阻滯細胞凋亡的作用。同時,本研究經實時熒光定量PCR檢測結果表明,經缺血預處理可能起到誘導血管新生和阻滯細胞凋亡的效果;而Akt抑制劑(LY294002)可阻滯PI3K和Akt蛋白磷酸化,因此可阻滯血管新生通路,提示缺血預處理效果可能是經PI3K/Akt信號通路而實現。
綜上所述,子宮內膜缺血預處理可起到有效阻滯EMs異位移植內膜細胞凋亡的作用,且這一抑制作用機制可能與Akt信號通路磷酸化及影響Bax、Bcl-2等下游靶蛋白表達密切相關。

