漢防己甲素聯合化療藥物在斑馬魚體內逆轉多藥耐藥的研究
向文碧,李志操,周棟珍,周艷華,吳西軍,何志旭,舒莉萍*
(1.貴州醫科大學 細胞工程生物醫藥技術國家地方聯合工程實驗室,貴州省再生醫學重點實驗室,兒科學教研室,貴陽 550004; 2.中國醫學科學院成體干細胞轉化研究重點實驗室,貴陽 550004; 3.遵義醫科大學附屬醫院兒科學教研室,貴州 遵義 563000; 4.貴州省貴陽市婦幼保健院/貴陽市兒童醫院,貴陽 550003;5.貴州大學,貴陽 550025)
目前,惡性腫瘤發病率和死亡率仍逐年上升,是威脅人類生命安全的主要疾病之一。 惡性腫瘤主要的治療措施包括化療、放療及手術切除等,但是多數腫瘤的治療效果仍不令人滿意,其主要原因是化療過程中腫瘤細胞產生了多藥耐藥導致化療效果不佳。 多藥耐藥是指最初對單一抗癌藥物產生耐藥的癌細胞后來對結構或功能不同的多種化療藥物產生交叉、廣譜耐藥性的現象[1]。 多藥耐藥的主要機制是ATP 結合盒(ATP-binding cassette,ABC)轉運蛋白通過利用ATP 水解釋放能量將抗腫瘤藥物在細胞內泵出細胞外[2]。 ABCB1(即MDR1)編碼的P 糖蛋白(p-glycoprotein, P-gp)是ABC 家族的主要成員之一,是引起腫瘤多藥耐藥的重要轉運蛋白也是研究熱點之一[3]。
近年來,斑馬魚作為一個新型的模式生物在高通量藥物篩選研究方面擁有其它實驗動物所不具備的天然優勢[4]。 斑馬魚abcb4 基因與人類ABCB1基因的氨基酸序列相似度高達64%[5],且斑馬魚abcb4 基因與藥物在體內的吸收與積累量有關[6]。漢防己甲素(Tetrandrine,TET)是中國傳統的硅肺、自身免疫性疾病、炎癥性肺病、心血管疾病和高血壓的臨床藥物。 大量研究證明,TET 抑瘤作用不明顯,但是與化療藥物組合能通過抑制P-gp 轉運體逆轉化療藥物產生的耐藥性,從而增強化療藥物的腫瘤抑制作用[7-9]。 但是漢防己甲素在斑馬魚體內的毒性研究及其對斑馬魚耐藥基因abcb4 表達的影響,未見相關報道。 因此,本研究通過研究TET 對Tubingen 野生型斑馬魚胚胎早期發育的毒性作用及TET 與化療藥物長春堿(vinblastine, VLB)和阿霉素(doxorubicin,DOX)聯合對多藥耐藥基因abcb4 表達及功能的影響,以期探討漢防己甲素在斑馬魚體內逆轉多藥耐藥的作用。
1 材料和方法
1.1 實驗動物
Tubingen 野生型斑馬魚為本實驗中心自行傳代培育[SYXK(黔)2018-0001],采用0~5 d 的斑馬魚胚胎及幼魚,按照3R 原則給予人道的關懷。
1.2 主要試劑
TET 和VLB 購自美國Sigma 公司;DOX 購自大連美輪;TRIzol 試劑、逆轉錄試劑First Strand cDNA Synthesis Kit 購自芬蘭Thermo 公司;IQTMSYBR Green Supermix 試劑購自美國Bio-Rad 公司。
1.3 實驗方法
1.3.1 斑馬魚養殖方法
Tubingen 野生型斑馬魚養殖于(28±5)℃的循環水系統中,光照/黑暗時間比為12/12 h[10]。 3 個月左右斑馬魚發育成熟后進行交配,交配時將雄魚和雌魚按比例為1 ∶1或2 ∶1放入缸中,用隔板分隔開,次日光照10 min 后拔板,半小時后收集胚胎并清洗雜質,加入胚胎培養液eggwater(0.06 mg/mL海鹽、亞甲基藍)放置于28℃生化培養箱中培養,每8 h 更換一次新的eggwater,吸出死胚。 幼魚5 ~7 d左右以草履蟲喂養,12~15 d 以后以豐年蟲喂養。
1.3.2 毒性實驗
將TET 用eggwater 配制成濃度分別為0、2.5、5、10、20、40 μmol/L 的藥液,挑選受精后12 h(12 hours post-fertilization,12 hpf)且發育時相一致的斑馬魚胚胎,每組100 枚5 mL 藥液于6 孔板內進行藥物暴露,將6 孔板放入鋁盒中置于生化培養箱中28℃避光培育。 每天更換藥液3 次并定時去除死亡的胚胎及幼魚,觀察并統計胚胎或幼魚在不同時相的死亡、孵化、心率和畸形情況。 通過Excel 軟件采用概率單位法計算TET 在斑馬魚上的LC50。
1.3.3 實驗處理分組
本實驗共設置6 個處理組,每組選取100 枚發育正常并且時相一致的的Tubingen 野生型斑馬魚胚胎。 對照(control, CT)組:不加藥液用等體積eggwater 處理;DOX 組:以終濃度為10 μmol/L 的DOX 藥液進行處理[5];VLB 組:以終濃度為3.08 μmol/L 的VLB 藥液進行處理[11];TET 組:用20 μmol/L 的TET 藥液處理;TET 聯合DOX 組:以含有20 μmol/L TET 和10 μmol/L DOX 的混合藥液進行處理。 TET 聯合VLB 組:以含有20 μmol/L TET 和3.08 μmol/L VLB 的混合藥液進行處理。 每個組挑選12 hpf 的胚胎開始藥物處理。 每8 h 更換1 次藥液,直至120 hpf。
1.3.4 實時熒光定量PCR
收集各組120 hpf 藥物處理后的野生型斑馬魚幼魚于1.5 mL Ep 管中(50 尾/管),每管均加入0.2 mL TRIzol 液后用黃槍頭充分吹打制成勻漿。 按TRIzol 法提取總RNA,最后用DEPC 水溶解RNA 并逆轉錄成cDNA。 根據斑馬魚abcb4 基因的mRNA序列(JQ014001,NCBI),設計abcb4 基因引物,F:5 ’-GTTGCTGTATTCTCCTATCG-3 ’, 5 ’-R:ATCTCCAGTCTCG TTCCA-3’,送上海捷瑞公司合成。 根據IQTMSYBR Green Supermix 試劑的反應體系按擴增條件:95℃,10 min;95℃,15 s;55℃,20 s;72℃,20 s;40 個循環進行擴增,并采用2-△△Ct值分析基因相對表達量。
1.3.5 羅丹明123 染色
用eggwater 將羅丹明123 配制成5 mol/L 的染液。 收集各組120 hpf 藥物處理后的野生型斑馬魚幼魚于6 孔板中,每孔50 尾,用eggwater 將幼魚清洗3 次吸干水分后,每組加入5 mL 羅丹明藥液,28.5℃下避光培養2 h。 通過檢測羅丹明123 染料在斑馬魚體力的累積量變化情況檢測斑馬魚的藥物外排功能,從而檢測斑馬魚的耐藥程度變化[12]。
1.3.6 酶標儀檢測幼魚熒光強度
收集各組經藥物處理和羅丹明123 染色后的野生型斑馬魚幼魚,50 尾/組,用1×PBS 洗滌3 次后再加入350 μL 的1×PBS,用研磨棒研磨胚胎直至在顯微鏡下看不到明顯組織塊后,2643 r/min 離心5 min,吸取上清液用多功能酶標儀測定羅丹明123 熒光強度值:激發和發射波長分別為488 nm 和528 nm,每組均設置3 個平行樣。
1.3.7 斑馬魚熒光強度觀察
收集各組經藥物處理和羅丹明123 染色后的野生型斑馬魚幼魚。 用eggwater 反復洗滌幼魚3 次后,將其置于共聚焦皿中,加入適量30 g/L 甲基纖維素進行固定,用活細胞工作站進行觀察并拍照。
1.4 統計學方法
所有實驗均重復3 次或3 次以上, 采用GraphPadPrism 5 軟件的單因素方差進行統計學分析。
2 實驗結果
2.1 TET 暴露對斑馬魚胚胎發育的毒性效應
當藥物濃度低于10 μmol/L 時,胚胎死亡率較低(圖1),對照組、2.5 μmol/L 組在各個時間點的死亡率相差不大。 5 μmol/L 組、10 μmol/L 組、20 μmol/L組和40 μmol/L 組在各個時間點的死亡率緩慢上升,40 μmol/L 組胚胎死亡率從48 hpf 開始迅速升高,至120 hpf,40 μmol/L 組死亡率達到90%。 說明TET 對于胚胎的發育毒性較低,但高劑量的TET 對胚胎仍有致死性。 根據胚胎各時間點的死亡率進行統計分析,得到TET 的半數致死濃度LC50=22.12 μmol/L。
2.2 TET 暴露對斑馬魚胚胎孵化率的影響
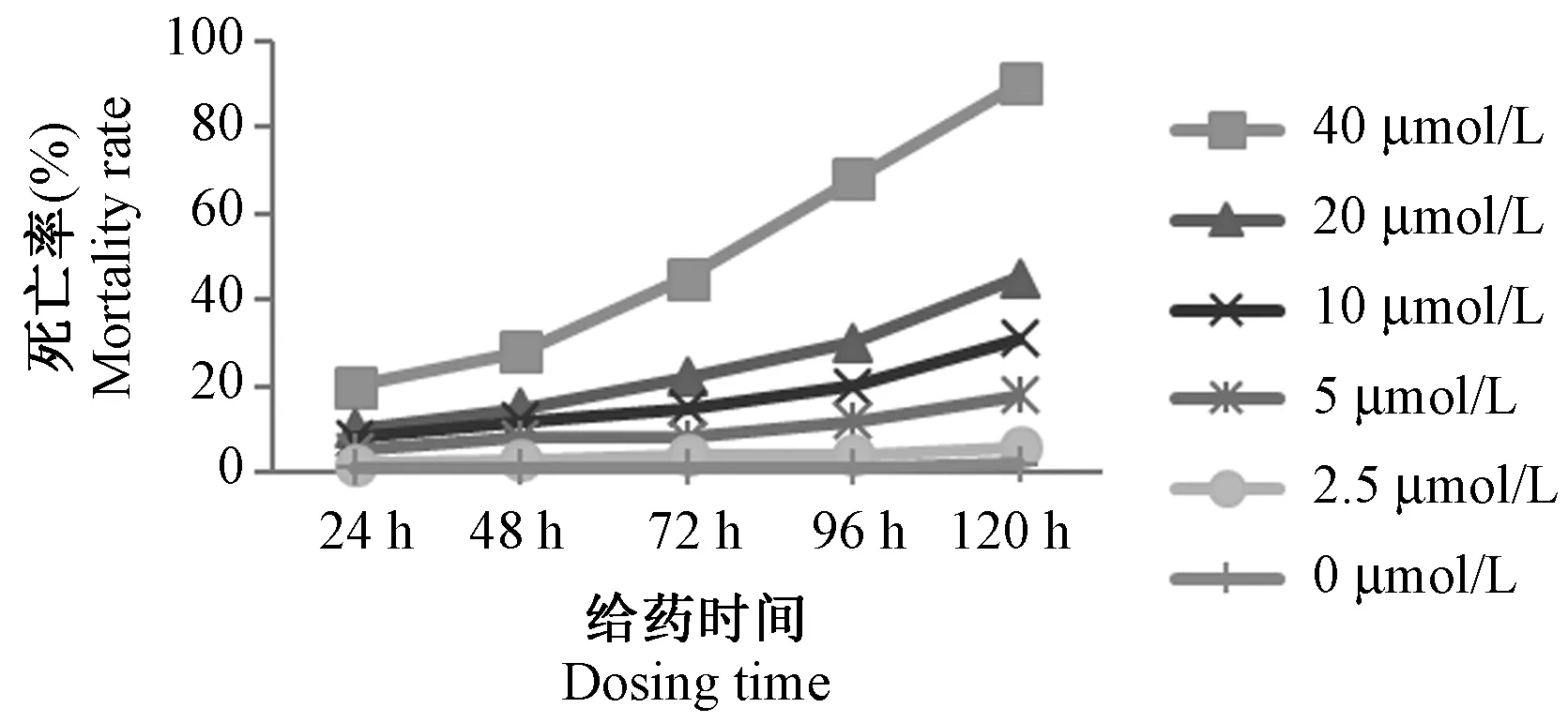
圖1 暴露于不同濃度TET 的斑馬魚胚胎及幼魚死亡率Figure 1 Mortality rate in zebrafish embryos and larvae exposed to different concentrations of Tetrandrine
48 hpf 時,與對照組相比,2.5 μmol/L 組和5 μmol/L組孵化率無明顯變化,當藥物濃度大于10 μmol/L時隨著藥物暴露濃度的增加孵化率逐漸下降(P<0.01);72 hpf 時,2.5 μmol/L 組與對照組相比孵化率無明顯變化,當藥物濃度大于5 μmol/L時孵化率逐漸下降(P <0.001),當藥物濃度為40 μmol/L 時孵化率僅為33.7%(圖2)。
2.3 TET 對斑馬魚胚胎心率的影響
藥物對斑馬魚心臟功能的影響也是評價藥物毒性的一個重要指標,斑馬魚心跳在20 hpf 左右開始出現,心臟大約在48 hpf 左右即可發育完全。 但藥物對斑馬魚發育可能存在抑制作用,故選擇72 hpf 觀察斑馬魚幼魚的心臟跳動,統計在不同濃度下斑馬魚的心率。 結果顯示72 hpf 時斑馬魚的心率在130 ~140 次/分,2.5 μmol/L 組與對照組相比心率變化不明顯,當藥物濃度增加到5 μmol/L 以上時,隨著藥物濃度的增加,斑馬魚的心率呈下降趨勢(如圖3 所示,P<0.001),說明高藥物濃度會降低斑馬魚的心率,影響斑馬魚的心臟功能。
2.4 TET 對斑馬魚胚胎畸形率的影響
與對照組相比,斑馬魚幼魚的畸形率隨著藥物濃度的增加呈明顯的上升趨勢(P <0. 001),表明TET 暴露對斑馬魚有發育毒性作用,當藥物濃 度 為40 μmol/L 時, 幼 魚 的 畸 形 率 高 達82. 7%,見圖4。
2.5 實時熒光定量PCR 檢測結果
不同藥物處理組的斑馬魚經實時熒光定量PCR 檢測結果(圖5)顯示,與對照組相比,DOX 和VLB 單獨處理組abcb4 基因的mRNA 表達增加(P<0.05)。 TET 和DOX 共同處理組及TET 和VLB 共同處理組相比于DOX 和VLB 單獨處理組abcb4 基因的mRNA 表達降低(P<0.01)。

圖2 暴露于不同濃度TET 的斑馬魚胚胎孵化率Note. Compared with the 0 μmol/L group,*P<0.05,**P<0.01,***P<0.001.Figure 2 Embryo hatching rate of zebrafish exposed to different concentrations of Tetrandrine

圖3 暴露于不同濃度TET 的斑馬魚胚胎心率Note. Compared with the 0 μmol/L group,***P<0.001.Figure 3 Heart rate of zebrafish embryos exposed to different concentrations of Tetrandrine

圖4 暴露于不同濃度TET 的斑馬魚幼魚畸形率Note. Compared with the 0 μmol/L group,***P <0.001.Figure 4 Malformation rate of zebrafish larva exposed to different concentrations of Tetrandrine
2.6 野生型斑馬魚的耐藥程度檢測結果
不同藥物處理組的野生型斑馬魚羅丹明123 染色后經活細胞工作站拍攝(圖6A)和酶標儀檢測(圖6B)結果顯示,與對照組相比,DOX 和VLB 單獨處理組熒光強度減弱,耐藥程度增加(P<0.001)。TET 和DOX 共同處理組及TET 和VLB 共同處理組相比于DOX 和VLB 單獨處理組熒光強度增強,耐藥程度顯著下降(P<0.001)。
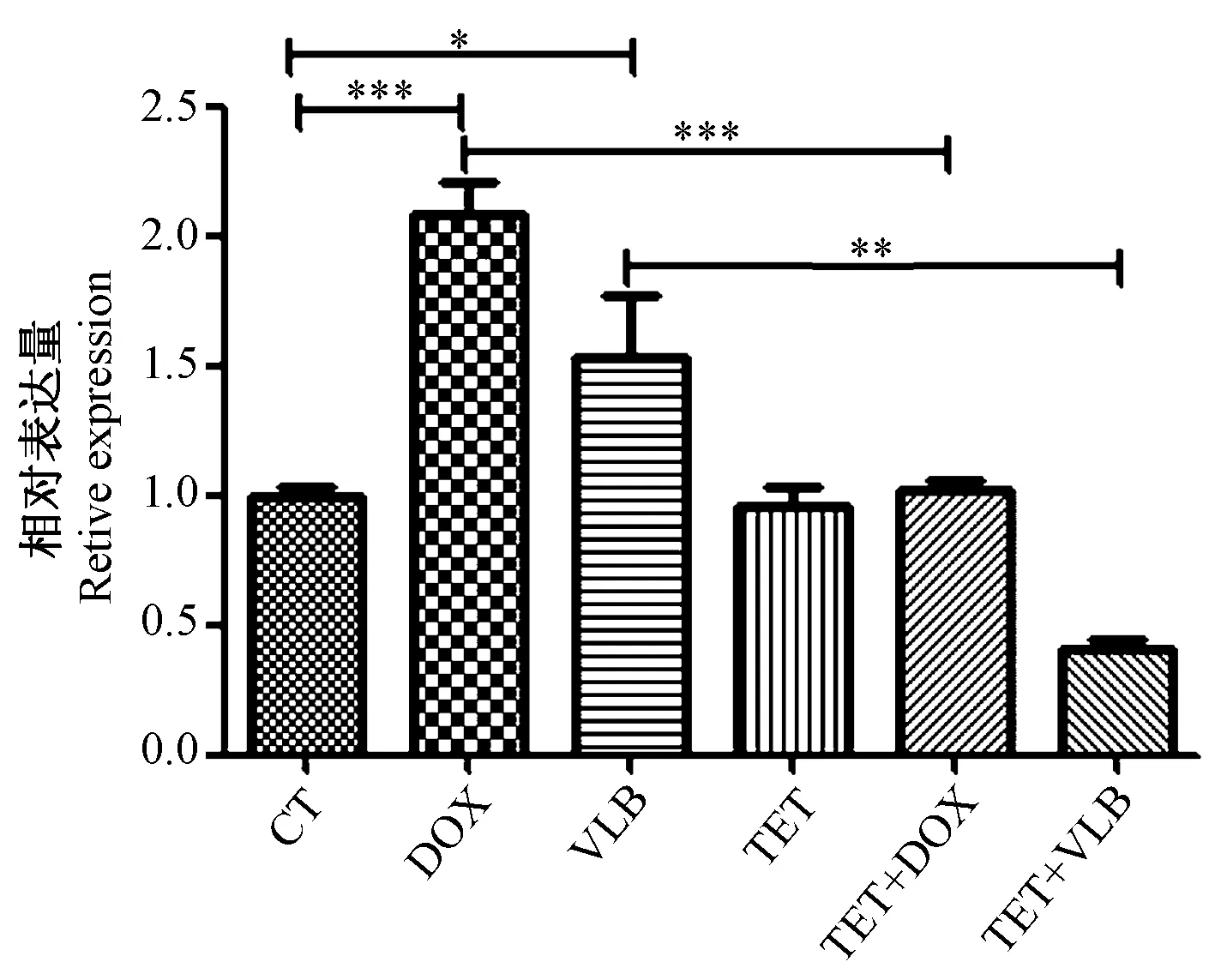
圖5 不同藥物處理后斑馬魚胚胎abcb4基因的mRNA 表達變化Note. The DOX and VLB groups compared with the CT group,*P <0.05. The TET+DOX group compared with the DOX group,**P <0.01.The TET+VLB group compared with the VLB group,***P <0.001.Figure 5 Relative abcb4 mRNA expression of drug-treated wild type zebrafish
3 討論
目前化療仍是腫瘤治療的重要措施之一,化療過程中ABC 轉運體過度表達使藥物外排增加引起的多藥耐藥是導致腫瘤治療失敗的主要原因,而在ABC 轉運體中導致多藥耐藥的首要因素是ABCB1轉運體的過度表達[1,13]。 近年來,斑馬魚作為一個新型的模式生物在高通量藥物篩選研究方面擁有其它實驗動物所不具備的天然優勢,且斑馬魚體內的abcb4 基因與人類ABCB1 基因的氨基酸序列高度相似。 因此,本課題基于斑馬魚的優勢選擇斑馬魚作為實驗動物進行研究。
TET 是一種于植物粉防己的塊根中提取的雙芐基異喹啉類生物堿[14]。 早期因其具有消炎、鎮痛、降壓、抗纖維化等功效而被廣泛應用于臨床治療高血壓、矽肺、肝纖維化等疾病,取得非常好的療效[15]。近年來研究發現,TET 是一種有效的抑制劑,可逆轉由P-gp 轉運體介導的多藥耐藥,在抗腫瘤治療及逆轉腫瘤多藥耐藥方面有良好的應用前景[16]。
本研究利用斑馬魚胚胎進行TET 濃度梯度暴露后,毒性實驗結果表明只有高濃度的TET 有明顯致畸致死效應,而用中低濃度的TET 藥液處理胚胎致畸致死效應不明顯。 通過對死亡率的統計分析得出TET 在斑馬魚胚胎發育早期的LC50=22.12 μmol/L。根據該藥物濃度選用20 μmol/L 對野生型斑馬魚胚胎進行藥物暴露,并收集胚胎進行后續實驗。
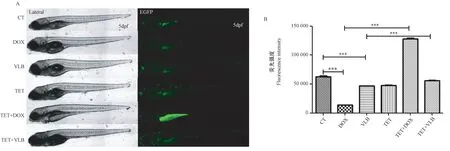
圖6 不同藥物處理后經羅丹明123 染色后的野生型斑馬魚耐藥程度Note. A, Photograph of live cell imaging system. B, Detection of fluorescent expression of EGFP. The DOX and VLB groups compared with the CT group, the TET+DOX group compared with the DOX group,the TET+VLB group compared with the VLB group,***P <0.001.Figure 6 Drug resistance in drug-treated wild type zebrafish stained with Rhodamine 123
通過實時熒光定量PCR 檢測abcb4 耐藥基因的mRNA 表達變化,從而判斷所用藥物是否產生針對abcb4 的耐藥。 結果顯示,通過用DOX 和VLB 藥液單獨處理后,斑馬魚abcb4 耐藥基因的mRNA 表達增高,說明斑馬魚體內的耐藥基因abcb4 被激活使斑馬魚產生了耐藥,這與之前報道的DOX 和VLB藥物能產生針對于ABCB1 耐藥的結果一致[17-19]。此外,還發現TET 聯合DOX 及TET 聯合VLB 共同處理時比DOX 和VLB 單獨處理時斑馬魚abcb4 耐藥基因的mRNA 表達降低,提示TET 能逆轉DOX和VLB 引起的耐藥,這與之前報道的體外試驗中TET 可逆轉P-gp 介導的多藥耐藥性結果一致[8,16,20]。 為進一步驗證TET 在斑馬魚體內能逆轉化療藥物DOX 和VLB 引起的耐藥,本研究采用羅丹明123 實驗檢測不同藥物處理后斑馬魚的藥物外排功能變化,進一步檢測不同藥物處理組的野生型斑馬魚的耐藥程度變化情況。
羅丹明實驗結果顯示,經DOX 和VLB 處理后斑馬魚體內羅丹明染液累積量降低,說明斑馬魚體內產生了針對abcb4 的耐藥,DOX 和VLB 藥物暴露后,abcb4 編碼的P-gp 轉運體激活將羅丹明染液排出體外從而導致斑馬魚體內羅丹明染液累積量降低,與實時熒光定量PCR 檢測到的結果一致。 此外,TET 聯合DOX 及TET 聯合VLB 共同處理時比DOX 和VLB單獨處理時斑馬魚體內羅丹明123 染液累積量增加,提示TET 能逆轉DOX 和VLB 引起的耐藥,這與實時熒光定量PCR 檢測結果一致。 此外,TET 聯合DOX共同處理比TET 單獨處理時斑馬魚體內羅丹明123染液累積量增加,而abcb4 耐藥基因的mRNA 表達量無明顯差異,提示TET 聯合DOX 時TET 可能通過下調abcb4 的表達量和降低abcb4 轉運體的活性兩種方式逆轉DOX 引起的耐藥。
綜上所述,本研究首先證實了TET 對斑馬魚具有較低的發育毒性;其次,證實斑馬魚體內的abcb4基因相關耐藥機制與人體內ABCB1 基因相關耐藥機制高度保守。 最后確定TET 對易引起腫瘤耐藥的DOX 和VLB 有逆轉耐藥的作用,為TET 的臨床應用提供有力的實驗依據,同時也證實了斑馬魚在藥物篩選方面的可行性。

