麻醉對建立大鼠重度創傷失血性休克模型的保護性作用
向成芳,駱立暉,趙會民*,陸 勇,楊 康,曾 歡,韋婷潔
(1.廣西醫科大學第二附屬醫院, 南寧 530007; 2.廣西醫科大學第一附屬醫院, 南寧 530021;3.郴州市第一人民醫院, 湖南 郴州 423000)
隨著交通事故、自然災害、暴力事件等頻繁發生,創傷占全世界死亡構成比的10%和致殘人數的16%,且受害人群主要是青壯年(18 ~45 歲)[1]。 創傷失血性休克是臨床急診急救中的常見病種,在大多數嚴重創傷危及生命的早期幸存者中,應用麻醉藥是很常見的。 全身麻醉劑的使用是否以及在多大程度上影響重度創傷的預后尚不清楚,全麻藥對結果測量的潛在混淆效應通常被忽略[2]。 多年來,動物研究對組織損傷和出血引起休克的生理學有了基礎的了解[3-4]。 然而以往大部分創傷失血性休克損傷的動物模型均是在麻醉狀態下制成的,難以判斷創傷后意識狀態及活動性變化,嚴重影響了動物對創傷失血性休克的應激反應,所以與臨床實際有一定的差異。 模擬出與臨床創傷休克接近的動物模型是至關重要的。 并且近幾年有少量實驗已經使用清醒狀態下動物模型應用于動物基礎實驗研究[5-6]。 但并沒有闡述清醒狀態下創傷失血性休克動物模型的基本特點。 本研究試圖改進傳統創傷休克模型,對比全身麻醉與清醒狀態下STHS 大鼠模型,探索麻醉對STHS 大鼠的影響,通過持續建模過程中血流動力學、動脈血氣指標、器官損傷病理情況,以期為重度創傷失血性休克患者提供新的治療視角。
1 材料和方法
1.1 實驗動物
SPF 清潔型健康雄性Sprague-Dawley(SD)大鼠40 只(7 ~9 周),體重250 ~350 g,由廣西醫科大學實驗動物中心提供[SCXK(桂)2014-0002];適應性隔離間飼養1 周,周圍環境溫度恒定(23±1)℃,濕度(50±5)%,光照遵循晝夜節律,每籠5 只,給予正常標準飼料,飲用水。 大鼠實驗操作與組織取材均與廣西醫科大學實驗動物中心設施內進行[SYXK(桂)2014-0003]。 本實驗通過廣西醫科大學實驗動物中心和實驗動物委員會批準(201907050),并且嚴格按照實驗動物使用的3R 原則給予人道主義關懷。
1.2 主要試劑與儀器
0.9%氯化鈉注射液、戊巴比妥鈉粉末(北京化學試劑公司,北京);肝素鈉注射液(天津藥業,中國);鹽酸利多卡因注射液(上海朝暉藥業)‘全自動動 脈 血 氣 分 析 儀 ( ABL90FLEV, 丹 麥RADIOMETER); 多通道生理記錄儀(BIOPAC MP160,美國);大鼠固定架(溫州原上草醫療科技有限公司);顯微解剖手術器械(廣州萊賽),醫療實驗用聚乙烯半透明毛細軟管(PE50,永發塑料商行),三通閥(BD Connecta,美國)。
1.3 實驗方法
1.3.1 實驗分組
選取40 只健康雄性SD 大鼠隨機分成四組(n=10),分別:清醒對照組(conscious control group,CC)、清醒創傷失血性休克組(conscious traumatic hemorrhage shock group, CTHS)、 麻 醉 對 照 組(anaesthesia control group,AC)、麻醉創傷失血性休克組休克組(anaesthesia traumatic hemorrhage shock group,ATHS)。
1.3.2 模型制備
動物模型均在無菌操作間進行,動物稱重后,采用3%的戊巴比妥鈉溶液(0.1 mL/100 g)經腹腔注射進行麻醉,待大鼠疼痛反應消失、眼瞼反射消失、肌肉松弛,麻醉平穩后,剪毛備皮,充分暴露手術范圍,酒精消毒腹部,大腿內側皮膚,將動物四肢用醫用膠帶固定在自制大鼠手術臺上,手指觸摸左右側股動脈搏動,沿腹股溝作1~2 cm 切口(左右側腹股溝),逐層鈍性分離皮下組織,避開皮下血管,分離股動脈和股靜脈,暴露股動脈、靜脈,準備肝素化PE50 管進行插管、結扎、內固定與腹股溝筋膜,外固定于大腿上內側皮膚,防止大鼠掙脫,插管完畢后通過股動脈插管分別注射肝素鈉(500 U/mL)溶液0.1 mL 封管,左側股動脈用于血流動力學監測,檢測并記錄大鼠平均動脈壓(MAP)、心率(HR)、左心室壓力最大上升/下降速率(± dp/dt max)每5 min 記錄一次生理指標,記錄至40 min;右側股動脈用于放血及血樣采集,左股靜脈用于靜脈麻醉通道。 各組每個放血步驟時間點,放血留取后200 μL 用于血氣測量;對照CC、AC 組僅進行雙側股動脈置管,CC 組等待大鼠完全清醒,穩定10 min鐘后,持續監測血流動力學40 min;AC 組持續麻醉,若大鼠出現覺醒傾向(擺尾,胡須抽動,舔舌,四肢抖動等)立即予以經左股靜脈注射3%戊巴比妥鈉0.1 mL 追加劑量,保持麻醉效果適中,持續監測血流動力學40 min;
ATHS、CTHS 組均在腹腔制造開放性創口(沿腹白線作5 cm 直線切口),肌層采用間斷縫合4 針,皮膚層及皮膚下黏膜層予以中點縫合1 針,術后予以0.1%利多卡因涂抹手術切口,用濕紗布覆蓋腹部傷口,手術時間控制在40 min 內完成,用固定架固定大鼠制動;THSA 組等待大鼠清醒(大鼠四肢,尾,頭頸,舌頭活動自如),穩定10 min;右側股動脈連接多功能生理測量儀,持續監測血流動力學;經左側股動脈放血,定量定時控制性放血,按體質量的7%放其全身血量的50%,THSB 組完成開放性創口與置管后,持續麻醉狀態下進行放血,若發現大鼠有覺醒傾向,立即予以追加戊巴比妥鈉劑量0.1 mL,保持適當麻醉效果(麻醉過程中大鼠無呼吸困難、抽搐、嘔吐、流涎等不良反應),放血量與THSA組一致;
放血過程分為6 個步驟三個階段:CTHS、AHSB組放血過程一致,CC、AC 組均在創傷休克組相應的放血時間點取200 μL 血液進行血氣測量;放血前記為時間點T0,分6 個時間點進行放血:第一個時間點(T1)監測10 min 正常穩定血流動力學后立即不控速(5~10 mL/min)放其全身血量的25%,用采血管連接三通閥開口其他時間點均用1 mL 無菌注射器連接三通閥開口;第二個時間點(T2)停置15 min 后,控速(0.5 mL/min)歷時2 min 放其全身血量的5%;第三個時間點(T3):停置5 min 后,控速(0.5 mL/min)歷時2 min 放其全身血量的5%;第四個時間點(T4):停置5 min 后,控速(0.5 mL/min)歷時2 min 抽取全身血量的5%;第五個時間點(T5):停置5 min 后,控速(0.33 mL/min)歷時3 min 抽取全身血量的5%;第六個時間點(T6):停置5 min 后,控速(0.33 mL/min)歷時3 min 抽取全身血量的5%;T1 稱為第一階段(不控速自主流血階段),T2、T3、T4 稱為第二階段(控速自主流血階段),T5、T6 稱為第三階段(控速被動流血階段);放血時長(46±2.1)min 均大體一致,CTHS組到達最大放血量時血壓為(36.87±11.93)mmHg(1 mmHg=0.133 kPa),ATHS 組到達最大放血量時血壓為(25.24±2.59)mmHg(1 mmHg=0.133 kPa),制成重度創傷失血性休克大鼠模型;
以放血結束后MAP 降至25 mmHg 或出現呼吸衰竭或存活時間達4 h 為實驗終點;分別觀察并比較其T0~T6 時間點生理狀態、血流動力學、血氣分析,以及休克后CTHS、ATHS 組MAP 的動態變化。到達實驗終點予以過量3%戊巴比妥鈉(1 mL)靜脈注射致安樂死,迅速取出心臟、肝、腎、肺浸泡于組織固定液中,隨后比較各組病理學切片等情況。
1.3.3 觀察指標
生理指標:主要觀察大鼠的呼吸、末梢循環情況、尿量等在實驗過程中的生理變化情況。
血流動力學指標:T0 為放血前,分別于T1、T2、T3、T4、T5、T6 相應放血時間點后選取1 min 持續監測時間段,觀察大鼠平均動脈壓(MAP)、心率(HR)、左心室壓力最大上升/下降速率(±dp/dt max),取各時間段平均值作為測量值,休克后持續監測創傷休克組MAP 變化情況。
動脈血氣分析指標:T0 為首放血時取血樣,分別于、T1、T2、T3、T4、T5、T6 時間點最后0.3 mL 動脈血樣,在15 min 內進行血氣分析測量。 測定酸堿度(PH 值)、 氧 分 壓(PaO2)、 二 氧 化 碳 分 壓(PaCO2)、血紅蛋白(ctHb)、乳酸(Lac)、血糖(Glu)、碳酸氫根濃度(cHCO3
-)、堿剩余(BE)。
病理檢查:各組到達試驗終點處死動物進行常規檢查后并迅速提取肝、心臟、肺、腎,浸泡在組織固定液中,送往廣西醫科大學實驗中心進行石蠟切片,HE 染色。
1.4 統計學方法
采用SPSS 20.0 統計軟件。 計量數據均以平均數±標準差(±s)表示,同一時間段內各組間比較采用單因素方差分析,若存在差異,兩兩比較采用LSD-t 檢驗;同組間不同時間點的比較采用重復測量方差分析,若存在差異,兩兩比較采用LSD-t 檢驗; P<0.05 為差異有統計學意義。
2 結果
2.1 一般生理指標的變化
各組大鼠休克前體重、體溫、麻醉起效時間、麻醉時長,CTHS、ATHS 組放血量、放血時長、休克時體溫差異無統計學意義(P<0.05)(如表1 所示)。 CTHS組放血過程中生理學特征表現明顯,放血至T3、T4、T5 時,大鼠出現明顯躁動,掙扎,不配合的狀態,同時伴隨著呼吸頻率明顯加快,上肢、耳朵、嘴唇等部位迅速蒼白,同時按壓無回血,末梢循環明顯減弱;放血至T6 時,大鼠活動性明顯減弱,精神萎靡,上肢、耳朵、嘴唇明顯蒼白,實驗過程無尿。 ATHS 組全程處于全麻狀態,配合實驗進程,呼吸平緩,無明顯變化,放血至T4~T5 時可見上肢、耳朵、嘴唇逐漸蒼白,按壓末梢循環無回血,放血至T6 時,上肢、耳朵、嘴唇明顯蒼白,實驗過程有尿(2 ~3 次)。 各組實驗中均發現明顯呼吸衰竭現象,因此實驗終點均以MAP 降至25 mmHg 或存活時間達4 h 為實驗終點。 CC、AC、ATHS組存活時間均大于4 h,實驗終點定義為存活時間為4 h;CTHS 組存活終點定義為MAP<25 mmHg,存活時間為(52.4±8.8) min。
2.2 各組血流動力學變化情況
大鼠休克放血過程中(T1、T2、T3、T4、T5、T6),在對照組中:與CC 組比較,AC 組MAP、HR 差異有統計學意義(P<0.05),當然在整個實驗中,各指標存在一定的波動性;CTHS、ATHS 組HR、±dp/dt max隨時間的變化均存在顯著差異(P<0.01),ATHS 組HR、±dp/dt max 均呈降低趨勢,而CTHS 組先降低(T1)再升高或穩定(T2、T3、T4、T5、T6)最后下降至死亡,發展時間極快(約50 min);MAP 在T4 時達到最低,隨后有上升趨勢(如圖1 所示)。 然而CTHS、ATHS 組休克后30 min 開始MAP 變化情況得到反轉,CTHS 組呈直線下降趨勢,而ATHS 直至存活四小時,血壓維持在40 ~70 mmHg 的低血壓水平(如圖2 所示)。
2.3 各組動脈血氣分析變化情況
休克放血過程中(T1、T2、T3、T4、T5、T6)在對照組(AC、CC 組)中未見明顯差異,CTHS、ATHS 組PH、PaCO2、ctHb、cHCO3-、BE 呈逐漸下降趨勢,除PH、ctHb 外,CTHS 組下降幅度顯著大于ATHS 組(P <0.01);Glu、Lac、PaO2呈逐漸上升趨勢,且CTHS 組上升幅度顯著高于ATHS 組(P<0.01)(如圖3 所示)。
2.4 各組大鼠病值理切片情況
對照組(CC、AC):可見各臟器完整,大小正常,表觀鮮紅,血液充盈;HE 染色鏡下可見肝、心臟、肺、腎結構正常、未見細胞壞死,少量炎性細胞浸潤。 ATHS 組:各臟器表觀較血液充盈欠佳,稍發白,可見心臟代償性增大,肺下葉可見多發水腫,肝大小無明顯差異,未見淤血,腎較對照組稍增大,表觀發白,無明顯水腫淤血;HE 染色鏡下各臟器結構尚正常,以可見大量腎小管上皮壞死,肺泡結構少量破壞,和紅細胞少量滲出,各臟器均可見炎性細胞浸潤。 CTHS 組:各臟器表觀呈明顯發白,缺血樣,可見心臟明顯增大,心臟壁薄,肺和腎可見1 ~2處水腫區,肝呈紅白相間像;HE 染色鏡下可見,肺、腎、心臟結構破壞,明顯大量紅細胞滲出及細胞水腫壞死(紅色箭頭標記處),伴隨少量炎性細胞浸潤(見圖4)。
表1 各組大鼠一般情況(±s,n=10)Table 1 General conditions of the rats in each group
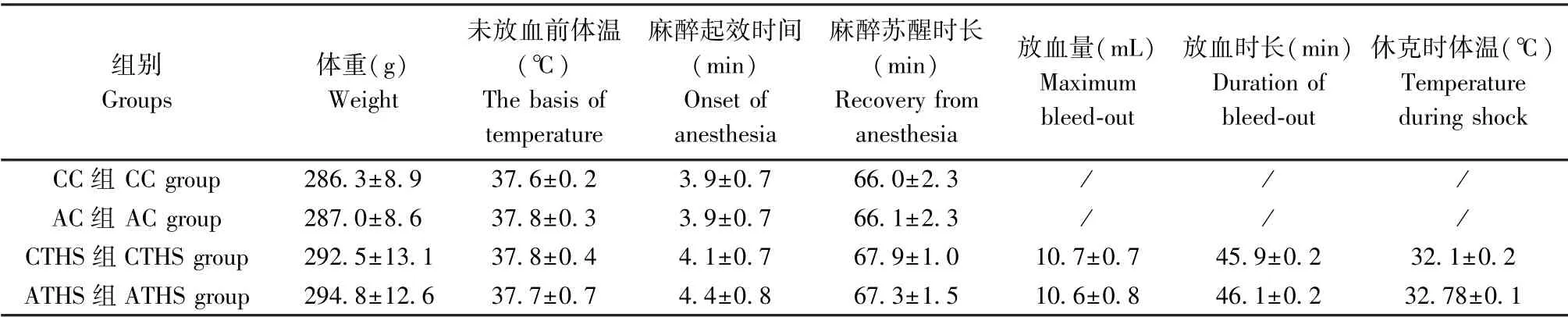
表1 各組大鼠一般情況(±s,n=10)Table 1 General conditions of the rats in each group
注:CC 與AC 組均未進行放血處理,放血量、放血時長、休克時體溫無數據顯示。Note. The CC and AC groups were not bled, and no data were displayed on the maximum bleed-out, duration of bleed-out, or temperature during shock.
組別Groups體重(g)Weight未放血前體溫(℃)The basis of temperature麻醉起效時間(min)Onset of anesthesia麻醉蘇醒時長(min)Recovery from anesthesia放血量(mL)Maximum bleed-out放血時長(min)Duration of bleed-out休克時體溫(℃)Temperature during shock CC 組CC group 286.3±8.9 37.6±0.2 3.9±0.7 66.0±2.3 / / /AC 組AC group 287.0±8.6 37.8±0.3 3.9±0.7 66.1±2.3 / / /CTHS 組CTHS group 292.5±13.1 37.8±0.4 4.1±0.7 67.9±1.0 10.7±0.7 45.9±0.2 32.1±0.2 ATHS 組ATHS group 294.8±12.6 37.7±0.7 4.4±0.8 67.3±1.5 10.6±0.8 46.1±0.2 32.78±0.1
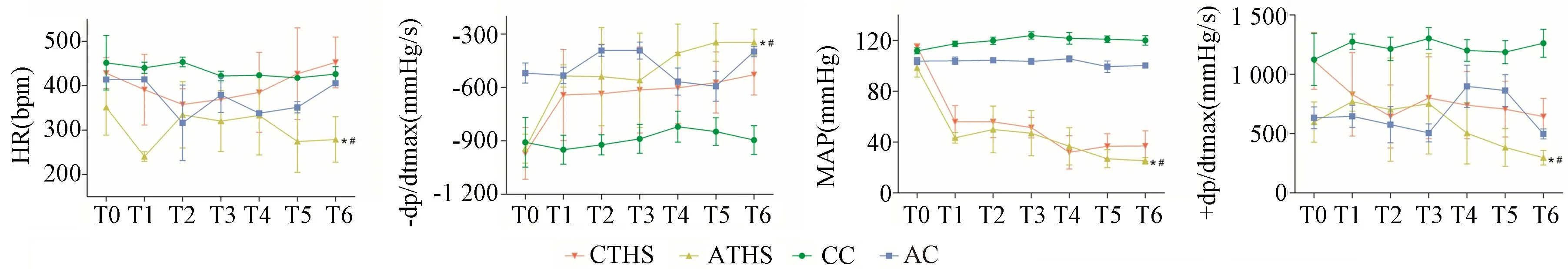
圖1 各組血流動力學變化情況Note. Compared with the CC and AC group, *P<0.05. Compared with the CTHS group,#P<0.05.Figure 1 Evaluation of hemodynamics in each group
3 討論
創傷仍然是當今世界的一大衛生難題,并且創傷休克動物模型也是當今創傷研究領域的一道難題。 創傷麻醉師在面對嚴重創傷休克患者時有多種相互矛盾的問題,在保證充分的復蘇基礎上,針對需要對氣道管理、高級創傷支持、手術止血等危重護理,選擇麻醉劑是確保最佳效果的關鍵[7]。 然而對于正在進行復蘇和血液動力學不穩定的患者使用麻醉誘導和維持劑的管理仍然尚存爭議[8]。為了開發新的治療方法,我們需要更好的了解重度創傷失血性休克病理生理學。 然而,由于急性損傷和可變原因以及傷員管理的變化,人體研究具有挑戰性,隨機對照實驗很難進行。 體外研究未能復制重度創傷失血性休克的細胞/組織/器官相互作用的復雜病理生理學(如失血低灌注、血流動力學、代謝改變等等)。 因此,在體內建立創傷與休克動物模型是機制研究發現的必要條件。 本研究選用適用于創傷基礎研究模型,易于實現和控制創傷休克以及可準確測量血流動力學、動脈血氣等的大鼠作為研究對象,試圖建立改良大鼠重度創傷失血性休克模型,比較全身麻醉與清醒狀態下STHS 大鼠,通過對大鼠生理學特征觀察,持續監測休克過程中血流動力學及休克后MAP、動脈血氣分析的變化情況,以及到達實驗終點時大鼠各臟器的病理學檢測,研究麻醉對創傷失血性休克各臟器的影響,利用各動物模型的優點,發揮最大的研究價值。
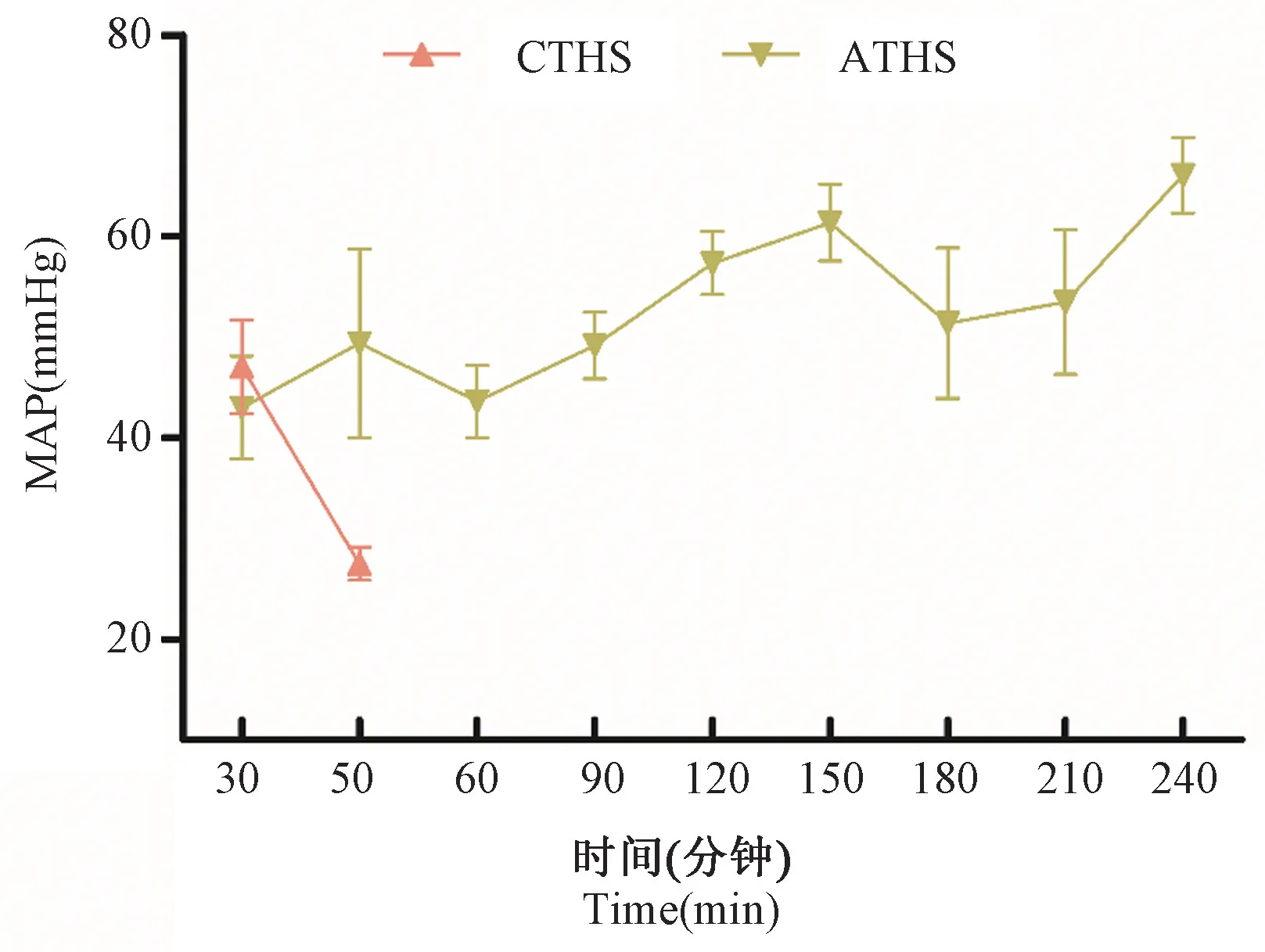
圖2 CTHS、ATHS 組休克后30 min 到實驗結束時MAP 變化情況Note. Since the survival time of the CTHS group was(52.4 ± 8.8) min, no data was shown for MAP 50 minutes after shock.Figure 2 The changes in the MAP in the CTHS and ATHS groups 30 minutes after shock to the end of the experiment
在體內建立創傷與休克動物模型是實驗機制研究的必要條件。 多年來,國內外學者采用了多因素復合致傷法,相繼建立了一些新的創傷失血性休克模型, 但由于存在著診斷標準不明確、施加因素(創傷)難以定量、致病因素單一、個體差異、成功率低等缺點,并且由于研究目的特殊性、失血休克發生的不穩定性,以及應用范圍的限制,動物實驗與臨床實際不一致性,迄今為止仍沒有建立公認的實驗動物模型標準[9-12]。 創傷是THS 損傷模型的重要組成部分。 軟組織損傷、骨折、內臟損傷以及組合損傷都有在動物模型中誘導,以模擬臨床實情。特定類型的損傷會引起不同的生理和炎癥反應,目前動物模型較常用的剖腹軟組織擠壓損傷用來模擬在器官和組織中誘導缺血和炎癥反應,加重失血性休克的嚴重程度[13]。 動物模型的出血休克方案有三種:控制性失血包括固定容量性失血和固定壓力性失血以及非控制性出血[11,14-17]。 固定容量性失血(fixed-volume haemorrhage, FVH)可以評估不同創傷模型和跨物種之間的代償性血流動力學反應;缺點是低血壓和休克的程度沒有固定的定義,體積個體差異大[18]。 在臨床前研究中,FVH 模型被廣泛用于測試復蘇方案,主要應用于大型實驗動物(如豬)[19],同時也被報道用于研究復蘇對大鼠生存和神經系統的影響以及Toll 樣受體(TLR)在創傷相關炎癥過程中的作用[20-21]。 本實驗通過選取同一批同齡大鼠,以腹部開放性創口(沿腹白線減少出血量)間斷縫合與失血性休克為主導因素,嚴格控制放的量和速度以及放血的時間點,減少個體差異,維持一個相對穩定的休克程度,比較麻醉與清醒狀態下放血大鼠休克進程與臨床特征。 雖然未能將創傷與放血同步進行,與臨床實際存在一定差異,但在清醒狀態下控速放血(先快后慢)可以進一步模擬實際情景。 同時選擇與臨床實際特點相似的創傷休克研究模型,實驗方法及檢測方法是非常重要的。 本實驗建立麻醉與清醒大鼠STHS 模型,采用常用動物實驗麻醉藥戊巴比妥鈉進行麻醉,并有研究在予以參考麻醉劑量正常大鼠實驗中發現戊巴比妥鈉對心血管系統影響較小[22]。 通過檢測與臨床檢測特點相似的方法學(生命體征、血流動力學、動脈血氣等),確定麻醉與清醒STHS 大鼠模型具有可重復性、可控性、穩定性、易操作性等特點。
清醒與麻醉狀態下制造STHS 模型過程中是存在巨大差異的,同時結果也是截然不同。 主要表現在以下幾個方面:一般生理情況,CTHS 組可以實時觀察到整個休克過程中大鼠的生命體征的變化,與人體應激表現相似,體溫驟減,幾乎無尿。 而ATHS組整個實驗過程是在麻醉下進行,無法觀測到本能應激反應。 隨著STHS 血容量顯著降低,血壓降低,器官組織灌注銳減,細胞缺氧,繼發性器官損傷,心血管反應性降低。 本研究發現,在麻醉狀態下,放血過程中HR 沒有明顯加快、±dp/dt max 也沒有增強,MAP 呈持續下降趨勢;而CTHS 組HR 代償性增快,±dp/dt max 也增強,MAP 在放血后期有上升趨勢。 提示在麻醉狀態下,在放血過程中ATHS 循環阻力增高,心臟功能受到抑制,MAP 顯著降低,易呈現低血壓狀態。 與臨床創傷需行手術患者預防低血壓情況相似[23]。 而到達最大放血量以后,CTHS組經過短暫的代償期以后,迅速進入失代償期致死亡;反之ATHS 組MAP 逐漸上升。 提示ATHS 組代償期明顯較清醒組時間長,耐受血管低反應性強。當然這些結果是否存在大鼠類特異性? 需要進行其他類型動物的研究需要進一步探索。 動脈血氣分析是評估氧合和通氣充分性的金標準,與休克損傷程度密切相關。 本研究發現麻醉狀態下,將減少放血過程中大鼠應激所致耗氧、耗能,并降低機體氧代謝,明顯可見其Glu、Lac、PaO2升高幅度低于CTHS 組而PH、PaCO2、ctHb、cHCO-3、BE 降低幅度顯著低于CTHS 組。 提示CTHS 組休克病程更快、病情更重,氧動力學嚴重失衡,加速死亡。
綜上所述,發現麻醉在失血過程中降低MAP、HR,抑制心臟收縮做功,予以同樣的創傷和休克后,經歷低血壓狀態后MAP 逐漸回升,可達到正常水平的25%~40%;在失血過程中顯著減少應激耗能耗氧、緩解呼吸和代謝產物堆積,改善預后MAP,顯著減輕各器官的損害,表現出提高大鼠建立STHS 模型的耐受性,發揮保護性作用。 進一步提示創傷研究者需要考慮所使用的實驗方法(如麻醉、手術操作)對模擬的創傷(出血/損傷)動物體內平衡的內在影響,以期為創傷失血性休克相關動物模型的制作和選擇提供借鑒。

