液質飼料喂養制備酒精性心肌病小鼠模型
廉 虹,劉立會,聶 宇
(中國醫學科學院,北京協和醫學院,國家心血管病中心,阜外醫院,心血管疾病國家重點實驗室,北京 100037)
酒精性心肌病是一類由于長期過量飲酒導致的心肌病,是臨床上常見的引起心力衰竭的原因,主要特征表現為左心室質量增加、心室擴張、室壁變薄和心室功能不全或伴有不同類型的心律失常[1]。 其具有發病率高,預后差的特點,早期不易發現,容易被誤診,晚期易出現心力衰竭,有些患者最終走向必須進行心臟移植的地步[2-3]。 隨著社會經濟的高速發展,人民生活水平不斷提高,飲酒已不再是一種奢侈行為,導致酒精性心肌病發病率逐年上升。
酒精性心肌病臨床表現類似擴張型心肌病,并且目前尚無特異性的組織病理、生化標志物作為病理學方面判斷酒精性心肌病的依據,所以區分酒精性心肌病和擴張型心肌病,一直是臨床上的難題[4-6]。 目前而言,酒精性心肌病的診斷只能通過患者的過量長期的飲酒史將其從擴張型心肌病中區分出來[7]。 雖然這兩種心肌病的臨床表型非常相似,但是造成同樣結局的機制理論上來說是完全不同:擴張型心肌病主要的原因是遺傳導致的[8-9],而酒精性心肌病發病原因很顯然不屬于經典遺傳學范疇。 因此,用于研究擴張型心肌病機制的動物模型,雖然與酒精性心肌病具有相同的表型特征,但是不能用于酒精性心肌病的病理機制研究的。所以,為了揭示酒精性心肌病的發病機制以及得到更好的預后和治療方法,構建良好的酒精性心肌病模型是十分必要的。
本研究通過添加了乙醇的成分明確、能量平衡的液體飼料長期喂食,成功構建了酒精性心肌病小鼠模型,為酒精性心肌病的機制研究提供了良好動物模型。
1 材料和方法
1.1 實驗動物
8 周齡SPF 級別C57BL/6 小鼠30 只購買于維通利華實驗技術有限公司[SCXK(京)2016-0011],全部為雄鼠,飼養至16 周(體重27~32 g)進行液體飼料喂養。 小鼠飼養于中國醫學科學院阜外醫院心血管疾病國家重點實驗室小動物平臺屏障環境動物房[SYXK(京)2017-0015],飼養間溫度(23±2)℃,12 h/12 h 明暗交替照明。 動物實驗中涉及的動物所有操作程序符合3R 原則,已經得到中國醫學科學院阜外醫院實驗動物管理和使用委員會的批準,批準號:FW-2017-0004。
1.2 主要試劑與儀器
液體飼料成分(Lieber-DeCarli)購自創亞化工(上海)有限公司,產自德國Bio Serv 公司(貨號:F1697SP);麥芽糖糊精(貨號:3585),液體飼料喂養瓶(貨號:9019),喂養瓶固定器(貨號:9015),95%乙醇購于北京化工廠;4% 多聚甲醛溶液購于北京益利精細化學品有限公司;小鼠心臟超聲儀(Vevo 2100);組織脫水機、石蠟包埋機、石蠟切片機購自德國Leica 公司;圖像拍攝顯微鏡(Leica TCS NT)。
1.3 實驗方法
1.3.1 液體飼料的配制
由于飼料配制過程中涉及到一些重要的細節問題,所以以制備1 L 飼料(乙醇濃度4.8%)為例描述流體飼料的配制,配制過程如下:(1)稱量130 g 的飼料粉和5 g 麥芽糖糊精;(2)將三分之一稱量好的固體粉末倒入一個2.5 L 的玻璃瓶中,加入890 mL 溫熱的自來水(非蒸餾水),劇烈振搖后,磁力攪拌器攪拌5 min;(3)待溶解均勻后,再加入三分之一固體粉末,繼續攪拌約5 min;(4)重復步驟(3),直至全部固體粉末溶解均勻,加入63.6 mL 的95%乙醇,充分混合后待喂食。 同理配制對照飼料,由于不添加乙醇,所以缺失的能量用麥芽糖糊精補充,以平衡乙醇組中乙醇的卡路里。 固體粉末溶解過程同前所述,切記不可將固體粉末一次性全部溶解,由于固體飼料粘度很高,一次性倒入很難溶解。制備好的飼料應該冰箱保存,宜在3 d 內使用,防止飼料變質。
液體飼料喂養瓶添加飼料方法:用拇指堵住喂養孔,從上方填充液體飼料30 mL,并旋緊螺帽。 顛倒喂養管排除滯留的氣泡,將其放置在鼠籠的喂養管固定器上(圖1A)。 由于液體飼料極易變質,需要每天進行飼料更換和飼養瓶的清洗、高壓,所以飼養瓶最好準備兩套,可輪換使用。
1.3.2 小鼠模型的建立
本研究采用乙醇量逐步增加的方式進行酒精性心肌病模型的構建[10]。 16 周齡的雄性小鼠每籠三只,其中對照組(WT 組)9 只,乙醇組(WT+Alc組)21 只,進行乙醇飼料或等熱量麥芽糖糊精對照飼料喂養(表1),共喂養8 周,每兩周升高一次乙醇含量(%,w/v),具體為:第1、2 周是4.8%,第3、4周是5.0%,第5、6 周是5.2%,第7、8 周升高至5.4%(圖1B)。 每三天配制一次液體飼料,冰箱冷藏,每天進行飼料的添加,添加量與前1 d 小鼠的食量相當。 每周進行一次體重的測量,同時記錄飼養過程中死亡小鼠個數。 喂養8 周后,對小鼠進行超聲心動圖檢測,檢測結束進行安樂死后,取心臟組織進行組織病理學檢測(圖1B)。
1.3.3 心臟超聲檢查
流體飼料喂養8 周后,采用異氟烷氣體麻醉的方式進行小鼠麻醉,脫去心前區的被毛,利用小動物心臟超聲儀(探頭型號:550)。 記錄左心室前壁厚度(left ventricular anterior wall,LVAW)、左心室后壁厚度(left ventricular posterior wall,LVPW)、左心室內徑(left ventricular internal diameter at endsystole,LVID)等參數,射血分數(percent ejection fraction,EF%), 短軸縮短率( percent fractional shortening,FS%)由計算得出。
1.3.4 小鼠心臟組織標本的獲取和HE 染色
液體飼料喂養8 周后,行頸椎脫臼法進行安樂死,采用眼科剪打開胸腔,摘取心臟。 PBS 沖洗后用擦手紙吸拭心臟表面液體,稱重后立即浸入4%多聚甲醛液體中進行固定,將固定管置于搖床上進行搖晃,使固定液充分浸入組織,固定48 h 后,流水沖洗30 min,組織進行脫水、石蠟包埋。 利用切片機將包埋好的蠟塊按縱切面切片,厚度4 μm,展臺展開后用病理片撈起,常溫晾干備用。
備用的切片68℃烘烤45 min 后,梯度乙醇脫蠟后,水沖洗1 min,蘇木精染液染色5 min 后水沖1 min,1% 鹽酸乙醇分化2 s,自來水沖洗泛藍,0.5%的伊紅染液浸入2 min,水沖洗后放置70%乙醇中,然后梯度乙醇脫水,樹脂封片,晾干后鏡下觀察,Leica 顯微鏡拍攝圖片。
1.4 統計學方法
實驗數據使用SPSS 統計軟件進行分析。 先進行數據的方差齊性檢驗,數據用平均數±標準差(±s)表示,組間比較采用student’t 檢驗,P<0.05 被認為差異具有統計學意義。
2 結果
2.1 體重和生存率分析
在液體飼料喂養的8 周過程中,每天進行液體飼料的更換,3 d 配制一次飼料,每周進行一次體重的測量,同時記錄小鼠的死亡情況。 對照組(WT,n=9)和乙醇喂養組(WT+Alc,n=21)兩組小鼠,液體飼料喂養8 周后,兩組小鼠體重均有增長,WT 組小鼠體重增長17.3%,WT+Alc 組增加8.2%,WT 組較WT+Alc 組增長明顯。 在接受液體飼料喂養前,WT組和WT+Alc 組體重無顯著差異(WT:(31.3±1.0);WT+Alc:(30.5 ± 2.1),P=0.347),喂養一周后,WT+Alc 組小鼠較WT 組體重開始降低,并且差異具有顯著學差異(WT:(31.6 ±1.2);WT+Alc:(29.9 ±1.2),P=0.048),直至第八周,WT+Alc 組小鼠體重較對照組降低9.8%(WT:(36.7 ±2.5);WT+Alc:(33±2.6),P=0.003)(圖2A)。 在喂養過程中,WT 組小鼠未出現死亡現象,生存率100%;WT+Alc 組小鼠在不同的時間點出現死亡現象,共死亡7 只,生存率66.7%(圖2B)。
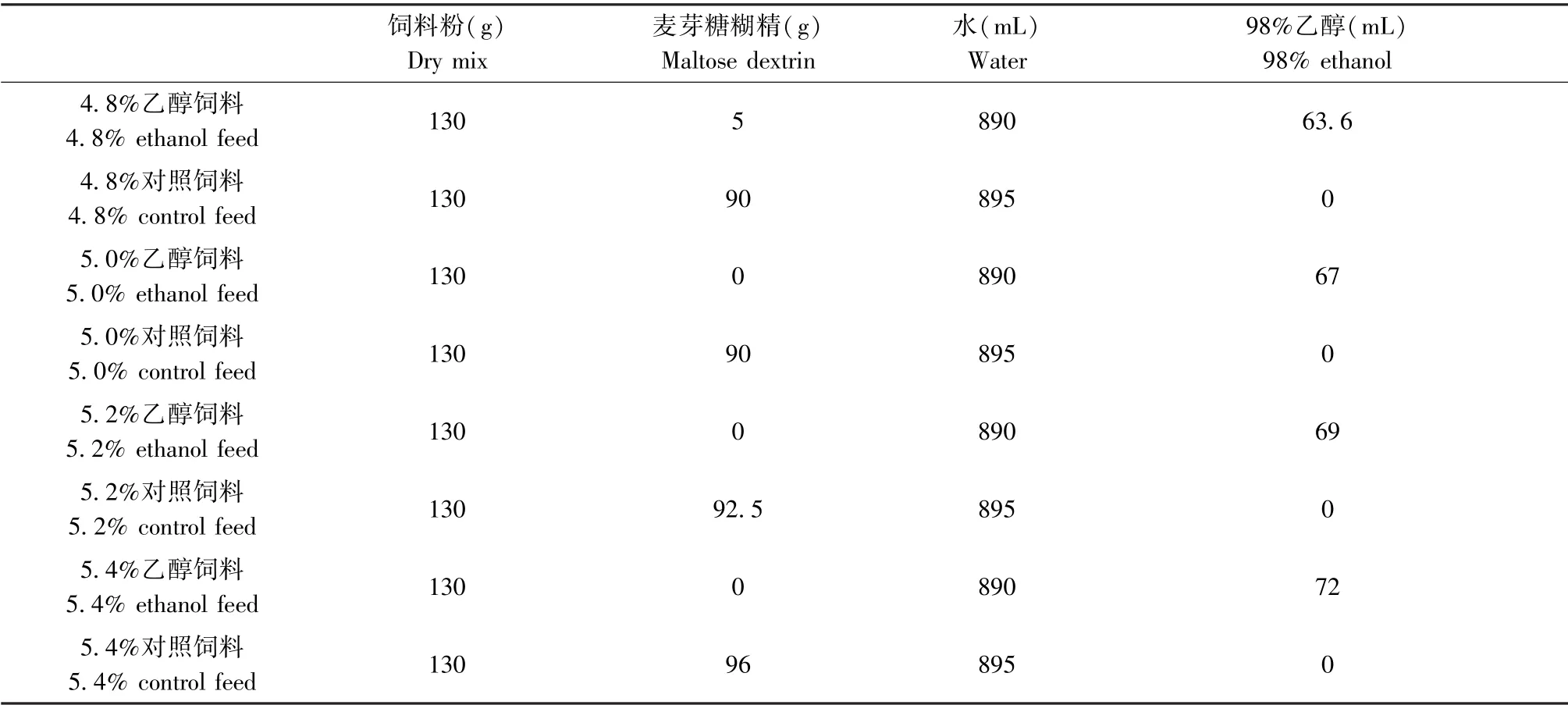
表1 不同濃度酒精飼料和對照飼料的配方Table 1 ingredients of different concentrations of alcohol feed and control feed
2.2 模型小鼠心臟整體結構和功能分析
流體飼料喂養8 周后,對兩組小鼠進行心臟超聲檢測發現,無論在舒張期還是收縮期,左心室前后壁厚度以及左心室腔內徑均有顯著差異,并且心臟功能也出現明顯差異。 WT+Alc 組小鼠較WT 組變化差異具體描述如下:舒張期左室前壁厚度(LVAW;d)減少13.40 %(WT 組:(0.97± 0.11)mm,WT+Alc 組:(0.84± 0.11) mm;P=0.025),收縮期左室前壁厚度(LVAW; s)減少10.94 %(WT組:(1.28 ± 0.13) mm,WT+Alc 組:(1.14 ± 0.16)mm;P = 0.026)(圖2A);舒張期左室后壁厚度(LVPW;d)減少20.88 %(WT 組:(0.91±0.18)mm,WT+Alc 組:(0.72 ± 0.08)mm;P=0.004),收縮期左室后壁厚度(LVPW; s)減少14.00%(WT組:(1.00 ± 0.12) mm,WT+Alc 組:(0.86 ± 0.08)mm;P=0.003)(圖3B);舒張期左室內徑(LVID;d)增加11.83%(WT 組:(3.72±0.29) mm,WT+Alc組:(4.16 ± 0.39) mm;P=0.011),收縮期左室內徑(LVID; s)增加19.17%(WT 組:(2.66 ± 0.33)mm,WT+Alc 組:(3.17 ± 0.49) mm;P=0.011)(圖3C);射血分數(EF%)增加18.47%(WT 組:(59.06± 6.65)%,WT+Alc 組:(48.15 ± 9.40)%;P =0.029),短軸縮短率(Fs%)增加16.49%(WT 組:(28.87 ± 4.32) %,WT+Alc 組:(24.11 ± 5.54)%;P=0.028)(圖3D)。 綜上所述,WT+Alc 組小鼠較WT 組心室前后壁厚度均有顯著減少,左室腔內徑顯著增大,射血分數和短軸縮短率降低,出現明顯的心臟功能降低的表型。
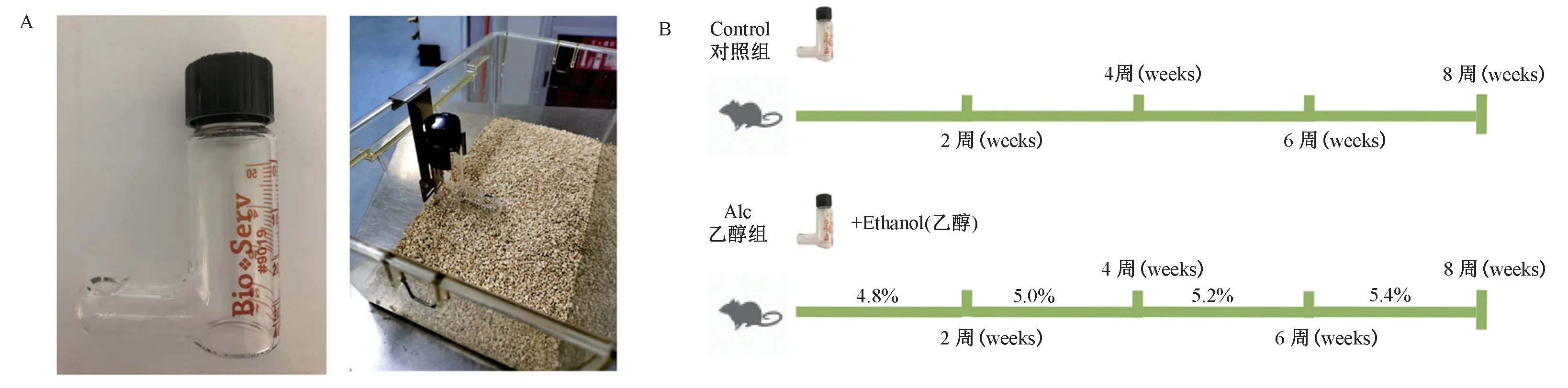
圖1 酒精性心肌病小鼠模型構建方法Note. A, the fluid feed bottle and how to set up the bottle rack. B, the control group mice were given control feed for eight weeks. The alcoholic group (Alc group) mice were fed with liquid feed containing different high-concentrations of alcohol every two weeks, and the alcohol concentration was changed from 4.8%-5.4%.Figure 1 Establishing a mouse model of alcoholic cardiomyopathy

圖2 酒精性心肌病模型體重和生存情況監測Note. A, mouse weight monitoring,*P <0.05. B, survival curve. WT, wild type control mice, n=9. WT-Alc, wild type mice were fed with alcohol feed, n=21.Figure 2 The body weights and survival of alcoholic cardiomyopathy model mice were monitored
2.3 模型小鼠呈現典型的擴張型心肌病病理表型
流食喂養8 周后,將兩組小鼠心臟進行取材,稱量心臟濕重,為了減少重量誤差,所有小鼠取材過程保持基本一致。 本研究發現WT+Alc 組小鼠心重/體重指數較WT 組升高了12.20% (WT 組:(4.12±0.28) mg/g;WT+Alc 組:(4.57±0.48) mg/g;P=0.035)(圖4A)。 同時心臟M 型超聲截圖和整個心臟組織H&E 染色結果均顯示,WT+Alc 組小鼠的心臟組織確實較WT 組顯著增大,并且左室心腔增大明顯,超聲結果左室壁厚度明顯降低以及心臟功能降低(圖4D、C)。 因此,WT+Alc 組小鼠的心臟表現出了典型的心腔變大、室壁變薄、心臟功能下降的酒精性心肌病的臨床表型。 上述結果充分表明,利用流食添加乙醇喂養方法可以成功構建酒精性心肌病小鼠模型,為酒精性心肌病機制的研究提供良好的動物模型。
3 討論
酒精性心肌病臨床表型與擴張型心肌病極其相似,均以心室擴張、心肌功能降低為主要表現,但是發病機制截然不同。 所以對于表型相同,但是發病機制不同的疾病,動物模型需要有針對性的應用。 由于酒精性心肌病主要由飲酒導致,因此本研究基于飲酒這一特征,進行了酒精性心肌病模型的構建。 本研究利用添加了乙醇的成分明確、能量平衡的Lieber-DeCarli 流質飼料進行長期的喂養,成功構建了典型的心室擴張、室壁變薄和心室功能不全的酒精性心肌病小鼠模型。
目前, 酒精性心肌病模型主要以小鼠為主[10-12],也有利用犬等大動物制備模型的,但使用較少[13]。 由于小鼠的體型較小、繁殖能力強以及成熟的基因工程操作手段等原因,小鼠是使用最廣泛的模型之一。 關于酒精性心肌病模型,目前認為C57BL/6 品系是最好的制備模型小鼠品系,其它品系如BALB/6 和DBA 要么不食用含有乙醇的飼料,要么會出現大量的死亡現象[14]。
酒精性心肌病小鼠模型制備方法主要分為乙醇灌胃法[15-18]、乙醇飲水法和液質飼料喂養法[10-12]三種。 其中乙醇灌胃法是指將一定溶度的乙醇通過灌胃的方法直接注射到小鼠胃里面,由于模型制作一般需要較長的時間,長時間的灌胃對小鼠的咽、食道會造成反復的創傷,操作不當還可能引起乙醇進入氣管,死亡率高,還有的操作人員為了快速造模成功,短期內大劑量給予乙醇灌胃,引起急性肝損傷或者急性胃擴張,并且與臨床上酒精性心肌病慢性發展過程不相符;乙醇飲水法,是指經乙醇加入到小鼠的日常飲水中進行酒精性心肌病造模的方法。 這種方法操作簡單,但是效果較差。 由于小鼠的個體差異,每只小鼠的飲水量不同,所以會造成較大差異,其次乙醇在飲水瓶中經過幾天的揮發,濃度也很難精準控制,因此,此方法的缺陷相對較大,造模成功率也不高,目前采用此方法造模的文獻相對較少;
第三種方法是液質飼料喂養法,這種方法是利用液體飼料喂養的方式進行模型的制備。 其中液體飼料是通過蛋白質、脂肪、維生素以及礦物質等等按相應比例配制成粉末溶解而成的成分清楚、營養均衡的液體飼料,并且由于對照組較乙醇喂食組缺少了高能量的乙醇,利用麥芽糖糊精補充到對照組的飼料中,達到了飼料能量的均衡,使誤差減少到最低。 此種飼料盡可能控制了所有會造成營養和能量誤差的一種飼料,保證了實驗的科學性,因此,這種方法也是目前國際上最流行一種制備酒精性心肌病模型的方法。 盡管液質飼料制備酒精性心肌病模型已經被普遍接受,但是乙醇濃度和造模周期并未統一,乙醇濃度從4%到10%,甚至有研究利用20%乙醇濃度進行短暫喂養,喂養過程中有的研究利用統一的喂養濃度,有的研究則采取了設置乙醇濃度梯度的喂養方式;由于乙醇濃度和喂養方式的不同,喂養周期也相差很大,總體來看最短的喂養時間是8 周,而最長周期達到16 周齡[10,19-23]。本文利用了一種產自德國的Bio Serv 公司的一種營養成分均衡、明確且精準實現乙醇組和對照組之間能量平衡的目前國際廣泛應用的液質飼料Lieber-DeCarli[12],進行了為期8 周的小鼠喂養,并且乙醇濃度采取了梯度遞增(4.8%~5.4%)的喂養方式,最終成功得到了具有心腔變大、室壁變薄、心臟功能降低的典型的酒精性心肌病表型特征的小鼠。
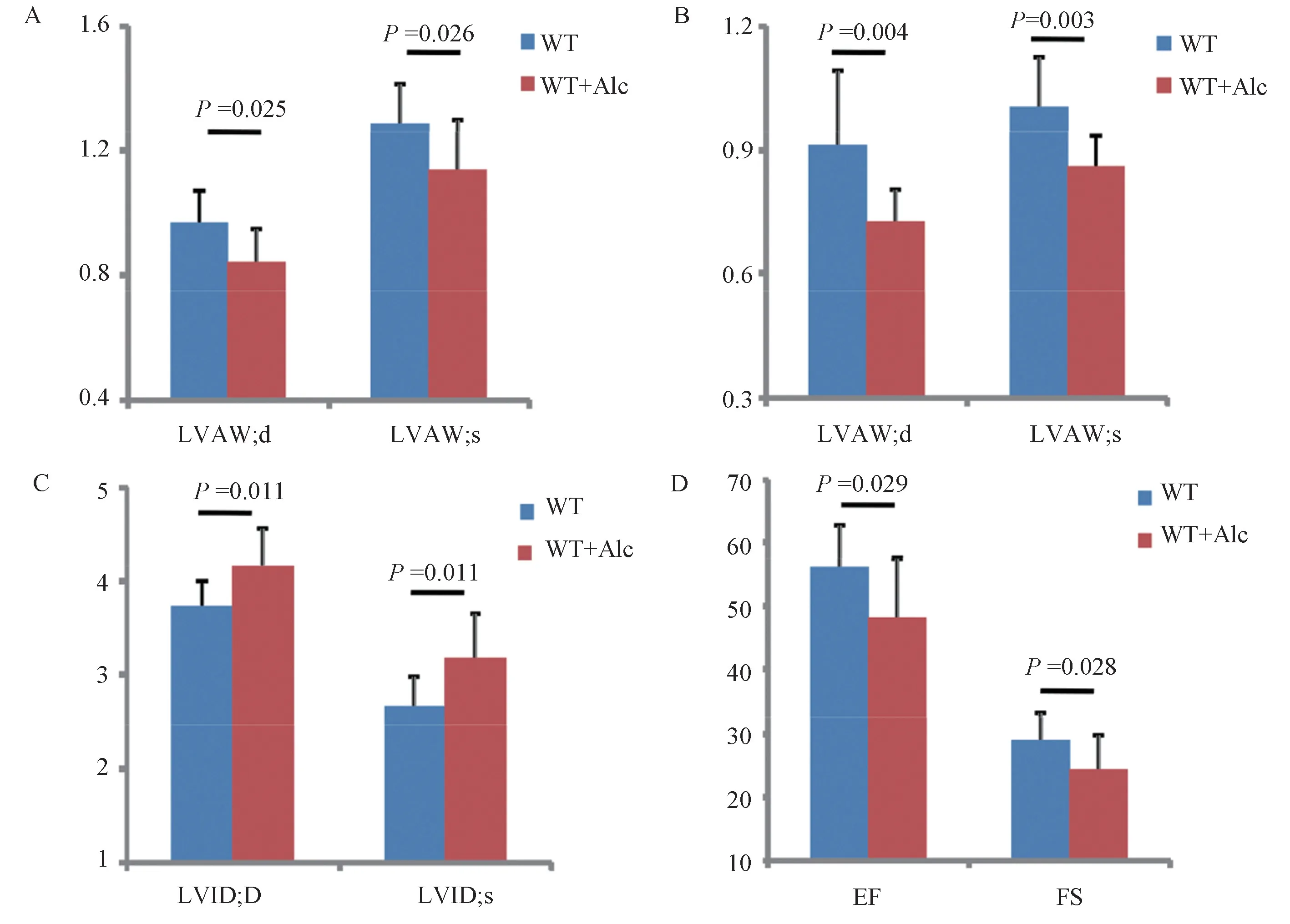
圖3 8 周后心臟超聲評價酒精性心肌病模型小鼠心臟結構和功能Note. A, Comparison of the left ventricular anterior wall thickness of the two groups of mice in the WT and WT+Alc groups. LVAW. d, the left ventricular anterior wall thickness during diastole. LVAW. s, the left ventricular anterior wall thickness during systole. B, Comparison of the left ventricular posterior wall thickness of the two groups. LVPW, d, diastolic left ventricular posterior wall thickness. LVPW. s, systolic left ventricular posterior wall thickness. C, Comparison of left ventricular diameter. LVID. d, left ventricle diameter during diastole. LVID; s, left ventricle diameter during systole. D, The cardiac ejection fraction and short-axis shortening rate were compared between the WT and WT+Alc groups. EF, ejection fraction, FS, fractional shorting, WT, wild mice fed a control diet, WT +Alc, wild mice fed an alcohol diet.Figure 3 Echocardiographic evaluation of cardiac structure and function after 8 weeks
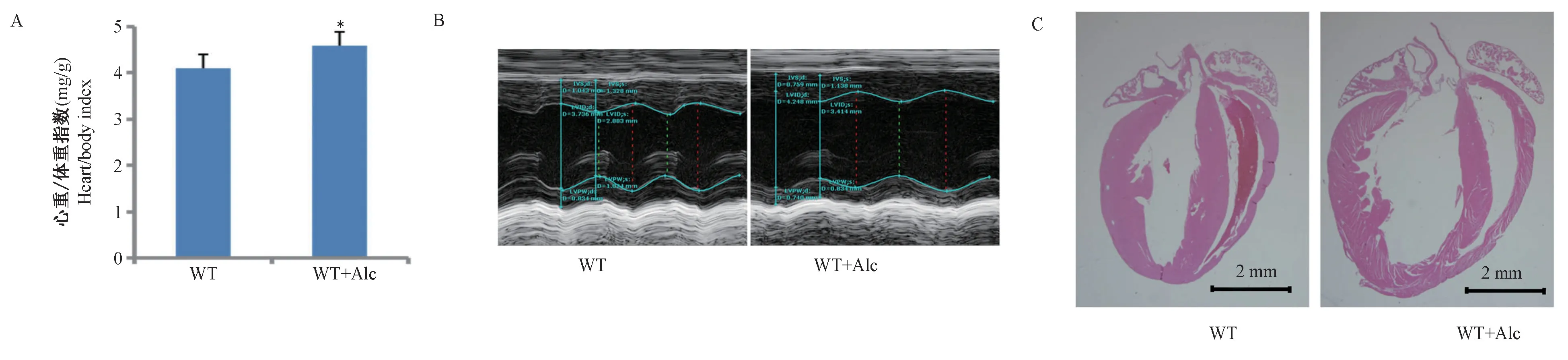
圖4 酒精性心肌病小鼠模型呈現典型的擴張型心肌病表型Note.A, the ratio of heart weight to body weight. WT group, n=9, WT+Alc group,n=14. B, the M-ultrasound image of the left ventricular short-axis from WT and WT+Alc groups. C, HE staining of longitudinal sections of the whole heart of mice in the WT and WT+Alc groups.Figure 4 A mouse model of alcoholic cardiomyopathy showing a typical dilated cardiomyopathy phenotype
盡管本研究成功構建了酒精性心肌病模型,但是在模型的制備過程中,本研究也發現了問題以及總結了經驗。 喂養過程中出現了小鼠體重下降的現象,雖然下降的絕對值不是很多,但是體重下降是具有統計學意義的,這一現象在前人的研究中也有發現[21]。 體重下降可能由于小鼠對液質飼料適應不足,為了克服體重下降,本文認為可以給予每周一次的正常固體飼料,不僅在體重降低方面起到一定的緩解作用,而且也可能降低模型組小鼠的死亡率,這一方法將在今后的模型制備過程中加以應用,期待獲得更好的效果。 另外,在模型的制備過程中,有些研究為了便于控制小鼠每天的飲食量[12-19],進行兩只一籠的飼養方式,但是我們的預實驗中發現模型組存在一定的死亡率,出現死亡的飼養籠里面就會發生單只一籠的情況,獨籠飼養違背嚙齒類動物的生活習性以及實驗動物倫理,因此在本研究中分組時采用了三只一籠的方法,這樣基本上不會出現單只飼養的情況,同時液體飼養瓶一次性所裝飼料也能夠滿足三只小鼠的一天所需的食量。
綜上,本研究應用目前國際上廣泛認可的流質飼料進行慢性乙醇喂養,制備了表型良好的酒精性心肌病小鼠模型,為酒精性心肌病機制的研究提供了有力的工具。

