偏振成像的乳腺癌病理切片檢測方法
田博文,黃丹飛*,鐘艾琦,王雄才,孫雪峰,張玉爽,趙麗穎,王 震,宋 東
(1.長春理工大學光電工程學院,長春 130022;2.吉林大學白求恩第一醫院,長春 130022)
運用偏振光學成像技術對生物組織進行表征,有著快速、低損傷、高分辨率的并能提供比非偏振光學方法更豐富的組織結構信息的優點[1]。生物組織可以類比作一個具有多種復雜偏振作用的光學元件,其對入射光偏振態的作用全部都包括在表征生物組織特性的Mueller矩陣中,依據前人的研究,目前所認可的包括二向色性、相位延遲、散射退偏、起偏特性、方位角變化等[2]。為了獲得這些反映組織微觀結構的特征參數,就要運用Mueller矩陣分解的方法從Mueller矩陣16個陣元中分離提取出只體現本征屬性的成像參數[3]。利用Mueller矩陣分解參數對組織進行表征,對于確定病變組織區域的惡性生長邊緣以進行精確的手術切除或在活檢過程中進行快速輔助診斷有著很好的發展空間[4]。21世紀初,Chung等[5]運用Mueller矩陣分解參數對口腔癌變組織進行檢測,發現相關參數能夠區分癌變與非癌變組織。Pierangelo等[6]總結了對腸癌組織的Mueller矩陣分解參數,發現其相位延遲參數和散射退偏參數可以區分癌變和非癌變組織。此后,Pierangelo等[7]再次提出Mueller矩陣分解參數可以輔助診斷不同階段的宮頸上皮瘤組織。但國外針對乳腺癌的這方面研究甚少,中國則幾乎沒有。
近年來乳腺癌一直位居于女性惡性腫瘤的第一位,其發病率在女性中約占10.4%[8]。隨著乳腺癌治療理念和方法的變化,乳腺癌的快速病理診斷已經成為臨床病理檢測的重要應用點[9]。病理切片的顯微觀測仍然是病理評估的“金標準”,由于光學顯微鏡只能對經染色處理過的切片觀測才能判斷癌變組織和正常組織的區別,所以病變部位需要取樣冰凍后染色制成切片,病理切片的染色制作一定程度上會增加病理檢測時長。如果檢測結果陽性,還需重新送檢,大大延長檢測時長。因此,臨床上亟需一種快速、客觀、準確的病理切片評判方法,來區分癌變與非癌變組織。
利用偏振光成像快速非染色檢測并能準確表征生物組織微觀結構差異的優點,提出了一種基于偏振成像的乳腺癌病理切片檢測的方法。首先設計并搭建了測量組織背向散射光Mueller矩陣的自動化成像系統。隨后對未染色的乳腺癌組織病理切片分別進行Mueller矩陣成像,最后對所得到的樣本Mueller矩陣圖像進行分解計算,提取出具有清晰物理意義且反映組織樣本微觀結構的特征參數圖像,來區分癌變非癌變組織。以期為偏振光在乳腺癌的快速病理診斷提供了一種新的思路。
1 實驗
1.1 實驗系統
主動偏振成像系統才能獲取待測樣本Mueller矩陣,所以需要對已知光波進行不同偏振態的調制后入射到待測樣本,相應的對于每種偏振態的入射光也都要按照不同偏振態進行檢偏。偏振光的調制方法目前有兩種類型,相位延遲調制和機械轉動調制[10]。相位延遲調制是通過改變偏振器件的相位延遲量來對光波進行調制,最為典型的為液晶可變相位延遲器(liquid crystal variable retarder,LCVR),但其容易受到溫度等外界環境因素的影響,導致測量時間不能過長,且每次使用前都需要進行標定。考慮到這些因素,采用機械轉動調制中的雙旋轉波片法(double rotating retarders,DDR)[11],由PLC驅動電控旋轉臺帶動兩個1/4波片以恒定的角速度旋轉特定角度來實現對光波偏振態的調制,該成像系統示意如圖1所示。該系統由中心波長為630 nm的LED陣列光源(LIU630A,美國ThorLabs),光闌,毛玻璃屏L1,線偏振片P1和P2(LPVISC100-MP2-SM1,美國ThorLabs),電控旋轉臺W1和W2(MAS102,北光世紀),1/4波片Q1和Q2(膠合零級波片,武漢優光科技),成像透鏡L2和CMOS相機,以及PLC控制系統和計算機組成。其中,PLC控制系統包括兩個二相混合式驅動器(SJ-2H504DM,常州雙杰)和一個PLC控制板(FX2N-14MT,國產三菱)。
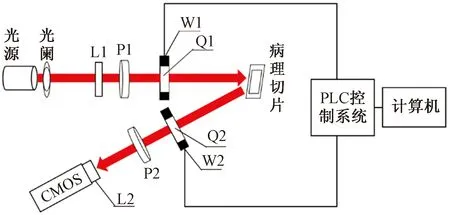
圖1 成像系統示意圖Fig.1 Imaging system diagram
1.2 實驗設計
實驗選取的樣本為未染色的乳腺癌組織切片,厚度為4 μm。LED陣列光源出射的光經過光闌,并經由毛玻璃屏勻光后,進入到由線偏振片P1和架設在電控旋轉臺W1上的1/4波片Q1構成的起偏器(polarization state generator,PSG)。先經由PSG調制的偏振光照射到待測組織切片,再通過待測組織的散射進入到由P2和架設在W2上的Q2所構成的檢偏器(polarization state analysis,PSA)。成像時,固定P1和P2,透振方向為水平方向,Q1和Q2的快軸方向與其保持一致,計算機與PLC控制系統建立通訊來驅動電控旋轉臺W1、W2帶動Q1、Q2每次以1∶5的角度從0°開始以6°和30°的步長旋轉30次,CMOS相機記錄每次旋轉獲得的光強變換圖像并傳輸到電腦中,然后根據光強傅里葉系數求得樣本Mueller矩陣的各個元素,最后運用Mueller矩陣分解對所得的Mueller矩陣進行計算得出能夠代表樣本微觀結構的參數圖像,單次實驗成像時間為分鐘。
1.3 實驗原理
1.3.1 Mueller矩陣
Stokes矢量是一種簡單的描述光波偏振態的數學表達形式,為一個包含四個參數的列向量,用[S0S1S2S3]T表示。Stokes矢量通常和Mueller矩陣一起表示表征光的偏振態和物質的偏振特性[12]。Mueller矩陣為一個4×4的矩陣,用M表示,Stokes矢量與Mueller矩陣之間的關系為Sout=MSin,其中Sin和Sout分別表示系統入射光和出射光的Stokes矢量[13]。在圖1的成像系統中入射光為Sin=[1,0,0,0]T,經過PSG調制后從待測組織(Mueller矩陣為MTissues)出射進入PSA,那么最后測得的出射光強表示為
Sout=MPSAMTissuesMPSGSin
(1)
MPSG=MP1MP2
(2)
MPSA=MP2MQ2
(3)
式中:MP和MQ分別為理想偏振片和波片的Mueller矩陣。為了進一步理解,可以把偏振器和檢偏器看作一個整體,則可以令A=MPSA,G=MPSGSin則式(1)可表示為
Sout=AMTissuesG
(4)
實驗中CMOS相機所探測到的為樣本組織經過散射后的光強Iout為Sout的第一個分量,則根據矩陣的運算關系,Iout大小與A的第一行元素有關。令ai為A的第一行元素,gj為G的所有元素,在經過展開合并后,可得:

(5)
根據雙波片的快軸旋轉角度α比,可以求出矩陣u:

(6)
再由傅里葉變化可得:

(7)
由式(7)可知,Iout的傅里葉系數與待測組織Mueller矩陣MTissues中各元素Mij成函數關系,利用傅里葉變換后的變換系數an、bn,通過計算可求得待測組織的Mueller矩陣:

(8)
1.3.2 Mueller矩陣分解
Mueller矩陣分解是通過對樣本的Mueller矩陣進行計算從而提取出具有明確物理意義的成像參數的方法,Lu-Chipman Mueller矩陣分解方法[13](mueller matrix decomposition,MMD)是目前最為廣泛應用的分解方法。該方法將樣本的Mueller矩陣分解成三個子矩陣相乘的形式,如式(9)所示,分別對應樣本的二向色性、相位延遲和散射退偏。
M=MΔMRMD
(9)
下面給出了相關參數的表達式,其詳細的推導過程可參考文獻[14],首先對式(8)所得待測組織的Mueller矩陣進行歸一化得:

(10)
二向色性:

(11)
散射退偏:

(12)
線性相位延遲:
δ=cos-1({[MR(2,2)+MR(3,3)]2+
[MR(3,2)-MR(2,3)]2}1/2-1)
(13)
2 結果
2.1 Mueller矩陣
根據組織病理學可將乳腺癌分為原位癌和浸潤癌兩個大類。有關研究表明,在電鏡下乳腺癌細胞形態學特征為細胞具有高度的異型性,且細胞質內可見張力原纖維絲[15]。偏振成像有著對亞波長微觀結構變化十分敏感的特點,所以對這種異型性則會表征出偏振特性差異[16]。在病理切片上選擇了由吉林大學白求恩第一醫院乳腺外科所提供的未染色乳腺原位癌對照切片和未染色浸潤性乳腺癌乳頭狀瘤對照切片進行Mueller矩陣成像實驗。
如圖2所示為乳腺原位癌的Mueller矩陣成像結果。其中,圖2(a)為實驗所使用的乳腺原位癌對照,對照部分(圓形區域)為正常組織。圖2(b)為切片的強度圖像,由于CMOS相機前置鏡頭使其成放大的鏡像,對照部分變為了左側部分。圖2(c)是強度偽彩色圖像。圖2(d)是乳腺原位癌對照切片Mueller矩陣,其每個陣元均用m00做歸一化處理。
如圖3所示為浸潤性乳腺癌和乳頭狀瘤Mueller矩陣成像。圖3(a)為浸潤性乳腺癌和乳頭狀瘤切片,上方紅色方框區域為乳頭狀瘤組織,下方黃色方框區域為浸潤性乳腺癌組織,剩余部分為正常組織;圖3(b)為切片的強度圖像;圖3(c)是強度偽彩色圖像。圖3(d)為浸潤性乳腺癌和乳頭狀瘤切片Mueller矩陣,其每個陣元均用m00做歸一化處理。

圖2 乳腺原位癌Mueller矩陣成像Fig.2 Mueller matrix imaging of breast carcinoma in situ

圖3 浸潤性乳腺癌和乳頭狀瘤Mueller矩陣成像Fig.3 Mueller matrix imaging of invasive breast cancer and papilloma
通過實驗結果可以看出,未染色病理切片的強度圖像癌變組織和正常組織并沒有明顯區別。與之相比較,圖2(d)和圖3(d)Mueller矩陣中對角線上陣元m11、m22、m33正常和癌變組織有明顯區別,癌變部分呈現出較高的強度值,這是因為癌變組織和正常組織的微觀結構的差異被表征出不同的偏振特性。但是具體的偏振特性需要通過Mueller分解的方法來得出。
2.2 Mueller矩陣分解
利用Mueller矩陣分解對上面所得到的病理切片的Mueller矩陣進行分解,可以得到Mueller矩陣的分解參數(散射退偏Δ,線性相位延遲δ,二向色性D),圖4所示,為乳腺原位癌對照切片的Mueller矩陣分解結果。圖4(a)為散射退偏Δ,正常區域Δ要高于癌變區域,均在0.4以上,這表明在癌變過程中組織細胞形態的改變導致組織散射退偏能力下降;圖4(b)為線性相位延遲δ,癌變區域的δ高于正常區域均在0.35以上,這說明癌變區域比正常區域有更強的雙折射效應,這是由于癌變過程中組織纖維化造成的;圖4(c)為二向色性D,癌變區域和正常區域的值都趨近于0,無法區分癌變和非癌變區域。

圖4 乳腺原位癌切片Mueller矩陣分解結果Fig.4 MMD results of breast cancer in situ section
圖5為浸潤性乳腺癌和乳頭狀瘤切片 Mueller矩陣分解結果。圖5(a)為散射退偏Δ,癌變區域[圖3(b)中紅色方框乳頭狀瘤區域和黃色方框浸潤性乳腺癌區域]呈現出較低的Δ,接近于0.2左右,正常區域Δ均在0.5以上。同樣表明病變過程中組織細胞形態的改變導致組織散射退偏能力下降;圖5(b)為線性相位延遲δ,癌變區域δ明顯高于正常組織區域。此外,乳頭狀瘤區域相比浸潤性乳腺癌區域呈現出更高的強度,達到0.6以上。表明了乳頭狀瘤區域相比侵潤性乳腺癌區域有著更強的雙折射效應。圖5(c)為二向色性D,癌變區域和正常區域的值都趨近于0,無法區分癌變和非癌變區域。

圖5 浸潤性乳腺癌和乳頭狀瘤切片Mueller矩陣分解結果Fig.5 MMD results of invasive breast cancer and papilloma sections
3 結論
(1)運用雙旋轉波片法(DDR),設計并搭建了一套乳腺癌病理切片的Mueller矩陣自動成像系統,系統整體由PLC控制。
(2)以乳腺原位癌對照切片和浸潤性乳腺癌乳頭狀瘤對照切片為實驗對象進行Mueller矩陣成像,實驗結果表明,該系統能夠正確對病理切片進行成像,癌變組織和非癌變組織有明顯的偏振特性差異,單次成像時間為2 min。
(3)對上述兩類切片的Mueller矩陣圖像進行分解,得到Mueller矩陣分解參數圖像。實驗結果表明,乳腺原位癌組織相比正常組織散射退偏能力較低,而雙折射能力較強;浸潤性乳腺癌和乳頭狀瘤組織有相同的特性,此外乳頭狀瘤組織比浸潤性乳腺癌組織有著更強的雙折射能力;相比于強度成像散射退偏參數Δ和線性相位延遲參數δ能夠區分癌變區域和正常區域。為乳腺癌的病理切片快速有效檢測提出了新的參考方法。