LncRNA XIST通過調控miR-186-5p促進非小細胞肺癌的增殖和侵襲實驗研究*
才 昊,韓 亮,李曉飛
錦州醫科大學附屬第三醫院胸外科(錦州 121000)
肺癌是常見的呼吸系統腫瘤,也是世界范圍內發病率最高的惡性腫瘤,占腫瘤死因第一位,其中非小細胞肺癌(Non-small cell lung cancer,NSCLC)是其常見病理類型,占全部肺癌的80%[1]。目前,肺癌發病因尚未完全明確,認為與吸煙、環境污染、肺部慢性感染及遺傳等因素有關。然其發病隱匿,早期臨床特征及表現不典型,致其早期確診率低下,大多患者就診時已發生轉移,整體預后不佳。因此對肺癌發生發展的分子機制進行深入研究與探討,對肺癌的臨床治療及改善患者預后具有重要意義。長鏈非編碼RNA(LncRNAs)是長度超過200個核苷酸序列且不編碼蛋白質的非編碼RNA,其在多種細胞水平均可通過復雜分子機制進行基因表達調控[2],但其機制特點尚不明確。最新研究[3]表明,LncRNA作為調節因子幾乎參與全部細胞過程,在腫瘤的發生發展中發揮著促癌或抑癌作用。并有研究[4]表明,LncRNA可以促進腫瘤細胞的增殖、凋亡及侵襲,可作為評判腫瘤細胞生物學行為及預后的預測標志。LncRNA XIST是XIST基因產物,位于人染色體Xq13.2,參與調控X染色體失活[5]。研究[6-7]證實XIST是具有生物學功能的LncRNA,在乳腺癌、卵巢癌、人鼻咽癌等腫瘤中均高表達。且最近研究指出,XIST與NSCLC患者預后密切相關[8]。然有關XIST在NSCLC發生發展中的作用機制尚未闡明且未見太多研究報道。因此,本研究就LncRNA XIST調控NSCLC發生發展的作用機制進行了探究,以期為臨床治療提供新的方向和思路。
材料與方法
1 材料及儀器 本研究所用非小細胞肺癌(NSCLC)細胞系A549、H1299、Calu-3及人支氣管上皮細胞系(BEAS-2B)均購自中科院上海細胞庫。試劑及儀器:RT-PCR逆轉錄試劑盒購自美國HyClone公司;胰蛋白酶、胎牛血清、DMEM細胞培養基購自美國GIBCO公司;MTT試劑、BCA蛋白質定量試劑盒購自上海碧云天生物技術研究所;XIST siRNA由上海吉瑪制藥技術公司合成;RIPA裂解液購自美國Santa Cruz公司;PCNA、CCND1、Bcl-2、MMP-9抗體購自美國Santa Cruz Biotechnology 公司;miR-186-5p模擬/抑制物、XIST表達載體均購自廣州銳博生物科技有限公司;熒光定量PCR 擴增儀購自美國ABI 公司等。
2 細胞培養 研究所用NSCLC細胞系A549、H1299、Calu-3培養于DEME培養基,人支氣管上皮細胞系BEAS-2B培養于PRMI1640培養基,37 ℃、5% CO2培養箱恒溫培養,待細胞生長達到80%~90%時取出培養皿,加入含0.03%濃度EDTA的胰蛋白酶進行細胞消化傳代培養3次后行細胞凍存處理。
3 LncRNA XIST與miR生物信息學分析 通過檢索生物信息學數據庫和DIANA數據庫預測可能與LncRNA XIST結合的miRNA,取兩者檢測交集同時結合NSCLC現有miRNA研究信息,篩選出與XIST存在結合位點的 miR-186-5p。
4 引物設計及表達載體構建 利用生物信息學數據庫和Primer5.引物設計軟件以GAPDH及U6為內參進行LncRNA XIST、XIST干擾序列siRNA和miR-186-5p引物的檢測設計,并構建包含miR-186-5p識別位點在內的野生型(pmir GLO-XIST-Wt)和突變型(pmir GLO-XIST-Mut)XIST片段熒光酶素報告基因載體。引物序列見表1。

表1 基因引物序列
5 XIST siRNA轉染 于12孔培養皿中接種適量NSCLC細胞,1 ml DNEM+10%FBS培養待細胞匯合率達到30%~50%,1.5 ml無菌EP管加入100 μl無血清培養基,后分別加入終濃度為100 nmol/L的XIST siRNA和5 μl Lipofectamine 2000,混勻靜置20 min,再加入RNA-脂質體復合物正常培養6~8 h后換為新鮮培養基培養48 h。RT-PCR驗證其轉染效率。
6 miR-186-5p mimic及inhibitor轉染 構建miR-186-5p mimic及inhibitor表達載體,同上接種、培養細胞至30%~50%匯合率,無菌EP管加入100 μl無血清培養基,分別加入終濃度為100 nmol/L的miR-186-5p mimic或inhibitor和5μl Lipofectamine 2000,混勻靜置20 min再加入RNA-脂質體復合物,后續培養方式同上。
7 RT-PCR 采用Trizol法并參照其反應試劑盒說明書提取各細胞總RNA,利用紫色分光光度計測定OD260/280吸收值及RNA純度。按逆轉錄試劑盒說明書及其反應體系分別加入總RNA及LncRNA XIST或miR-186-5p的逆轉錄RT引物,逆轉錄獲取其cDNA;后根據熒光定量反應試劑盒及其反應體系將所得cDNA進行PCR擴增,反應條件:LncRNA XIST:95 ℃(60 s)、95 ℃(15 s)、60 ℃(60 s)、72 ℃(30 s),循環40次;miR-186-5p:94 ℃(10 min)、94 ℃(15 s)、69 ℃(60 s)、72 ℃(30 s),循環40次,實驗均重復3次。采用2-△△Ct法定量分析各細胞系中LncRNAXIST或miR-186-5p相對表達量。選取轉染效率較明顯的兩組細胞進行后續實驗。
8 MTT實驗檢測細胞活性 待NSCLC細胞系成功轉染XIST siRNA 48 h后分別取生長狀態良好的對數生長期細胞制成單細胞懸液,2×103/孔接種于96孔板,每組設8個平行孔。于轉染培養后24 h、48 h、72 h取出培養板,每孔加入20 μl MTT液繼續培養4 h,吸除上清液,加入150 μl二甲基亞砜振蕩溶解,酶聯免疫檢測儀于570 nm 波長檢測各細胞光密度值。
9 Transwell實驗檢測細胞侵襲 -20 ℃冰箱中取出Matrigel基質膠室溫過夜液化稀釋為工作液,加入Transwell小室底部膜上室,37 ℃培養箱培養30 min膠化Matrigel;無血清培養液培養細胞12 h后制成細胞懸液,于Transwell培養板上室加入100 μl細胞懸液和200 μl無血清培養基,下室加入600 μl RPMI 1640培養液,37 ℃、5% CO2條件培養24 h;取出小室,95%酒精固定,結晶紫溶液染色;隨機選取三個視野于高倍鏡下觀察細胞數量,取其平均值。
10 Western blot檢測細胞增殖侵襲相關蛋白含量 收集成功轉染XIST siRNA后的NSCLC細胞系,利用RIPA裂解液進行裂解提取總蛋白,后采用BCA 蛋白濃度測定試劑盒測定提取蛋白濃度;采用轉印蛋白及免疫檢測于電泳結束前進行轉膜處理,后將PVDF膜放入BSA 室溫封閉 2 h,TBST 洗膜 3次,加入TBST稀釋的PCNA孵育過夜;利用辣根過氧化物酶(HRP)標記的羊抗兔二抗和羊抗小鼠二抗室溫孵育 2 h;膜于化學發光檢測試劑反應2 min,取膜,包好PVDF膜,于暗室中行X 膠片感光、顯影、定影。
11 熒光酶素報告實驗 轉染前一天按2×104個/孔濃度接種于 24 孔板,含10% FBS 的DMEM 高糖培養基培養,待細胞匯合度至50%~60%時加入300 μl OPTI-MEM 培養基及用其稀釋的1 μl Lipofectamine 2000,終體積50 μl,靜止5 min,加入20 μmol/L的miRNA 1 μl和熒光素酶報告基因質粒0.1 μg及轉染復合物液于37 ℃、5% CO2培養箱孵育轉染48 h, PLB裂解收集裂解液至發光板,加入LAR Ⅱ 工作液及Stop & Glo Reagent,混勻,分別讀值2 s,保存數據。
12 RIP實驗 預冷PBS液清洗NSCLC細胞系2次,加入RIP Lysis Buffer置于冰上裂解并收集產物-80 ℃保存;后制備重懸磁珠,加入5 μl AgO2/IgG 抗體孵育去上清,RIP Wash Buffe 清洗 2 次;每管磁珠AgO2/IgG 抗體混合物中加入RIP Immunoprecipitation Buffer,裂解、離心,取上清至磁珠-抗體管中行RNA 結合蛋白-RNA 復合物免疫沉淀及RNA純化。
13 營救實驗 分別構建miR-control、miR-186-5p mimics、XIST表達載體及miR-186-5p mimics + XIST表達載體轉染至A549細胞系,分別設為control組、miR-186-5p組、XIST組及miR-186-5p + XIST組;接種于12孔培養皿培養至細胞匯合率達50%,1.5 ml離心管加入100 mmol/L miR-186-5p、100 μl 無血清培養基和(或)2 μg 表達載體質粒及4 μl Lipofectamine 2000混勻,加入脂質體復合物,37℃、5% CO2孵育箱培養。待轉染48 h后分別取對數生長期細胞制成懸液,分別進行MTT、Transwell實驗,實驗步驟同上。
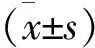
結 果
1 NSCLC細胞系中LncRNA XIST表達情況 采用RT-PCR法以BEAS-2B細胞系為對照,對NSCLC細胞系A549、H1299、Calu-3中LncRNA XIST表達水平進行檢測,結果顯示:NSCLC細胞系中LncRNA XIST表達水平均顯著高于人支氣管上皮細胞系BEAS-2B(P<0.05,圖1)。
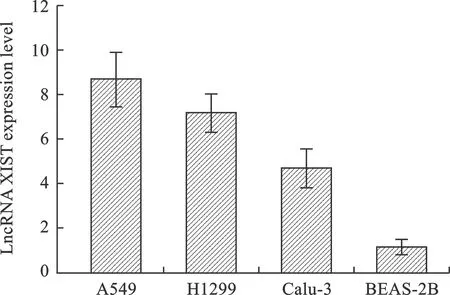
圖1 NSCLC細胞系中LncRNA XIST表達水平
2 轉染XIST siRNA后NSCLC細胞中XIST和miR-186-5p表達情況 選取表達相對較高的NSCLC細胞系A549、H1299轉染XIST siRNA敲降其LncRNA XIST表達,以si-NC組作為陰性對照。RT-PCR檢測顯示:與si-NC組相比,敲降XIST后A549、H1299細胞中LncRNA XIST表達顯著降低,miR-186-5p表達顯著增高,兩組比較差異有統計學意義(P<0.05,圖2)。
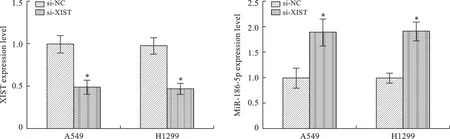
注:兩組比較,*P<0.05
3 轉染miR-186-5p mimic及inhibitor后NSCLC細胞系中XIST表達情況 分別轉染miR-186-5p mimic及 inhibitor至A549、H1299細胞系,采用RT-PCR檢測轉染后A549、H1299細胞中XIST表達情況,以空白Control組作為對照。結果顯示:轉染miR-186-5p mimic后A549、H1299細胞中XIST表達顯著降低,而轉染miR-186-5p inhibitor后A549、H1299細胞中XIST表達顯著升高,比較差異有統計學意義(P<0.05),提示過表達miR-186-5p可顯著降低NSCLC細胞中XIST表達(圖3)。
4 敲降XIST抑制NSCLC細胞增殖活性 轉染敲降A549、H1299細胞中XIST表達,以si-NC組作為陰性對照。采用MTT法分別于轉染24 h、48 h、72 h,利用酶聯免疫檢測儀檢測各組細胞光密度值。結果顯示:轉染48 h、72 h 時,A549、H1299細胞的si-XIST組OD值顯著低于si-NC組,比較差異有統計學意義(P<0.001),提示敲降XIST抑制NSCLC細胞增殖能力(圖4)。
注:三組比較,*P<0.05
5 敲降XIST抑制NSCLC細胞侵襲能力 轉染敲降A549、H1299細胞中XIST表達,以si-NC組作為陰性對照。采用Transwell實驗檢測A549、H1299細胞侵襲能力。結果顯示:敲降XIST表達后,A549、H1299細胞平均每視野穿過細胞數較si-NC組明顯減少,比較差異有統計學意義(P<0.05),提示敲降XIST抑制NSCLC細胞侵襲能力(圖5)。
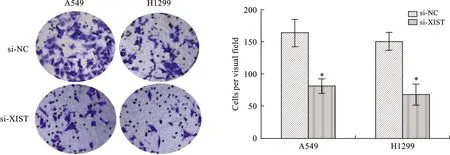
注:兩組比較,*P<0.05
6 敲降XIST抑制NSCLC細胞增殖侵襲相關蛋白表達 采用Western blot實驗檢測轉染敲降XIST對A549、H1299細胞增殖、侵襲相關蛋白CCND1、PCNA、MMP-9及Bcl-2表達的影響,以內參蛋白β-actin為對照。結果顯示:敲降XIST表達后,A549、H1299細胞中CCND1、PCNA、MMP-9、Bcl-2蛋白表達水平較內參蛋白β-actin表達降低(圖6)。

圖6 敲降XIST后CCND1、PCNA、MMP-9、Bcl-2蛋白表達降低
7 XIST與miR-186-5p結合驗證 通過檢索生物信息學數據庫和DIANA數據庫篩選出與LncRNA XIST存在結合位點的miR-186-5p,并構建包含miR-186-5p識別位點在內的pmir GLO-XIST-Wt和pmir GLO-XIST-Mut熒光酶素報告基因載體。為進一步驗證兩者之間的調控關系,研究以miR-NC為對照,將miR-186-5p mimic分別轉染至NSCLC細胞系A549、H1299中,并同時轉染pmir GLO-XIST-Wt和pmir GLO-XIST-Mut報告質粒載體。采用熒光酶素報告基因實驗檢測各組細胞熒光霉素活性,結果顯示:共轉染miR-186-5p mimic和pmir GLO-XIST-Wt可使A549、H1299細胞熒光酶素活性降低(P<0.05),而共轉染miR-186-5p mimic和pmir GLO-XIST-Mut則不能引起報告載體熒光素酶活性改變,提示XIST是miR-186-5p的靶向基因(圖7)。
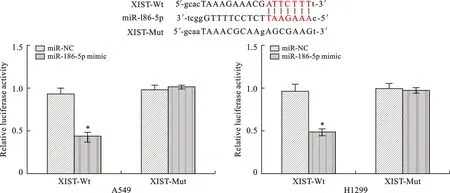
注:兩組比較,*P<0.05
8 miR-186-5p調控 XIST 采用RIP實驗(RNA結合蛋白免疫共沉淀實驗)檢測XIST和miR-186-5p是否存在于相同RISC復合體,沉淀在A549、H1299細胞中包含miRNA及與其結合的LcnRNA的內源性Ago2蛋白。RT-PCR檢測Ago2蛋白和IgG蛋白中XIST和miR-186-5p表達水平,結果顯示:A549、H1299細胞中XIST和miR-186-5p在Ago2免疫沉淀復合物中的表達含量顯著高于IgG免疫沉淀復合物(P<0.05),提示miR-186-5p以Ago2依賴的方式調控XIST(圖8)。
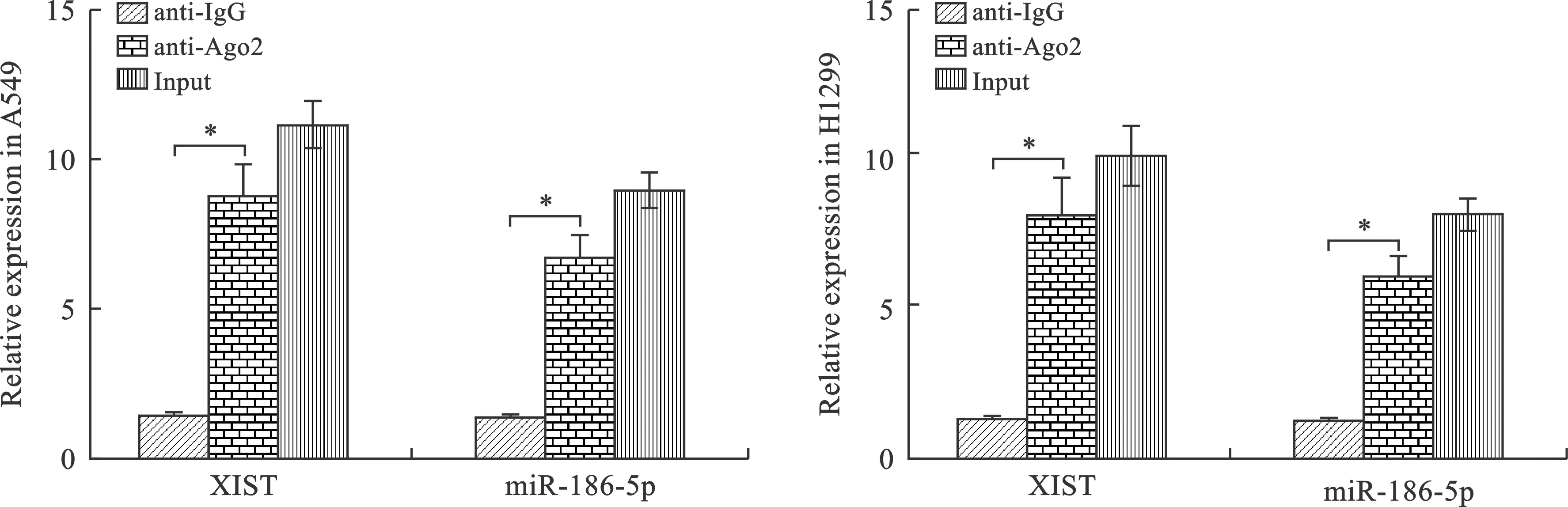
注:三組比較,*P<0.05
9 miR-186-5p抑制XIST促進細胞的增殖作用選取A549細胞為例分別轉染miR-control、miR-186-5p mimics、XIST 表達載體和miR-186-5p mimics+XIST 表達載體,培養72 h。采用MTT法檢測各組細胞生長情況,結果顯示:與Control組相比,XIST組OD值明顯增高,miR-186-5p組OD值明顯降低,miR-186-5p+XIST組OD值低于Control組,高于miR-186-5p組。提示過表達miR-186-5p顯著抑制A549細胞活性,抑制過表達XIST促進A549細胞的增殖作用(圖9)。
10 miR-186-5p抑制XIST促進細胞的侵襲作用 轉染A549細胞,采用Transwell實驗檢測各組細胞侵襲能力,結果顯示:與Control組相比,XIST組每視野細胞數明顯增加,miR-186-5p組每視野細胞數明顯減少,miR-186-5p+XIST組每視野細胞數少于XIST組,多于miR-186-5p組。提示過表達miR-186-5p顯著降低A549細胞侵襲能力,抑制過表達XIST促進A549細胞的侵襲作用(圖10)。
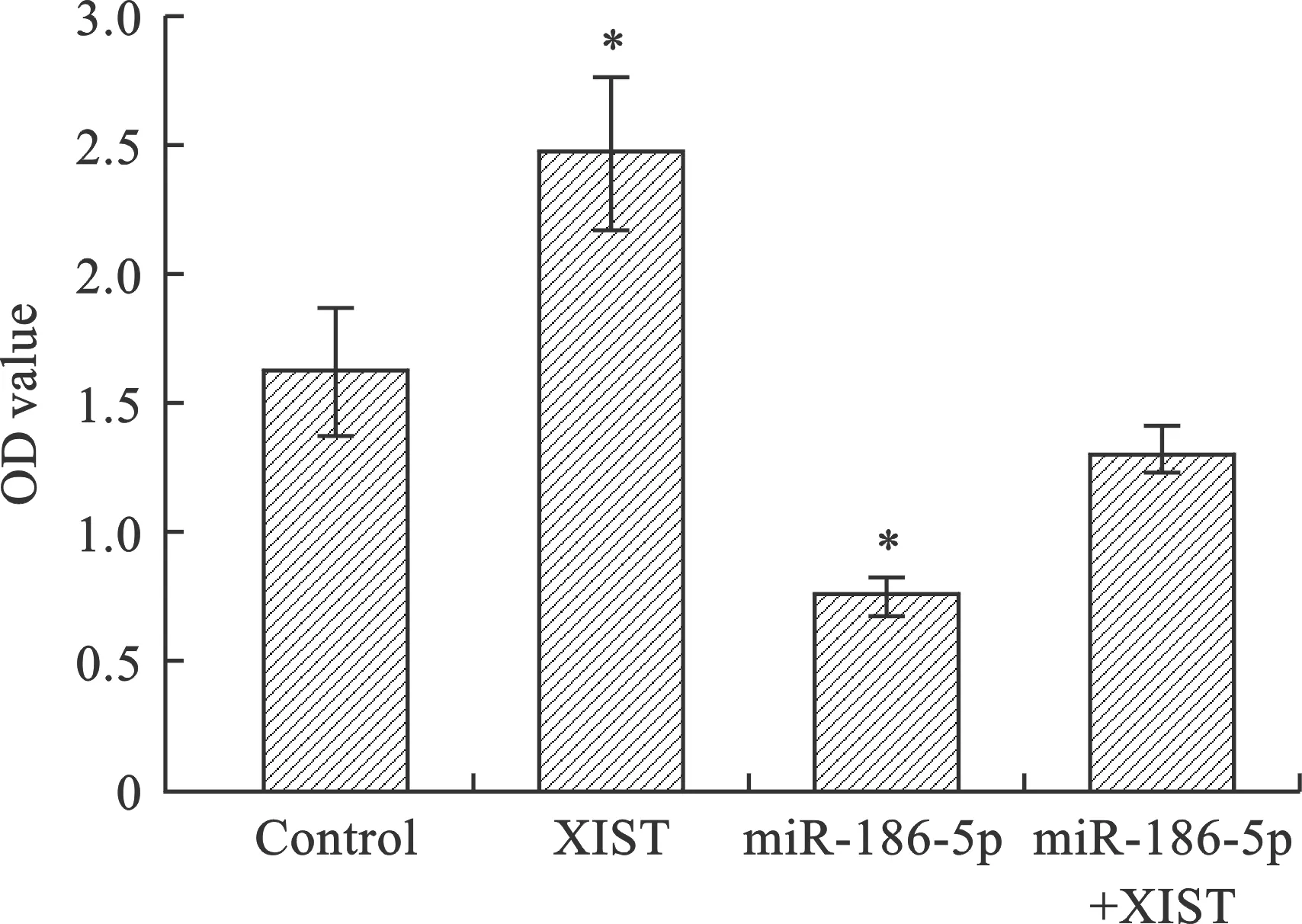
注:四組比較,*P<0.05
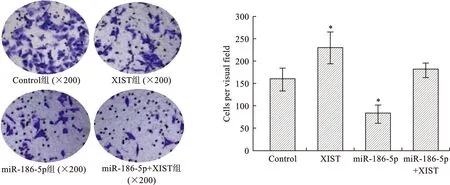
注:四組比較,*P<0.05
討 論
近年來隨著人類對基因的研究及基因組測序技術的發展,已證實大多數基因組可轉錄為RNA,僅1%~2%可以編碼蛋白質,因此可將全部RNA分為蛋白質編碼RNA和蛋白質非編碼RNA(ncRNA)[9]。目前人類對于長鏈非編碼RNA(LncRNAs)的研究相對較少,但目前研究[10]已經證實LncRNAs其結構特異性和堿基特異性可通過與核酸或蛋白質相互作用,對基因表達能力進行調節。據了解,人類基因組幾乎都可轉錄 LncRNA,其與編碼基因相比有著不同的轉錄方向[11]。最近研究[12-13]證實LncRNA扮演著干擾轉錄、調節蛋白活性、誘導染色體重塑、改變細胞或蛋白結構等細胞調節功能,可通過與蛋白質結合、轉錄調控、RNA剪接及表觀遺傳調控等分子機制在癌癥中發揮促癌或抑癌作用,與包括惡性腫瘤在內的眾多種疾病密切相關。此外,Jang等[14]研究表明,肝細胞轉移癌中LncRNA ATB高表達,促進腫瘤細胞器官定植,誘導上皮至間質的侵襲。Jia等[15]研究指出,LncRNA H19異常表達在轉錄調控水平誘導肝癌、肺癌、乳腺癌的發生發展,且可降低人腦膠質瘤細胞對替莫唑胺的耐藥。而Wan等[4]研究發現在表觀遺傳學上LncRNA PVT1可通過調控 LATS2的表達促進NSCLC的增殖。可見對LncRNAs在NSCLC中的分子作用機制進行研究可為其臨床治療提供新的思路。
1991年LncRNA XIST被首次研究發現,指出XIST參與X染色體滅活的啟動階段。既往研究再次證實乳腺癌、淋巴瘤、卵巢癌等眾多腫瘤的發生發展與XIST相關,XIST參與細胞的全部過程,影響腫瘤的增殖和侵襲。是否可以推測LncRNA XIST在NSCLC中發揮著相同作用。因此,本研究首先采用RT-PCR法檢測NSCLC細胞系及人支氣管上皮細胞系中XIST表達是否差異,發現NSCLC系中XIST高表達。通過轉染XIST siRNA敲降細胞系中XIST表達,檢測發現各細胞系中XIST表達水平顯著降低。為研究LncRNA XIST是否參與NSCLC的發生發展,研究中通過MTT實驗、Transwell 實驗和 Western blot實驗,探究了敲降LncRNA XIST表達對NSCLC惡性生物學行為的影響,結果發現經敲降XIST表達后,NSCLC細胞增殖、侵襲能力顯著降低,其細胞中增殖、侵襲相關蛋白表達含量也明顯降低,研究證實敲降LncRNA XIST表達可顯著抑制NSCLC的增殖及侵襲。
研究指出NSCLC中LncRNA UCA1通過靶向調控miR-193a-3p表達發揮促癌作用。miR-18a的表達可激活降低結直腸癌中LncRNA CASC2的表達。以上研究均指出LncRNAs和miRNAs間存在相互作用。為驗證NSCLC中LncRNA XIST是否同樣可作為ceRNA參與腫瘤細胞的發生發展,本研究利用生物信息學數據庫結合NSCLC的miRNA既往研究成果,檢索篩選出與LncRNA XIST存在結合位點的miR-186-5p進行探究,檢測發現敲降XIST表達后,NSCLC細胞中miR-186-5p表達升高。經構建轉染miR-186-5p mimic和inhibitor檢測發現LncRNA XIST與miR-186-5p間存在相互抑制關系。根據LncRNA XIST與miR-186-5p可能存在的結合位點,構建包含miR-186-5p在內的XIST野生型和突變型基因報告載體,利用熒光素霉基因實驗和RIP實驗進一步驗證兩者間的調控關系和調控方式,發現NSCLC細胞中miR-186-5p直接調控XIST,XIST是miR-186-5p的靶向基因,而miR-186-5p以Ago2依賴方式調控XIST表達。營救實驗進一步證實過表達miR-186-5p可逆轉XIST對NSCLC細胞的增殖、侵襲作用。
綜上所述,LncRNA XIST在NSCLC中高表達,LncRNA XIST通過調控 mi R-186-5p表達水平影響NSCLC細胞的增殖和侵襲,XIST可作為其臨床治療的新靶點。

