基于網絡藥理學的鹽酸小檗堿治療胃炎機制研究
李雪梅,吳 堅,徐文堅△
(1. 廣東省中山市小欖人民醫院,廣東 中山 528400; 2. 廣東省汕頭市中心醫院,廣東 汕頭 515000)
胃病的發病率高達80%,其中以胃炎發病率最高[1]。胃炎是各種原因引起的胃黏膜炎癥,為最常見的消化系統疾病,是一種血管系統的活體組織對損傷因子所發生的復雜防御反應,通常包括上皮損傷、黏膜炎性反應和上皮再生3個過程。機體許多成分參與胃炎反應過程,主要包括白細胞、血管壁細胞、細胞外基質和胃炎介質等。胃炎常表現為腹胃脘部不適、疼痛、飯后飽脹、噯氣、反酸,甚至惡心、嘔吐等癥狀[2],影響其正常飲食和生活質量,甚至威脅機體健康。目前,治療胃炎仍以化學藥物為主,能快速改善癥狀,緩解不適,但易復發,甚至會產生嚴重不良反應。隨著現代醫學科學研究技術的發展,藥物分離及分析技術的提高,分子生物學等相關學科研究的深入,結構確定、作用溫和、藥效緩慢與持久的藥用天然產物逐漸成為開發新藥的寶庫。
小檗堿(berberine,BBR,C20H19NO5,相對分子質量為336.37)又名黃連素,可從小檗科、毛茛科、蕓香科、鼠李科等屬植物中提取分離的異喹啉類生物堿[3],是除青蒿素、三氧化二砷及阿帕替尼外,我國自主研發的藥用植物單體藥物,來源廣泛,成本低,不良反應小[4-5],臨床應用廣泛,極具開發潛能。臨床常用的鹽酸小檗堿(BBRH,相對分子質量372.87)具有多種生物活性,以及抗炎、抗菌、降糖、調脂、抗痢疾、抗腫瘤等藥理活性[6-15],可用于治療消化性潰瘍、胃炎、腸炎等消化系統疾病[16]。BBRH 治療胃炎效果良好,但其作用機制尚未見系統報道。目前絕大多數藥物以個別靶點和通路作為研究對象闡明其作用機制,但該法難以全面地反映具有天然屬性的鹽酸小檗堿的藥理機制。網絡藥理學基于系統生物學理論,從藥物、靶點與疾病間相互作用的整體性和系統性出發,通過采用復雜生物網絡模型,揭示藥物、基因、靶點、疾病之間復雜的整體生物網絡關系,在此基礎上分析、預測藥物的藥理學機制[17-20]。目前,多采用網絡藥理學方法研究天然單體藥物和西藥的藥理機制,如丹參酮ⅡA、苦參堿、大黃素、人參二醇、牛磺鵝去氧膽酸、臭椿酮、阿帕替尼等成分和藥物的機制分析[21-27]。本研究中基于網絡藥理學的分析方法,從整體、系統的生物學角度綜合探討BBRH 治療胃炎的作用機制,為BBRH 藥理機制的闡明及其更多臨床應用的開發提供研究思路。現報道如下。
1 資料與方法
1.1 BBRH 靶點收集及其互作網絡(PPI)構建
在NCBI 數據庫中獲得berberine 的SDF 格式文件,并 將 其 上 傳PharmMapper 服 務 器(http:/ / lilab.ecust.edu.cn/pharmmapper/submit_file.php)進 行 靶 點預測,設置獲得前300個人類靶點及其名稱、匹配值(score)、PDBID 等 信 息;將 PDBID 導 入 UniProt(https:/ /www.uniprot.org/)數據庫中檢索和矯正,剔除重復、非人源與不規范的靶點,并結合TCMSP(http:/ /lsp.nwu.edu.cn/tcmsp.php)和Puchem(https:/ /pubchem.ncbi.nlm.nih.gov/)收集的靶點建立Berberine 的靶點數據庫;將BBRH 潛在靶點導入STRING 數據庫(http:/ /string-db.org),選定物種為人類,最后導出BBRH 潛在靶點PPI 網絡文件,并使用Cytoscape 3.6.1 軟件進行可視化分析。
1.2 BBRH 治療胃炎的潛在靶點確認及PPI 構建
以“gastritis”為 關 鍵 詞,在GeneCards(https:/ /www.genecards.org/)數據庫中檢索與胃炎相關的靶點,建立胃炎相關靶點數據庫;按1.1 項下同法構建胃炎PPI 網絡;對BBRH 潛在靶點PPI 網絡和胃炎相關靶點PPI 網絡進行交集比對,確認BBRH 治療胃炎的潛在直接作用靶點及間接作用靶點,按1.1 項下同法構建BBRH 治療胃炎的潛在作用靶點PPI 網絡;采用Cytoscape 3.6.1 軟件自帶的“Network Analysis”插件對該PPI 網絡進行拓撲性質分析,包括度數(degree)和介數中心度(betweenness)[28-29],以大于或等于1 倍介數中心度(betweenness)和接近中心度(closeness)中位數及大于或等于2 倍度數(degree)的中位數為條件篩選關鍵靶點[30]。
1.3 相關通路和注釋分析及其網絡構建
使用DAVID 數據庫(https:/ /david.ncifcrf.gov/)對靶點進行KEGG 生物通路富集分析,并使用Cytoscape 3.5.1 軟件的ClueGO 插件對BBRH 治療胃炎的生物學功能進行注釋分析,并采用其Merge 與Union 功能構建“藥物-靶點-通路”網絡。
1.4 藥物-靶點的分子對接驗證
采用Discovery studio 2.5,AutoDock 1.5.6,PyMOL軟件,分別對原配體和蛋白進行預處理、對接、作圖,以結合自由能(ΔGbind)為參考指標,ΔGbind 值越小,BBRH 與靶點的結合能力越強,并從最優構象上分析BBRH 與靶點的結合模式,從分子水平探討兩者的結合情況,準確了解靶點和活性小分子間的相互作用[31]。
2 結果與分析
2.1 BBRH 靶點收集及其PPI 網絡構建
合并PharmMapper(227)和TCMSP(49)及Pubchem(54)3個數據庫的BBRH 靶點,并取PharmMapper 數據庫中score 排序前30個靶點及其他2個數據庫的靶點,剔除重復項后共獲得117個靶點,詳見圖1。可見,117個靶點共存在1242 條關系,對該網絡的拓撲信息進行分析可知,degree,betweenness,closeness 的中位數分別為8,0.0028,0.433,且符合大于或等于1 倍betweenness 和closeness 中位數及大于或等于2 倍degree 中位數的靶點共20個,該類靶點是BBRH 作用的潛在關鍵靶點。結果見表1。
2.2 胃炎相關靶點的收集及其PPI 網絡構建
從GeneCards 數據庫獲得882個與胃炎相關的靶點,對BBRH 靶點與胃炎相關靶點進行比對,得出31個BBRH 治療胃炎的潛在直接靶點,包括TP53,MAPK1,COX-2,PPARG,IFN-γ 等。BBRH 靶點與胃炎靶點的韋恩圖見圖2。在BBRH 治療胃炎的潛在直接靶點PPI網絡中有30個靶點存在相互作用,且構成127 條關系,詳見圖3。對BBRH 治療胃炎的潛在直接靶點PPI 網絡進行Network Analyzer 分析發現,該PPI 網絡中的degree,betweenness,closeness 分 別 為 6.5,0.00729,0.537,其中符合篩選條件的靶點有TP53,MAPK1,COX-2,PPARG,這4個靶點是連接其他靶點的樞紐,提示其在BBRH 治療胃炎過程中可起到關鍵作用。
此外,BBRH 治療胃炎的31個潛在直接靶點與651個胃炎相關靶點存在相互作用關系,表明BBRH 通過直接作用到31個潛在靶點上而再影響到651個靶點的活性,詳見表2;對間接靶點PPI 網絡進行拓撲性質分析,并列出了該網絡符合關鍵參數條件的前50個靶點,其中包括白細胞介素6(IL-6)等靶點。結果見表3。

圖1 鹽酸小檗堿作用靶點的互作網絡

表1 關鍵藥物靶點的拓撲參數基本情況
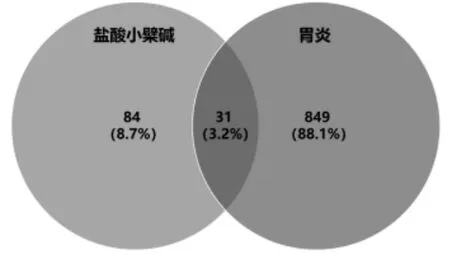
圖2 鹽酸小檗堿治療胃炎的潛在直接靶點韋恩圖
2.3 相關通路和注釋分析及其網絡構建
對靶點進行ClueGO 生物功能注釋,BBRH 治療胃炎的潛在生物學功能主要概括為13個方面的內容,如細胞因子介導信號通路調節、活性氧的代謝調節、一氧化氮生物合成過程、血管內皮細胞遷移的調控、外源性凋亡信號通路的調控、RNA 聚合物的轉錄、端粒酶活性的調節等,該類生物功能均與細胞增殖、細胞遷移、細胞凋亡、血管再生、細胞周期的調控,以及轉錄、翻譯、信號轉導、炎性反應、免疫應激等生物過程密切相關,提示BBRH 對胃炎的治療是通過多種生命過程共同干預胃炎的發生、發展實現的。

圖3 鹽酸小檗堿治療胃炎的潛在直接靶點PPI 網絡
為了進一步探討BBRH 治療胃炎的潛在作用機制,將31個潛在靶點映射到DAVID 數據庫,進行KEGG 通路富集,共富集到64 條信號通路(見表4),其中P>0.05的通路共有50 條,主要與炎癥、癌癥、免疫等相關(包括TNF 信號通路等炎癥通路、B 細胞受體信號通路等免疫通路、PI3K-Akt 信號通路等常見腫瘤經典通路)。共12個靶點富集在幽門螺桿菌感染的上皮細胞信號傳導(DDR1,IκB-α,MAPK14)、缺氧誘導因子-1 信號通路(HIF-1α,IFN-γ,MAPK1,iNOS,eNOS)、血管內皮生長因子信號通路(MAPK1,iNOS,eNOS,COX-2)、腫瘤壞 死 因 子 信 號 通 路(IκB-α,COX-2,MAPK14,MAPK1)、花生四烯酸代謝通路(COX-1,COX-2)、病灶粘連(BRAF,DDR1,GSK-3β,MAPK1)等與胃炎的發生,發展密切相關的信號通路中,體現了BBHR 干預胃炎的多途徑作用特點。為更清晰地了解BBRH 干預胃炎的潛在機制,本研究中構建了“藥物-靶點-通路”可視化網絡,有助于BBHR 干預胃炎機制的闡釋。詳見圖5。
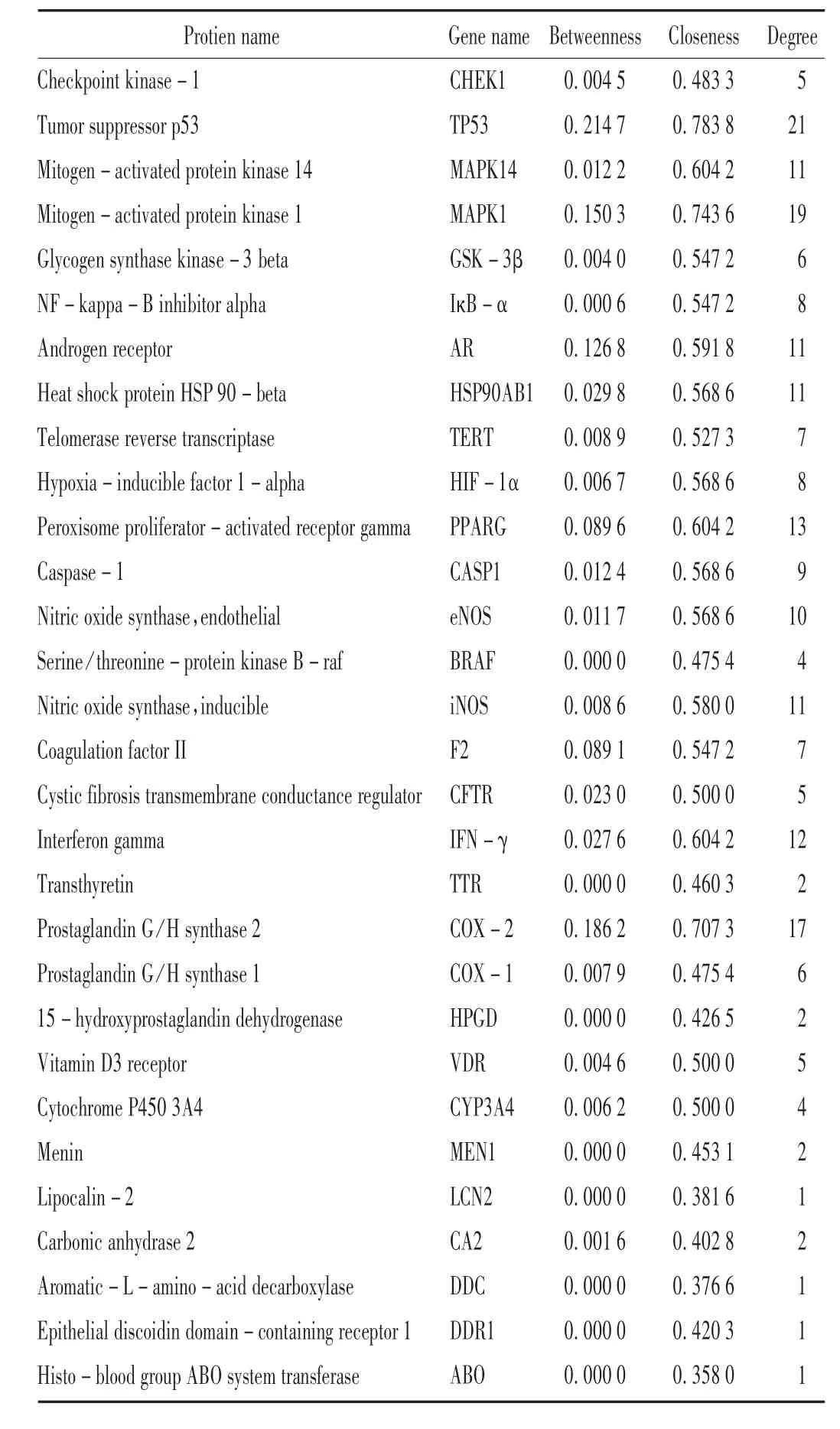
表2 鹽酸小檗堿治療胃炎的潛在直接靶點的拓撲參數基本情況

表3 間接靶點的關鍵節點拓撲參數基本信息
2.4 分子對接驗證

圖4 鹽酸小檗堿治療胃炎的生物學功能注釋
將富集在與胃炎發生、發展密切相關通路的12個潛在靶點與BBRH 進行分子對接(見圖4),配體與受體結合的構象穩定時能量越低,發生作用可能性越大。本研究中的分子對接結果表明,BBRH 與12個靶點的親和力和各蛋白原配體的親和力相近,其中親和力最強的是iNOS(見圖6),BBRH 與iNOS 的Tyr-483,Gln-199,Trp-366 存在氫鍵作用,其自由能為-10.1 kcal/mol,不僅接近于原配體與該蛋白的自由能,且結合最穩定。詳 見 表5。此 外,BBRH 與IFN-γ,MAPK1,eNOS,GSK-3β 等靶點的自由結合能較其對應的原配體更低,且存在氫鍵作用。與原配體的結合相比,BBRH 與這些靶點的結合更親和和穩定,體現了BBRH 多靶點的作用特點。
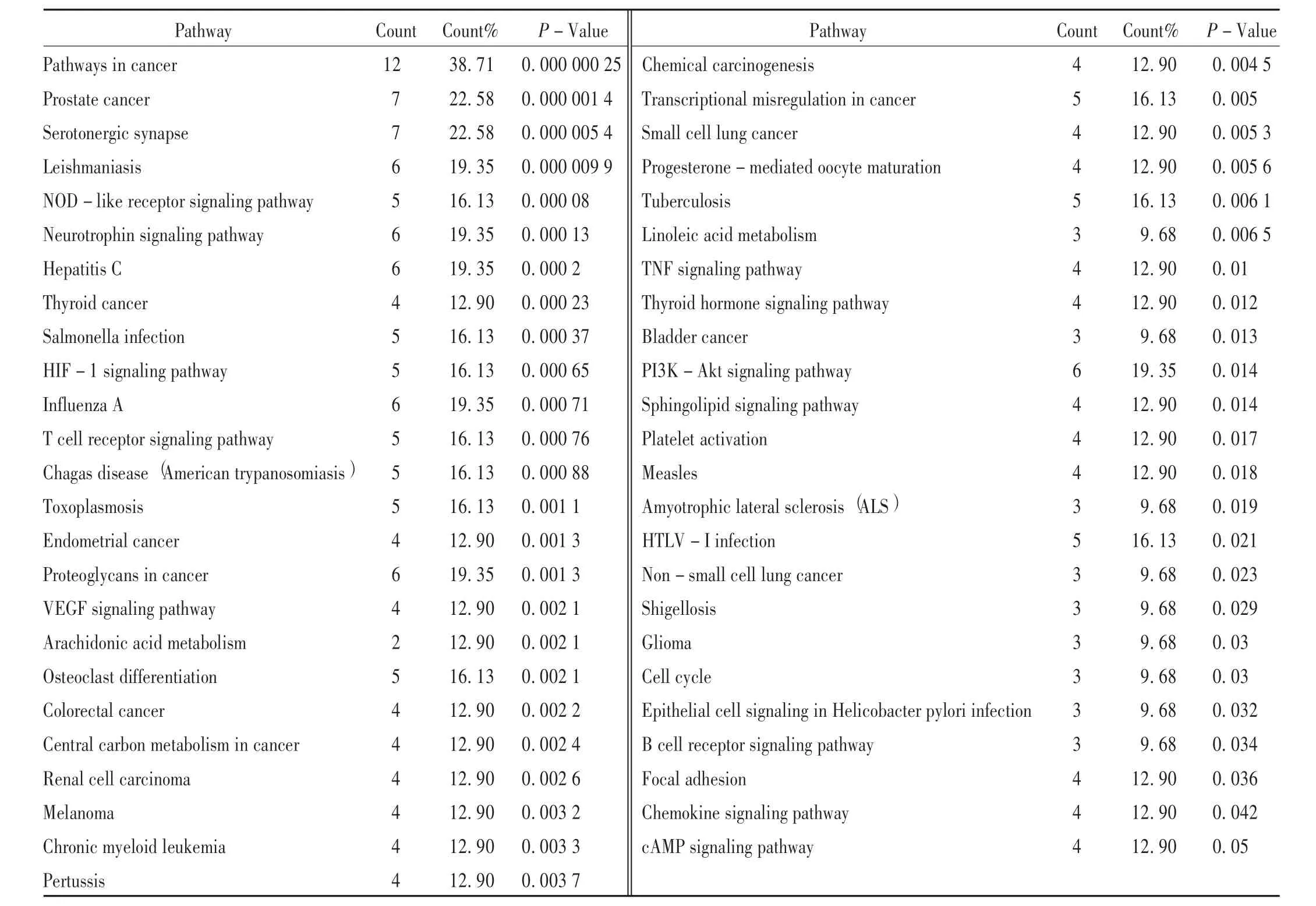
表4 鹽酸小檗堿治療胃炎的信號通路
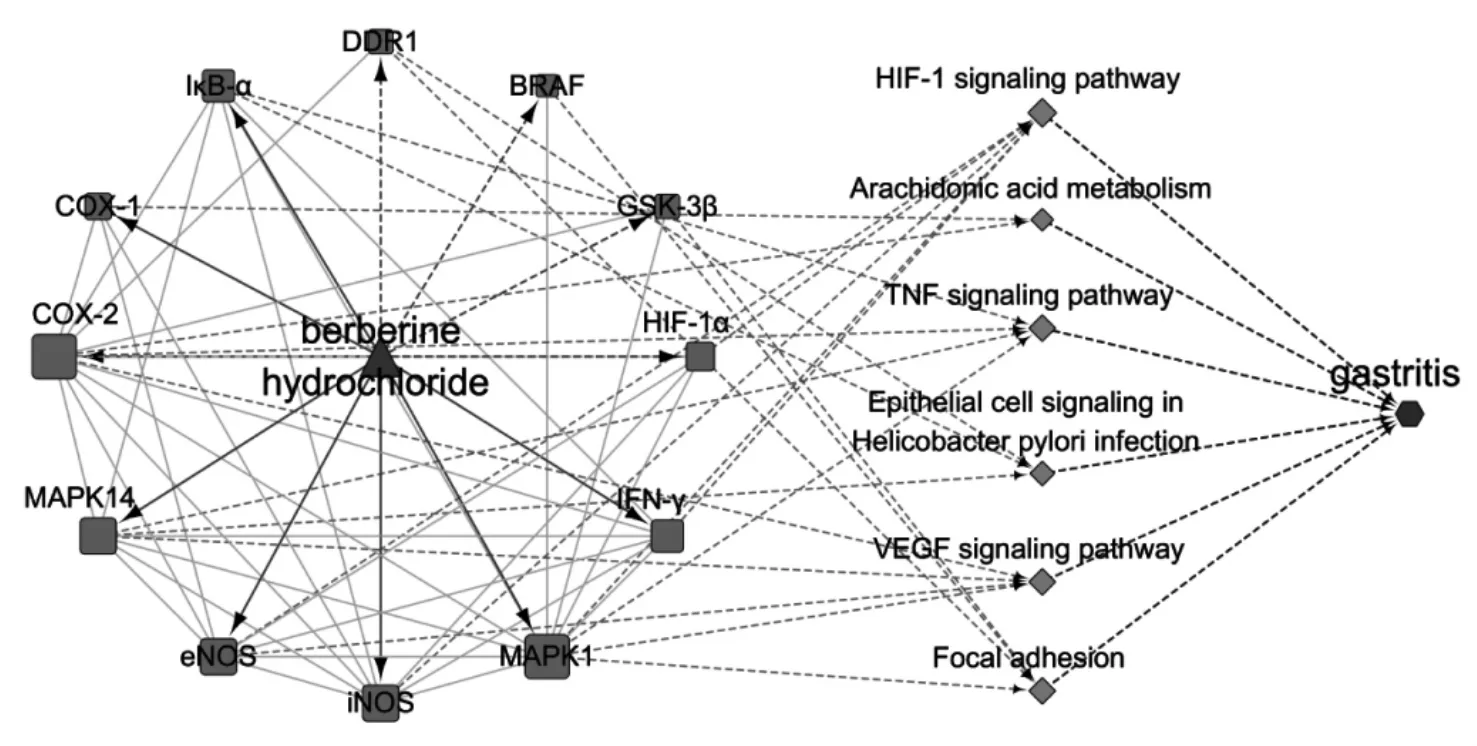
圖5 鹽酸不檗堿對胃炎的“藥物-靶點-通路”干預網絡
3 討論
網絡藥理學是一種集系統生物學和多向藥理學及計算機分析技術網絡為一體的新型學科,其可將藥物和疾病緊密關聯起來[32],建立既復雜又清晰的藥物-靶點-疾病的相互作用網絡,助力現代藥物研究者從系統和整體的角度闡明和理解藥物作用機制,可為先導化合物的發現、新藥靶點的識別等研究提供新策略和思路[33-34]。本研究中通過網絡藥理學研究發現,BBRH 可通過多靶點、多通路的作用特性干預胃炎的發生、發展。
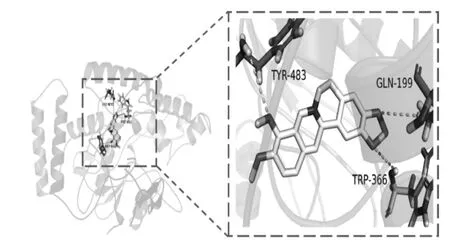
圖6 鹽酸小檗堿與NOS2 分子對接圖

表5 鹽酸小檗堿與14個重要靶點的對接結果
通過PharmMapper 服務器和TCMSP 數據庫獲得的BBRH 靶點與利用GeneCards 數據庫得到的胃炎相關靶點進行對比與分析,并預測到BBRH 干預胃炎的潛在靶點共31個。然后利用STRING 數據庫構建PPI,分析發現,共有30個蛋白存在相互作用關系,其中COX-2,MAPK1,TP53,PPAPG 等靶點較關鍵,這表明BBRH 干預胃炎的效果是通過多靶點相互作用實現的。隨后利用ClueGO 對這些靶點進行GO 生物功能注釋,結果表明,這些靶點主要參與機體多種應激反應和多種蛋白酶的生物合成過程,也參與蛋白、氨基酸、脂質等代謝,調控細胞增殖與凋亡、免疫應答及信號傳導,調控多種金屬離子的運轉和多種蛋白激酶的活性及細胞活化等作用,提示BBRH 干預胃炎的作用可通過多層次、多途徑實現。
對以上靶點進行KEGG 通路富集分析發現,31個靶點分布在64 條信號通路上,其中12個靶點富集在6 條與胃炎發生、發展密切相關的通路上,主要為酶類(包括蛋白酶、蛋白激酶、氧化還原酶等)、受體、轉錄因子等。分子對接結果也表明,BBRH 與這些靶點均有良好的結合,進一步分析發現,COX-2 和MAPK1 分別都富集在3 條通路中,且為在12個靶點中的拓撲參數最大的2個靶點。此外,BBRH 與iNOS 的結合最親和,表明其在BBRH 干預胃炎的過程中發揮著較重要的作用,提示網絡藥理學對BBRH 干預胃炎的機制研究具有一定的可靠性和參考價值。
COX 主要分為COX1 和COX-2,前者在大多數正常組織中表達,負責生理性PG 的生成,后者在正常內環境中不表達,但其升高可導致炎性級聯反應和組織損害,并與炎癥程度呈正相關。COX-2 是催化花生四烯酸(AA)裂解為前列腺素類等致炎介質的關鍵酶,其介導的級聯反應可調節炎性介質NO 和前列腺素類(PGs)的合成和釋放,該酶活性的降低或抑制能有效控制炎癥的發生[35]。有研究發現,胃炎患者的COX-2 的蛋白表達陽性率很高[36],表明COX-2 蛋白的表達可促進黏膜的炎性反應[37]。因此,對COX-2 蛋白表達下降可修復胃黏膜并恢復其正常的生理功能,進而緩解胃炎的癥狀[38]。
BBRH 具有保護胃腸道黏膜的作用,可誘導胃腸黏膜中PGE2 含量的增加,COX-1 表達的升高及COX-2表達的降低[39],同時,促進可能與胃腸黏膜血管內皮細胞分泌NO 密切相關的eNOS 的表達,介導胃黏膜血管內皮細胞依賴性舒張反應,改善胃局部微循環,通過修復胃黏膜的損傷,恢復胃腸黏膜的生理功能、增強其對外界刺激的防御能力,從而實現BBRH 對胃腸黏膜的保護作用。
MAPK1(ERK 1/2)和MAPK14(p38)均為絲裂原活化蛋白激酶(MAPK)家族成員,參與機體對外界環境應激的適應、炎性反應等多種生理、病理過程,是多種抗炎藥物作用的共同通路[40]。在生理狀態下,NF-κB 以p50-p65 異源二聚體的形式存在,且與IκB 結合而處于失活狀態[41]。IκB-α 是遏制NF-κB 核因子活性的關鍵蛋白[42],可通過與NF-κB 二聚體結合,使NF-κB 以失活的靜息狀態存在細胞質中。但當細胞受到外界刺激時,IκB-α 被磷酸化[43],NF-κB 變為游離狀態,啟動相關基因的轉錄和表達,誘導相關炎性因子、趨化因子及炎性介質表達,放大炎性損傷[44]。BBRH 能下調MAPK 信號通路中ERK 1/2 和p38 蛋白磷酸化水平,提高兩者總蛋白的表達水平[45]。此外,BBRH 還能降低NF-κB 信號通路中p65 蛋白和IκB-α 的磷酸化水平和提高IκB-α 總蛋白表達水平[46],從而減少炎性因子的轉錄和表達,減輕炎癥對組織的繼續損傷而發揮其抗炎效應。
BRAF 作為一種蛋白激酶也參與了促有絲分裂信號從細胞膜到細胞核的傳遞,能磷酸化MAPK1 激活MAPK/ERK 信號通路,影響細胞分裂、分化和分泌[47]。由分子對接結果可知,BBRH 可與BRAF 的Lys483,Sep467,Phe595,Ser463 形成較穩定的氫鍵,據此推測BRAF 也是BBRH 參與胃炎治療的重要靶點。
慢性胃炎多由幽門螺桿菌感染引發。幽門螺桿菌是定植于胃黏膜表面和黏膜層之間的微需氧菌,其細胞壁的主要成分為脂多糖,可使單核細胞、巨噬細胞分泌抗原類物質,幽門螺桿菌感染機體的同時可刺激iNOS 表達增高,該蛋白誘導產生的NO 含量也隨之增加[48],進而引起并加劇了胃黏膜的炎性反應,造成胃黏膜發生損傷及萎縮等變化。故幽門螺桿菌的陽性率越高,慢性胃炎的癥狀就越重[49]。
在機制方面,受體酪氨酸激酶(DDR1)在多個臟器的炎癥中發揮重要作用[50-51],參與調節炎性細胞在病灶的聚集和浸潤,可通過促進炎性細胞對膠原基質屏障的黏附和侵襲作用[52],在多種炎癥性疾病的發生、進展中發揮關鍵作用[53]。BBRH 在體內外對幽門螺桿菌均有較強的抑制或殺滅作用,其機制可能為抑制細菌在胃上皮的附著和增殖[54]。此外,BBRH 還可抑制促炎因子iNOS 的表達[55],減少炎性介質的產生。
在炎性反應和缺氧環境中,缺氧誘導因子-1α(HIF-1α)對此環境中的代謝、增殖、凋亡、炎性免疫反應中發揮重要作用[56-58]。目前,HIF-1 與PI3K,MAPK,NF-κB 信號傳導通路之間聯系緊密[59-60],多個促炎因子的轉錄和表達受HIF-1 的調控[61],如HIF-1α 調節iNOS 表達升高后產生的NO 可促進炎性細胞釋放TNF-α,放大炎性反應。同時,TNF-α[62],IL-1β[63],ROS[64],NO[65]、生長因子[66]等致炎因子也能激活HIF-1α 的轉錄和表達,提示HIF-1 與炎性反應過程密切相關[67],并認為HIF-1α 可能作為炎癥疾病治療的一個新靶點[68-69]。分子對接結果顯示,HIF-1α 與Tyr310,Arg383,Arg322 形成穩定的氫鍵,提示HIF-1α 也可能在BBRH 治療胃炎的過程中起到非常重要的作用。
糖原合酶激酶3β(GSK-3β)是一種廣泛表達在真核生物中的一種多功能絲氨酸/蘇氨酸激酶,參與細胞分化、增殖、凋亡、代謝等多種細胞活動過程[70-72]。GSK-3β 可參與調控炎癥信號轉導通路[73],在炎癥性疾病的發生、發展中可選擇性地調控炎癥信號的轉導。在不同致病源刺激下,GSK-3β 可選擇性調控MyD88和TRF 依賴性的信號轉導通路,正向調控促炎因子和IFN-γ 的產生,介導不同的炎性反應[74-75],當GSK-3β活性受到抑制或其基因被敲除后,可下調IL-16,IL-12,TNF-α 等促炎因子的產生,上調IL-10 等抗炎因子的分泌[76-77]。對分子的對接結果分析發現,BBRH 與GSK-3β的Tyr134,Ser467,Phe201,Gln185 形成較穩定的氫鍵,推測GSK-3β 也可能參與了BBRH 對胃炎的治療。
綜上所述,可通過調節多條生物通路共同作用抑制炎性因子的產生,促進胃黏膜保護物質的分泌,阻斷病菌遷移、侵襲、增殖、凋亡等過程干預胃炎的發生、發展。因此,推測BBRH 主要可通過修復胃黏膜、減輕炎癥損傷、消除幽門螺桿菌感染等功能發揮其治療胃炎的作用。
本研究中通過“藥物-靶點-疾病”關系網絡的構建,獲得了BBRH 干預胃炎的重要靶點,其中BBRH 與部分靶點的作用已有文獻證實,在一定程度上確證了本研究的準確性,其余靶點的作用尚需進一步探討,并給予實驗確證;初步解釋了BBRH 干預胃炎的作用是通過多層次調控實現的,為今后更加深入地闡明BBRH 治療胃炎的機制提供了理論依據和線索。

