低劑量微囊藻毒素MC-LR誘導羅氏沼蝦肝胰腺損傷及凋亡
曹清晟,王麗萍,楊輝,魏文志,張瑩瑩
揚州大學動物科學與技術學院,揚州 225000
近年來,由于生活及工農業生產中含有大量氮、磷的廢污水進入水環境中,導致水體富營養化,水華藻類大量增殖,其中藍藻水華的發生范圍最廣,并且釋放微囊藻毒素(MCs),對人類及其他動物的危害也最為嚴重[1-2]。MCs主要是具有生物活性的環庚肽化合物,已經發現了100多種不同類型的MCs異構體,其中,MC-LR是分布最廣和毒性最強的亞型[3-4]。天然水體中,MCs的含量一般在0.1~10 μg·L-1之間,但是在藻類爆發季節,MCs的含量也可以升到幾十μg·L-1[5-6]。水中的MCs不僅對水生生物有直接危害,而且通過飲用水或食物鏈對鳥類、家畜和人類產生毒害作用。我國規定居民飲用水MCs的含量不得超過1 μg·L-1。迄今為止,由于微囊藻爆發尚未找到有效的解決方法,給人類的生產及生活帶來較大的影響,MCs的生物毒性研究一直以來都是國內外研究的熱點。
MCs具有明顯的嗜肝性,與肝癌的發生、肝內出血以及肝壞死有密切關系[7]。除肝臟外,MCs可富集在動物的多個器官中,包括心臟、腸、性腺、肌肉、腎臟和肺組織中,進而產生毒害效應[8-9]。目前,其毒性作用研究主要集中在對動物新陳代謝、個體生長發育、免疫機能、神經毒性以及生殖毒性等方面[8-13]。MCs通過細胞膜上三磷酸腺苷(ATP)依賴的轉運體進入細胞,然后特異性抑制絲氨酸和蛋白磷脂酸合成酶1和2A的活性,從而影響細胞內蛋白磷酸化和去磷酸化,破壞細胞骨架,最終導致細胞凋亡和壞死[14]。MCs還可通過減少白細胞總數,誘導淋巴細胞凋亡、壞死,最終降低機體免疫水平[15-16]。此外,MCs會破壞動物機體的活性氧(ROS)平衡[17],損傷細胞DNA,抑制DNA的修復活性,誘導細胞凋亡及壞死[18-19]。
目前,MCs毒性機制的研究主要集中在哺乳動物及魚類等脊椎動物上,對無脊椎動物如南美白對蝦、克氏原螯蝦、日本沼蝦和鹵蟲等也有相關報道[20-22]。羅氏沼蝦(Macrobrachiumrosenbergii)是節肢動物門的一種,隸屬于大氏沼蝦屬,是世界上最大的淡水對蝦品種,具有生長速度快、餌料食譜廣和抗病害強等特點,是我國大型養殖業生產的一種特殊水產養殖品種,在我國廣東、江蘇和浙江等省份有較大的養殖規模。由于羅氏沼蝦的養殖主要以投喂飼料為主,所以養殖水體中氮磷濃度較高,每年的6—10月份,蝦塘藍藻水華爆發嚴重。所以MCs已經成為影響羅氏沼蝦生長的不可以忽視的一個因素,但是關于MCs對羅氏沼蝦的毒性機制研究的報道較少。因此,本研究以MC-LR和羅氏沼蝦為研究對象,通過組織學觀察、免疫組化定位、氧化應激指標測定以及熒光定量PCR技術探究養殖水體中常見的低濃度MCs對羅氏沼蝦肝臟的毒害效應及潛在機制。
1 材料與方法(Materials and methods)
1.1 實驗材料
實驗用羅氏沼蝦購買于中國江蘇省高郵市羅氏沼蝦養殖場,藥物MC-LR(純度≥95%)購買于中國上海源葉生物科技有限公司。
1.2 實驗方法
1.2.1 實驗動物處理及樣品收集
實驗所用的羅氏沼蝦(5月齡)飼養于實驗用玻璃缸內,密度大約為1 L水1 g蝦,養殖用水充分曝氣,水溫控制在(28±0.5) ℃,光照/黑暗周期為14 h/10 h,每天投喂2次羅氏沼蝦專用飼料,在實驗室適應2周后,平均體重在(11.31±1.05) g,將蝦隨機分組,分別暴露在0、0.5和5 μg·L-1的MC-LR溶液中1、2和3周,設置3個平行。MC-LR的暴露濃度根據其在自然水體中的濃度設定。暴露期間,每天更換暴露用水的1/2,并補充相應劑量的MC-LR,在暴露1、2和3周時分別采樣一次。在每個采樣時間點,每個玻璃缸內隨機撈取3只蝦,稱重,解剖后采集肝胰腺組織并稱重,計算肝體指數(HSI),計算公式為HIS=肝臟重量/體重×100%。一部分肝胰腺用Bouin固定液(索萊寶,中國)固定,以進行石蠟切片組織學觀察、MC-LR富集和細胞凋亡檢測,一部分肝胰腺組織立即儲存于-80 ℃,待進行氧化應激指標和實時定量PCR分析。
1.2.2 組織學觀察
取0.3 cm3左右的肝胰腺組織塊用波恩固定液(索萊寶)固定48 h;經梯度乙醇脫水后再使用水楊酸甲酯脫色12~24 h,待組織完全透明后,再浸蠟然后包埋;蠟塊凝固后使用渦輪式切片機(Leica RM2235,德國)進行切片,切片的厚度為6 μm;二甲苯脫蠟,梯度酒精復水后使用HE方法染色,梯度酒精脫水后中性樹膠封片,室溫晾干后即可顯微鏡觀察拍照(Olympus BX53,日本)。
1.2.3 肝胰腺中的MC-LR免疫定位
將石蠟切片用二甲苯脫蠟,然后使用梯度酒精脫水,BSA進行抗原封閉,用MC-LR免疫抗體(1∶500稀釋) (上海羽朵生物,中國)進行孵化過夜,再用小鼠二次抗體孵化后,采用辣根過氧化氫酶DAB顯色試劑盒(碧云天,中國)進行顯色,梯度酒精脫水后使用中性樹脂進行密封后,用顯微鏡對組織樣進行檢測。
1.2.4 肝胰腺細胞凋亡檢測
細胞凋亡檢測使用TUNEL組織染色試劑盒(碧云天,中國)進行。簡要步驟:(1)用20 mg·L-1蛋白酶K將切片處理15 min;(2)用TdT反應液(TdT酶以及生物素標記的dUTP)在37 ℃孵育1 h,然后使用標準檸檬酸鹽液處理15 min終止反應,再使用磷酸鹽緩沖液(PBS)(pH=7.4)洗去未結合的生物素標記的dUTP;(3)使用體積分數為3%的H2O2處理5 min,阻斷內源性過氧化物酶;(4)將切片用鏈霉素標記的辣根過氧化物酶室溫孵育30 min后,使用PBS洗去未反應試劑;(5)使用DAB顯色,并用蘇木素染核。陽性對照為DNase I處理后的切片;陰性對照在步驟(2)中使用等體積的PBS替代TdT。觀察方法同普通HE染色組織切片。細胞核被染成棕色的細胞為凋亡細胞。
1.2.5 氧化應激指標測定
肝胰腺組織使用PBS研磨后,離心,上清液用于測定氧化應激相關指標包括過氧化氫(H2O2)、總抗氧化能力(T-AOC)以及一氧化氮(NO)由試劑盒測定(南京建成,中國),具體操作及計算方法依照說明書進行,蛋白定量使用Bradford蛋白濃度測定試劑盒進行(碧云天,中國)。
1.2.6 總RNA提取、反轉錄及qPCR
使用Trizol一步法提取肝胰腺組織的總RNA,通過瓊脂糖凝膠電泳28s rRNA和18s rRNA比值檢測RNA完整性。用微量分光光度計(Thermo NanoDrop 2000c,美國)測定分離RNA的濃度和純度,總RNA使用帶基因組DNA去除的反轉錄試劑盒(Takara,日本)反轉成cDNA。通過實時熒光定量PCR(qPCR)檢測促凋亡基因(bax)、抗凋亡基因(bcl2)、細胞色素C基因(cytc)以及半胱氨酸蛋白酶3基因(casp3)的mRNA的表達。選擇18s rRNA(18s)和β-機動蛋白(actb)作為內參基因,所使用的引物序列如表1所示,引物的擴增效率(E)值都在90%~110%之間。基因的相對表達量采用2-△△Cq法進行(F=2-△△Cq, △△Cq=(Cqtarget gene-Cqmean of actband18s)enrofloxacin-(Cqtarget gene-Cqmean of actb and 18s)control)計算MC-LR暴露下基因表達的相對變化。
1.3 數據分析
所有數據均用均數±標準誤(SEM)表示,分析前對數據進行分布正態性檢驗(Shapiro-Wilk檢驗)和方差齊性檢驗(Levene’s檢驗),對不符合正態性和同方差的數據進行對數(lg)轉換,然后進行單因素方差分析,對差異顯著的數據集進行Tukey檢驗,顯著性水平P<0.05。

表1 定量引物序列Table 1 Primer sequences for qPCR
2 結果(Results)
2.1 MC-LR誘導肝胰腺的損傷
如圖1(a)所示,對照組中的肝小管形態完整,相互之間連接緊密,刷狀緣發達。在低濃度MC-LR處理的前2周肝胰腺組織無明顯變化,而在處理的第3周發現肝小管之間的縫隙變大,部分連接消失(圖1(b))。高濃度MC-LR處理下,第1周即出現上述現象(圖1(c)),隨著暴露時間延長,肝小管間的縫隙逐步加大,連接逐漸消失,肝小管壁逐漸變薄,乃至消失;在暴露3周后,發現部分肝小管中的刷狀緣消失(圖1(d)和(e))。
2.2 MC-LR在肝胰腺組織中的富集
對照組未檢測到MC-LR(圖2(a));在低濃度(0.5 μg·L-1)的MC-LR暴露下,羅氏沼蝦的肝胰腺組織中,在暴露后的第1、2和3周內都沒有出現明顯的MC-LR毒素蓄積現象;在高濃度(5 μg·L-1) MC-LR暴露下,第1周即發現MC-LR在羅氏沼蝦肝胰腺少量富集,隨著暴露時間的延長,MC-LR的富集增多,并且在肝胰腺組織的邊緣部MC-LR富集更為明顯(圖2(b)~(d))。
2.3 MC-LR誘導肝胰腺細胞凋亡
如圖3所示,對照組的肝胰腺中,沒有明顯凋亡的細胞。低濃度(0.5 μg·L-1)MC-LR處理組在整個暴露階段也沒有明顯的凋亡現象發生。高濃度(5 μg·L-1)MC-LR處理組,在暴露的第3周,發現了被染成棕色的凋亡細胞。
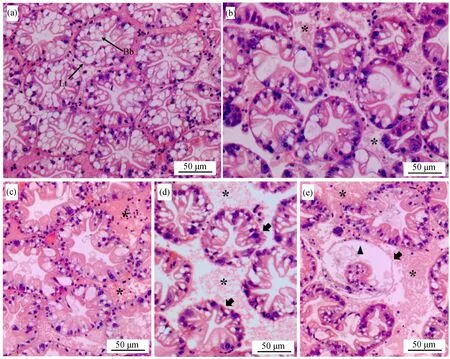
圖1 微囊藻毒素LR(MC-LR)誘導羅氏沼蝦肝胰腺損傷注:(a) 對照組;(b) 0.5 μg·L-1 MC-LR處理組暴露3周;(c) 5 μg·L-1 MC-LR處理組暴露1周;(d) 5 μg·L-1 MC-LR處理組暴露2周;(e) 5 μg·L-1 MC-LR處理組暴露3周;Lt為肝小管,Bb為刷狀緣;星號表示肝小管之間連接組織消失,縫隙變大;箭頭表示肝小管壁變薄;三角形表示肝小管刷狀緣消失。Fig. 1 Microcystin LR (MC-LR) induced hepatopancreas injury of Macrobrachium rosenbergiiNote: (a) control group; (b) 0.5 μg·L-1 MC-LR treatment group after 3 weeks; (c) 5 μg·L-1 MC-LR treatment group after 1 week; (d) 5 μg·L-1 MC-LR treatment group after 2 weeks; (e) 5 μg·L-1 MC-LR treatment group after 3 weeks; Lt stands for hepatic tubule; Bb stands for brush border; asterisk shows that the connective tissue between the hepatic tubules disappeared, and the gap became larger; the arrow shows that the hepatic tubule wall became thin; the triangle shows the brush border in the hepatic tubules disappeared.
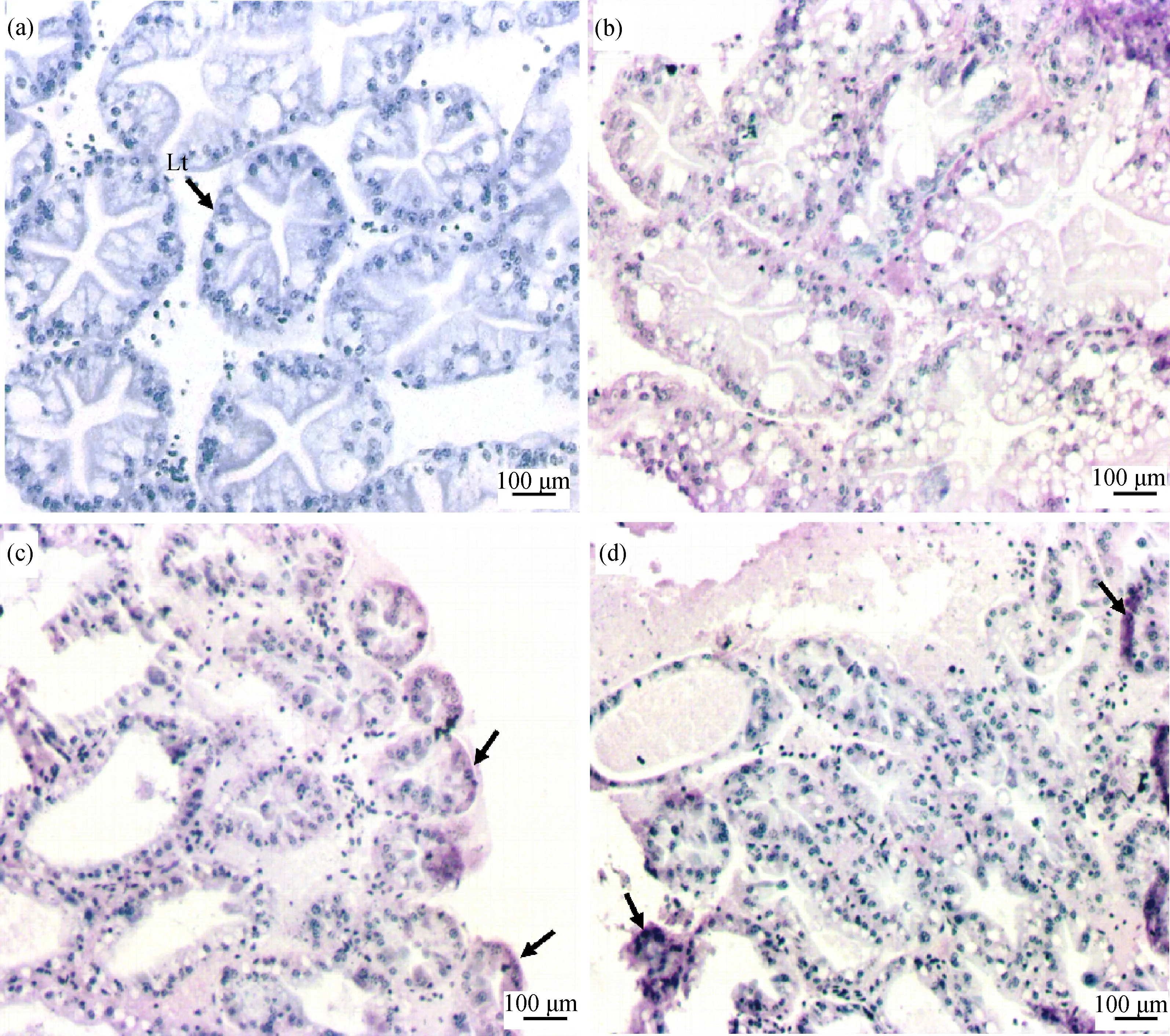
圖2 MC-LR在羅氏沼蝦肝胰腺組織中蓄積注:(a) 對照組;(b) 5 μg·L-1 MC-LR處理組暴露1周;(c) 5 μg·L-1 MC-LR處理組暴露2周;(d) 5 μg·L-1 MC-LR處理組暴露3周;Lt表示肝小管;紫色為MC-LR毒素富集;黑色箭頭指示MC-LR富集較多的部位。Fig. 2 MC-LR accumulated in the hepatopancreas of Macrobrachium rosenbergiiNote: (a) control group; (b) 5 μg·L-1 MC-LR treatment group after 1 week; (c) 5 μg·L-1 MC-LR treatment group after 2 weeks; (d) 5 μg·L-1 MC-LR treatment group after 3 weeks; Lt stands for hepatic tubule; purple indicates MC-LR enrichment; black arrow indicates the site where MC-LR is abundantly enriched.

圖3 MC-LR誘導羅氏沼蝦肝胰腺細胞凋亡注:(a) 對照組;(b) 5 μg·L-1 MC-LR處理組暴露3周;黑色箭頭指示被染成棕色的凋亡細胞。Fig. 3 MC-LR induced hepatic cell apoptosis in Macrobrachium rosenbergiiNote: (a) control group; (b) 5 μg·L-1 MC-LR treatment group after 3 weeks; black arrow shows apoptotic cells stained brown.
2.4 MC-LR對氧化應激相關指標的影響
如圖4所示,在暴露第2周,5 μg·L-1MC-LR顯著上調了肝胰腺中H2O2的水平0.22倍;在暴露第3周,0.5和5 μg·L-1MC-LR顯著誘導肝胰腺H2O2水平0.19倍和0.38倍。0.5 μg·L-1MC-LR在暴露1周后顯著上調NO含量0.23倍,在暴露2周后顯著上調NO含量0.36倍;NO含量在5 μg·L-1MC-LR處理組中,在暴露2周和3周后,分別顯著上調0.62倍和0.41倍。5 μg·L-1MC-LR在暴露的1周后顯著上調T-AOC含量1.43倍,在暴露3周后顯著下調T-AOC含量19%。
2.5 MC-LR對凋亡相關基因表達的影響
如圖5所示,在暴露1周和3周后,0.5 μg·L-1MC-LR分別顯著上調bax基因表達0.49倍和0.22倍;5 μg·L-1MC-LR在暴露1周后顯著上調bax基因表達2.24倍,在暴露3周后顯著下調bax表達72%。暴露2周后,bcl2的表達在0.5和5 μg·L-1MC-LR處理組中分別顯著上升0.80倍和0.61倍;在暴露3周后,其表達在0.5 μg·L-1MC-LR處理組中顯著上升0.49倍。在0.5 μg·L-1MC-LR處理組中,cytc基因的表達在暴露后1周顯著上升1.82倍,在暴露3周后,顯著下調49%;在5 μg·L-1MC-LR處理組中,cytc基因的表達在暴露后1周和2周分別顯著上升1.88倍和0.70倍,在暴露3周后,顯著下調50%。在3個時間點,casp3基因的表達均被MC-LR抑制(76%~23%)。
3 討論(Discussion)
藍藻水華以及其產生的MCs一直以來都是威脅水產養殖業健康發展的主要問題之一。在羅氏沼蝦的養殖中,由于投飼量較大,水體的富營養化程度高,藍藻水華爆發更為嚴重,對羅氏沼蝦的健康養殖帶來較大影響。在本研究中,為了探究環境相關濃度的MCs對羅氏沼蝦的毒性效應,選取了與水環境中MCs濃度比較接近的0.5和5 μg·L-12個MC-LR濃度作為實驗濃度;并且考慮到蝦類接觸藻毒素的方式是通過鰓呼吸、體表滲入以及食物帶入等多個途徑,因此,采用更接近其真實生活狀態的養殖水體暴露方式進行;通過毒素暴露濃度與方式的控制,保證能夠更加準確地反映自然水體中MCs對羅氏沼蝦的毒害效應。
肝臟是MCs主要的靶器官,本研究的MC-LR免疫組化結果表明,較高濃度(5 μg·L-1)的MC-LR可在羅氏沼蝦的肝胰腺中富集,并且富集量隨時間增加。Yuan等[23]對克氏原螯蝦和日本沼蝦進行了為期7 d的MC-LR暴露,并通過液質聯用檢測了MC-LR在蝦體內的富集情況,結果與本研究相似,MC-LR在肝胰腺組織中的富集也是隨暴露時間增加而增多。不同的是在暴露1周后,0.1 μg·L-1MC-LR處理組的克氏原螯蝦及日本沼蝦的肝胰腺中也有毒素檢出,而本研究中低濃度處理組(0.5 μg·L-1MC-LR)中沒有發現毒素的明顯富集。其主要原因可能有2點,一是液質聯用檢測的敏感度更高,二是不同的蝦對MCs的代謝強度有差異,羅氏沼蝦可能對MC-LR的代謝能力更強。此外,本研究發現,MC-LR在肝胰腺組織外緣富集更多,這可能也意味著MCs對肝胰腺外緣部分損傷更大。
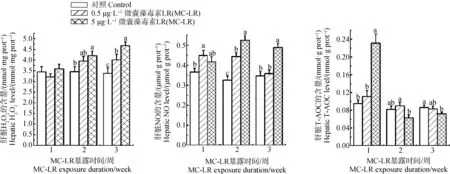
圖4 MC-LR對羅氏沼蝦肝胰腺氧化應激相關指標的影響注:數據均以mean±SEM表示,標注不同字母表示差異顯著(P<0.05)。Fig. 4 Hepatic oxidative stress-related index levels of Macrobrachium rosenbergii in response to MC-LR exposureNote: All data were expressed as mean±SEM; bars with different letters indicated significantly difference at P<0.05.
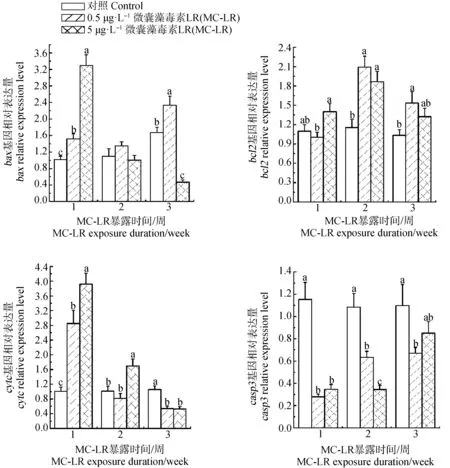
圖5 MC-LR對羅氏沼蝦肝胰腺凋亡相關基因表達的影響注:數據均以mean±SEM表示,標注不同字母表示差異顯著(P<0.05)。Fig. 5 Hepatic apoptosis-related gene expression of Macrobrachium rosenbergii in response to MC-LR exposureNote: All data were expressed as mean±SEM; bars with different letters indicated significantly difference at P<0.05.
組織學切片結果表明,環境相關濃度的MC-LR對羅氏沼蝦的肝胰腺有較大的損傷作用,即使是在低于我國飲用水安全濃度標準(0.5 μg·L-1)下,MC-LR的長時間暴露也會對肝胰腺產生損傷。MC-LR產生這種損傷的機制是什么?許多研究表明,MCs可以通過誘導氧化應激對機體產生損傷[18,24-25]。氧化應激是指體內氧化與抗氧化作用失衡,傾向于氧化,是由自由基包括HO·和NO等在體內產生的一種負面作用。與MCs在其他動植物中產生損害的結果相似[26-27],在本研究中,HO·和NO的水平在MC-LR暴露期間均增加,并且大多呈現劑量依賴型上升方式。然而,T-AOC水平在暴露早期升高,隨著暴露時間的延長而降低,尤其在較高濃度組更為明顯。這表明,暴露早期羅氏沼蝦在進行著積極的抗氧化反應,但隨著暴露時間延長,氧化機體的抗氧化能力逐漸減弱,這與本研究中肝胰腺組織損傷不斷加重的結果一致。
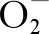
綜上,本研究結果表明,較高的環境相關濃度的MCs(5 μg·L-1)會在羅氏沼蝦肝胰腺中顯著富集,誘導氧化應激,破壞肝胰腺的形態和結構,并且破壞作用隨暴露時間延長而加劇,組織發生細胞凋亡。較低的環境相關濃度的MCs(0.5 μg·L-1)對肝胰腺的影響相對較小,但是依然會誘導羅氏沼蝦肝胰腺氧化應激,并且長時間作用下也會給肝胰腺組織結構帶來損傷。

