超聲輔助制備金烏賊墨黑色素及其對Caco-2細胞氧化損傷的保護作用
張景禹 解萬翠,2,3,4 車紅霞,2 楊錫洪,2
(1. 青島科技大學海洋科學與生物工程學院,山東 青島 266042;2. 山東省生化工程重點實驗室,山東 青島 266042;3. 青島智科檢驗檢測有限公司,山東 青島 266002;4. 尚好科技有限公司,山東 青島 266002)
金烏賊(Sepiaesculenta)墨黑色素是天然色素的重要來源,是一種高度聚合的生物大分子,存在于墨囊中,是烏賊在防御和躲避危險時噴出墨汁的主要成分,具有光保護作用[1]、抗氧化作用[2]、清除自由基[3]、金屬離子螯合作用[4]、抗炎作用[5]等功能。目前,黑色素在調節免疫低下[6]、保護糖尿病腎病對腎臟損傷[7]、治療侵襲性肺曲霉病[8]、保護急性酒精肝損傷[9]等方面具有良好的效果。
研究表明,氧化應激與糖尿病[10]、阿爾茨海默病[11]和腸道炎癥[12]等慢性疾病密切相關。氧化應激可使自由基、活性代謝物(ROS)和保護機制(抗氧化劑)之間失衡[13],損傷重要的生物分子和細胞,導致疾病。
關于墨黑色素抗氧化能力的研究多為化學法[14-16],而在細胞水平上的功效研究鮮有報道。已有的報道[17]僅通過測定細胞增殖活性探究墨黑色素對細胞的影響,無法反應細胞內指標的變化。化學法只能簡單測定抗氧化劑的抗氧化能力,不能真實模擬或反映機體內部生理環境,不能有效評價其抗氧化活性與藥理作用的關系。相比于水洗、酶解、酸堿等提取法,Guo等[18]通過超聲輔助方法制備可溶性黑色素,說明超聲法在改善黑色素溶解性方面具有很好的效果。試驗擬以金烏賊為原料,采用超聲輔助法提取制備黑色素,并利用叔丁基過氧化氫誘導Caco-2細胞建立氧化應激損傷模型,同時將不同濃度的黑色素溶液加入細胞中進行提前干預,研究金烏賊墨黑色素在Caco-2細胞氧化應激損傷中的保護作用,為黑色素作為一種食補或者營養性的外源抗氧化劑的開發和利用提供依據。
1 材料與方法
1.1 材料和儀器
1.1.1 材料與試劑
冷凍金烏賊:山東青島航海客公司;
人克隆結腸腺癌細胞Caco-2細胞:美國典型培養物保藏中心;
高糖DMEM細胞培養液:美國Hyclone公司;
胎牛血清:上海依科賽生物制品有限公司;
叔丁基過氧化氫(TBHP):美國Sigma公司;
四甲基偶氮唑藍(MTT)細胞增殖及細胞毒性檢測試劑盒、BCA法總蛋白定量測定試劑盒、超氧化物歧化酶SOD測定試劑盒、丙二醛MDA測定試劑盒:南京建成生物工程研究所;
其余試劑均為國產分析純。
1.1.2 主要儀器設備
超聲波細胞破碎儀:JY92-IIN型,寧波新芝生物科技股份有限公司;
紫外分光光度計:UV-1800PC型,上海翱藝有限公司;
冷凍離心機:Happy-TL18型,山東濟南福的機械有限公司;
真空冷凍干燥機:FD-1A-50型,北京博醫康實驗儀器有限公司;
傅里葉紅外光譜儀:Nicolet iS10型,賽默飛世爾科技有限公司;
掃描電子顯微鏡:JSM-6700F型,日本電子公司;
酶標儀:BIO-RAD680型,美國伯樂生命醫學產品有限公司;
二氧化碳細胞培養箱:MCO-15AC型,日本三洋公司。
1.2 方法
1.2.1 超聲輔助提取及制備墨黑色素 參考Guo等[19]的方法并略作修改。取0.5 g干燥的黑色素樣品,溶于100 mL NaOH溶液(1 mol/L)中。超聲細胞破碎儀振幅80%,溫度上限30 ℃,超聲1 s,間歇1 s,總作用時間1 h,冷卻,加入1 mol/L HCl調節pH值,8 000 r/min離心15 min,取上清液,真空冷凍干燥,得黑色素樣品。
1.2.2 紫外—可見光光譜和FT-IR光譜 將黑色素樣品充分溶解,配置成10 mg/L的溶液,使用紫外—可見光分光光度計在200~700 nm范圍內掃描。稱取0.5 mg黑色素樣品,與KBr均勻混合并壓制成片劑,使用傅立葉變換紅外光譜儀在4 000~400 cm-1范圍內掃描。
1.2.3 掃描電子顯微鏡和粒徑統計 黑色素樣品于真空噴金,通過掃描電子顯微鏡掃描圖像,掃描電壓5.0 kV/10 kV,工作距離8.4~8.8 mm。使用Nano meterer 1.2軟件對黑色素粒徑分布進行統計分析。
1.2.4 Caco-2細胞培養 在含有Caco-2細胞的培養瓶中加入含10%的胎牛血清(經熱滅活處理)和雙抗(100 U/mL青霉素和100 μg/mL鏈霉素)的高糖DMEM細胞培養液,于37 ℃,5% CO2培養箱中培養,每天更換一次培養液。待細胞貼壁生長為單層后,對其進行消化傳代。
1.2.5 黑色素對Caco-2細胞存活率影響 取對數生長期的Caco-2細胞,以密度5×104Cells/mL接種至96孔板,每孔加入100 μL細胞懸液,置于培養箱中培養。待細胞貼壁后開始試驗。試驗組每孔加入200 μL樣品溶液,黑色素最終濃度分別為5,20,40,60,80,100 μg/mL,每個濃度設置4個復孔,同時設置對照組,對照組為正常細胞組。繼續培養24 h后,采用MTT法[19]檢測,并按式(1)計算Caco-2細胞存活率。
(1)
式中:
C——Caco-2細胞存活率,%;
A1——黑色素干預組的吸光度;
A0——空白組吸光度;
A3——黑色素溶液吸光度;
A2——對照組吸光度。
1.2.6 TBHP誘導Caco-2細胞氧化損傷模型建立 取對數生長期的Caco-2細胞,以密度5×104Cells/mL接種至96孔板,每孔加入100 μL細胞懸液,于37 ℃,5% CO2培養箱中培養。待細胞貼壁后開始試驗。細胞貼壁后孵育不同濃度梯度的TBHP(0,50,100,200,300,400 μmol/L),孵育時間4 h,MTT法檢測細胞存活率,選擇半抑制濃度(IC50)為后續試驗作用劑量。
1.2.7 不同濃度黑色素溶液對Caco-2細胞氧化損傷的影響 細胞布板同1.2.6,細胞貼壁后分別加入5,20,40,60,80,100 μg/mL的黑色素溶液,每孔200 μL,每組5個復孔。孵育24 h后棄去上清,加入TBHP損傷4 h,MTT法檢測細胞存活率。
1.2.8 細胞中SOD活性和MDA含量的測定 將Caco-2細胞以密度5×105Cells/mL接種至6孔板中。經不同濃度黑色素溶液和TBHP處理后,用PBS洗滌細胞兩次,從平板上刮入到冷PBS中,采用超聲波細胞破碎儀進行均質化。將勻漿液于4 ℃,5 000 r/min離心20 min,收集上清液。通過BCA分析試劑盒測定上清液樣品中的蛋白質濃度,按測定試劑盒說明書進行SOD、MDA測定[20]。
1.2.9 統計學分析 所有試驗重復3次,結果以(平均值±標準偏差)表示。使用SPSS 18.0和GraphPad Prism 8軟件分析,采用T檢驗法對試驗組和模型組進行統計分析和數據處理,ns表示差異無顯著性,*表示P<0.05,**表示P<0.01;采用T檢驗法對模型組和對照組進行統計分析,##表示P<0.01;采用單因素方差分析(ANOVA)進行試驗組內比較,字母不同表示組間差異顯著(P<0.05)。
2 結果與分析
2.1 紫外—可見光光譜和FT-IR光譜
由圖1可知,金烏賊墨黑色素在215 nm處有一個最大吸收峰,并且隨波長的增加吸光度逐漸降低。這是由于黑色素分子中含有復雜的共軛結構,因此寬光譜范圍內的強吸收和隨波長逐漸降低是黑色素的典型特性[21]。此外,260,280 nm處均未觀察到吸收峰,表明諸如蛋白質和脂質的雜質含量少。
由圖2可知,3 420 cm-1處的強而寬的譜帶為—OH和—NH拉伸振動;2 926,2 852 cm-1處的小峰和尖峰分別對應于CH3、CH2的拉伸振動;1 620 cm-1處的強吸收峰對應芳族C═C和C═O基團的拉伸振動;1 372 cm-1處的吸收峰歸屬于酚O—H基團的O—H變形和C—O拉伸;800~600 cm-1處的弱吸收峰表明芳香環的某些位置已被取代形成低芳族氫含量的共軛體系,與報道的真黑色素標準品[22]和天然魷魚黑色素[18]高度一致。其中,3 420,1 620 cm-1處的吸收峰被認為是黑色素的代表特征,說明超聲輔助提取的黑色素保留了黑色素特征基團和吲哚結構。

圖1 黑色素紫外—可見光譜圖
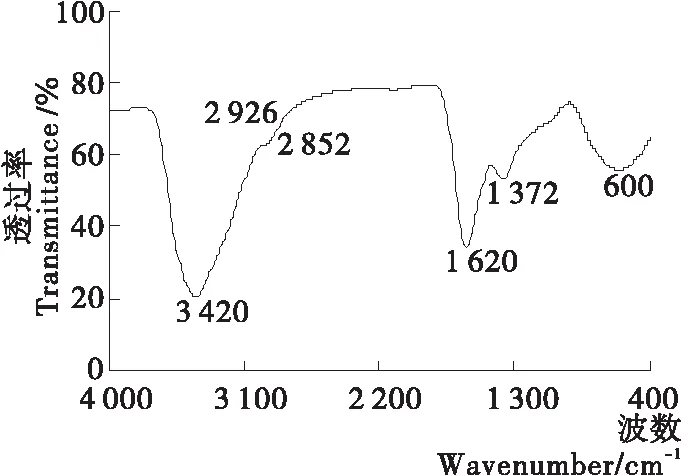
圖2 黑色素FT-IR光譜圖
2.2 掃描電子顯微鏡及粒徑統計
由圖3可知,金烏賊墨黑色素呈納球狀,具有不同的粒徑,主要分布于80~210 nm的范圍內,顆粒表面輕微的凸起。黑色素單體顆粒并不代表保持其功能的最小基本單位,而只是代表一種擴展的聚集[23]。超聲破碎后,黑色素部分顆粒發生形變,圓形顆粒的物理結構遭到一定程度地破壞,使黑色素產生了更小顆粒并釋放更多的活性基團[18]。
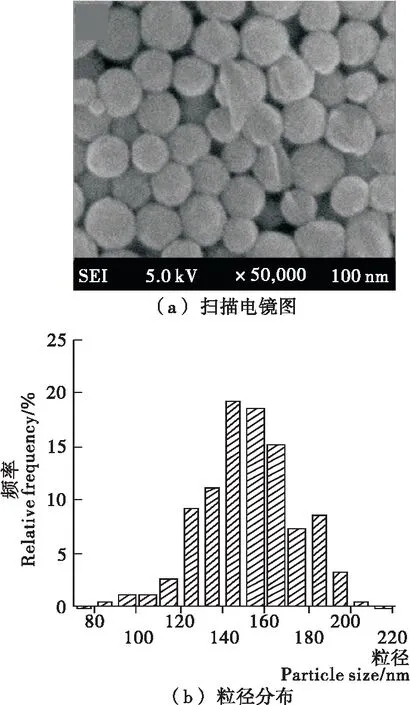
圖3 黑色素的顯微結構
2.3 黑色素對Caco-2細胞存活率的影響
由圖4可知,黑色素組的細胞存活率高于正常組,表明金烏賊墨黑色素對Caco-2細胞沒有毒性,還可在一定程度上促進細胞的生長和增殖。雷敏[17]研究發現不同分子量的水溶性魷魚墨黑色素在48 h內顯著地促進了內皮細胞的增殖。楊亞杰等[24]研究發現烏骨雞黑色素對細胞增殖無影響。當濃度為5~100 μg/mL時,金烏賊墨黑色素干預Caco-2細胞24 h未發現毒性作用,可在此條件下進行后續試驗。

圖4 黑色素對Caco-2細胞存活率的影響
2.4 TBHP誘導Caco-2細胞氧化損傷模型的建立
由圖5可知,當叔丁基過氧化氫濃度為0~400 μmol/L時,細胞存活率逐漸下降。當叔丁基過氧化氫濃度為300~400 μmol/L時,細胞存活率緩慢降低。當叔丁基過氧化氫濃度為400 μmol/L時,細胞存活率最低(10%),細胞嚴重受損,此時叔丁基過氧化氫細胞損傷的IC50值為146.2 μmol/L。故后續采用150 μmol/L的叔丁基過氧化氫建立Caco-2細胞損傷。

圖5 TBHP對Caco-2細胞存活率的影響
2.5 不同濃度黑色素溶液對Caco-2細胞氧化損傷的影響
由圖6可知,叔丁基過氧化氫組的細胞存活率為59%,顯著低于正常組(P<0.05),說明采用150 μmol/L叔丁基過氧化氫能成功建立細胞損傷模型。黑色素組的細胞存活率均高于叔丁基過氧化氫組,且差異顯著(P<0.05)。其中,黑色素濃度為60 μg/mL的存活率與黑色素濃度為5,20,80 μg/mL的差異顯著,而與黑色素濃度為100 μg/mL的無統計學意義(P>0.05)。綜上,金烏賊墨黑色素具有保護Caco-2細胞免受氧化應激誘導損傷的能力。

圖6 黑色素濃度對Caco-2細胞氧化損傷的影響
2.6 細胞中SOD活性和MDA含量的測定
由圖7可知,叔丁基過氧化氫能顯著提升Caco-2細胞中MDA含量(P<0.05);經40,60,80,100 μg/mL黑色素提前干預后,受損細胞中MDA含量下降,且與模型組差異顯著(P<0.05)。而黑色素組間MDA含量差異無統計學意義(P>0.05)。當黑色素濃度為60 μg/mL時,Caco-2細胞中MDA含量為0.933 nmol/mg·Pro,為模型組的60%。經叔丁基過氧化氫氧化損傷的Caco-2細胞中SOD酶活性顯著降低(P<0.05);而經40,60,80,100 μg/mL黑色素干預后,細胞中的SOD酶活顯著升高(P<0.05),其中,黑色素濃度為60 μg/mL的細胞中SOD酶活為39.37 U/mg·Pro,為叔丁基過氧化氫模型組的1.86倍。綜上,黑色素可以通過降低細胞內不飽和脂肪酸發生過氧化反應所產生的氧化產物來降低細胞氧化損傷的程度;同時提高細胞中抗氧化物酶的活性,從而降低細胞氧化應激損傷水平。黑色素對細胞氧化損傷的保護機制可能與其他天然活性物質并不相同,但都可通過提高細胞內源性抗氧化物酶活性、降低自由基對細胞損傷來提高細胞的存活率[25]。
3 結論
以叔丁基過氧化氫誘導人克隆結腸腺癌Caco-2細胞建立氧化損傷模型,研究了金烏賊墨黑色素對Caco-2細胞氧化應激損傷的保護作用。結果表明,金烏賊墨黑色素可以通過提高Caco-2細胞中超氧化物歧化酶SOD活性和降低丙二醛MDA含量,清除過量的活性氧自由基和減少脂質過氧化程度來保護細胞免受氧化應激損傷。由于細胞氧化應激損傷的復雜性,烏賊墨黑色素的抗氧化應激損傷分子機制還需進一步研究。
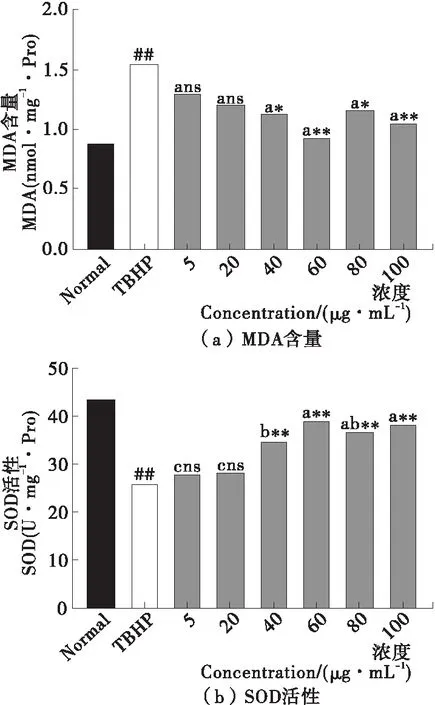
圖7 黑色素對叔丁基過氧化氫誘導Caco-2細胞中MDA含量和SOD活性的影響
Figure 7 Effect of melanin on MDA content and SOD activity in Caco-2 cells induced by TBHP

