大豆分離蛋白與單糖、雙糖、多糖共價復合物的凍融特性及結構表征
王玉瑩,張安琪,周國衛,王 琳,王喜波*
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
大豆分離蛋白(soybean protein isolate,SPI)為蛋白質質量分數在90%以上[1],富含有多種必需氨基酸和不飽和脂肪酸的優質蛋白[2],是少數可與動物蛋白比擬的植物蛋白,由于其具有表面活性而常被用作乳化劑,但是蛋白質的乳化特性會受到外界因素的影響,當溫度降低時,水相會形成尖銳冰晶會刺破油水界面膜,使乳液呈現失穩狀態。
蛋白質改性是改善蛋白質的結構和功能性質的有效方法[3],化學改性由于顯著效果常用作蛋白質改性,如糖基化、脫酸胺化、磷酸化、羧甲基化、共價交聯等[4]。其中,糖基化改性僅通過加熱不需要催化劑就能提高蛋白質的穩定性,是一種理想的改性蛋白質的方法[5]。竇超然等[6]制備的凍融穩定型糖基化SPI乳液的分層系數和出油率顯著降低。孫洪蕊等[7]發現濕法糖基化能夠制備抗凍融SPI復合物。Zhang Zeyu等[8]利用超聲輔助提高了大豆蛋白凍融性質,明顯降低了凍融循環后乳析指數(creaming index,CI)和粒徑。Yu Jie等[9]利用酶改性獲得不同水解度的SPI水解物,觀察發現酶改性后的乳液在3 次凍融循環后蛋白沒有明顯的沉淀絮凝現象。Zang Xiaodan等[10]通過木瓜蛋白酶和植酸酶處理修飾的SPI可以顯著提高冷凍的穩定性,并能承受多種環境因素。Chen Yebao等[11]揭示了經熱誘導后,SPI納米顆粒形成穩定Pickering乳液的凍融穩定性的重要性。
綜上,目前關于SPI與多糖共價復合物凍融性質的研究較多,但對SPI與單糖和雙糖共價復合物凍融性質研究鮮有報道。本實驗在前人研究的基礎上,比較分析SPI與單糖、雙糖、多糖共價復合物在凍融循環后的功能穩定性并優化出最佳反應條件,以期尋求制備凍融穩定型糖基化SPI的最佳工藝為冷凍產品提供新的技術思路。
1 材料與方法
1.1 材料與試劑
葡萄糖(glucose,G) 上海國藥集團化學試劑有限公司;麥芽糖(maltose,M) 北京化學試劑廠;葡聚糖(dextran,D) 國藥集團化學試劑有限公司;九三大豆油 市售;其他試劑均為分析純。
1.2 儀器與設備
FJ200高速分散均質機 上海滬析實業有限公司;AVP-1000型高壓均質機 德國APV公司;F-2700熒光分光光度計 上海棱光技術有限公司;TU-1800型紫外-可見分光光度計 上海菁華分析儀器公司;Nicolet is5傅里葉變換紅外光譜儀 上海力晶科學儀器有限公司;Mr-90恒溫磁力攪拌器 華北試驗儀器廠;MS104TS分析天平上海右一儀器有限公司;FDU-1200冷凍干燥機 深圳市科力易翔儀器設備有限公司;數顯型恒溫水浴鍋上海碩光電子科技有限公司。
1.3 方法
1.3.1 SPI提取
參考Sorgentini等[12]采用堿溶酸沉法提取,凱氏定氮法測定SPI蛋白質量分數為90.23%。
1.3.2 糖基化SPI的制備
將SPI分別與G、M、D按一定質量比(1∶1、2∶1、3∶1、4∶1、5∶1)溶解于0.01 mol/L pH 7.0磷酸鹽緩沖液,配成一定蛋白質量分數(2%、3%、4%、5%、6%)的溶液,室溫攪拌4 h后,加入微量疊氮化鈉防止滋生微生物并于4 ℃冰箱中過夜。取不同樣品溶液于水浴鍋(60、70、80、90、100 ℃)反應(1、2、3、4、5 h),反應結束后,樣品置于冰水浴冷卻10 min使反應停止,然后樣品在2 000 r/min離心20 min,取上清液于蒸餾水中透析24 h,冷凍干燥備用。共價復合物分別為SPI-G、SPI-M、SPI-D。
1.3.3 乳化性測定
參考Perace等[13]方法,略有改進。用0.1 mol/L pH 7.0的磷酸鹽緩沖溶液溶解樣品,取30 mL樣品和10 mL大豆油混合,置于高速乳化機,在11 000 r/min均質1 min以形成乳濁液,分別在0 min與10 min從底部吸取100 μL加入10 mL(0.1%)SDS中,于500 nm波長處測定吸光度,以0.1% SDS溶液為空白。乳化活性指數(emulsifying activity index,EAI)和乳化穩定性指數(emulsifying stability index,ESI)計算公式如下:
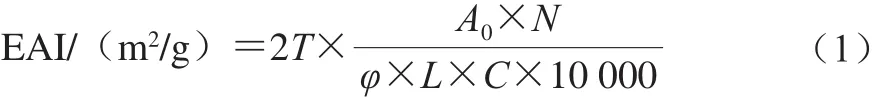
式中:T為2.303;A0為第0分鐘時的吸光度;N為稀釋倍數(100);φ為體系中油相所占的體積分數(0.25);C為蛋白質質量濃度/(g/mL);L為比色池光徑(1 cm)。

式中:A0為第0分鐘時的吸光度;A10為第10分鐘時的吸光度;?T為時間差10 min。
1.3.4 高壓均質制備乳液工藝
用磷酸鹽緩沖溶液(10 mmol/L,pH 7.0)溶解樣品SPI-G、SPI-M、SPI-D,并加入體積分數10%~30%的大豆油,置于高速乳化機,在11 000 r/min處理3 min形成粗乳液,然后高壓均質(60 MPa)處理得微乳液。加入0.02%的疊氮化鈉,防止微生物污染。
1.3.5 凍融處理
將新制備的樣品乳液20 mL轉移到具塞試管內,-20 ℃冰箱中冷凍儲存22 h,取出后于20 ℃水浴解凍2 h[14],取部分樣品進行凍融穩定性分析,如此循環3 次凍融。
1.3.6 CI測定
經凍融處理后乳液分層。用刻度尺量取底部透明或渾濁的乳清層高度與乳液總高度,乳液的凍融性質CI表示[15]。CI計算如式(3)所示:

式中:HS為乳清層高度/cm;HT為乳液總高度/cm。
1.3.7 出油率測定
參考Palanuwech等[16]方法,略有改進。將1 000 g大豆油與0.015 g蘇丹III充分混合,蘇丹III油溶液與乳液按質量比4∶1精確放入離心管內混勻,10 000 r/min離心20 min后于508 nm波長處測吸光度,以大豆油為空白。出油率計算如式(4)所示:

式中:φ為出油率/%;m0為蘇丹III油溶液質量;me為乳液質量;a為蘇丹III油溶液吸光度與離心后蘇丹III油溶液吸光度的比值;φd為乳液中油相的質量分數/%。
1.3.8 接枝度測定
將樣品SPI-G、SPI-M、SPI-D配制成4 mg/mL的樣品溶液,取200 μL樣品溶液加入到4 mL鄰苯二甲醛溶劑[17],混勻后于35 ℃水浴中保溫反應2 min,以鄰苯二甲醛溶劑試劑作空白,在340 nm紫外波長處測定吸光度,接枝度計算如式(5)所示:

式中:DG為接枝度/%;A0為接枝反應前吸光度;A1為接枝反應后吸光度。
1.3.9 傅里葉變換紅外光譜測定
取適量冷凍干燥后的樣品與一定量溴化鉀混合,研磨成粉末后壓成薄片,設置分辨率為4 cm-1,掃描次數32 次,隨后用傅里葉變換紅外光譜儀進行全波段(4 000~400 cm-1)掃描[18]。
1.3.10 熒光光譜測定
用磷酸鹽緩沖溶液(10 mmol/L,pH 7.0)將樣品SPI-G、SPI-M、SPI-D配制成蛋白質質量分數為0.5%的樣品溶液,設置激發波長347 nm,發射波長掃描范圍375~550 nm[19]。然后用0.01 mol/L pH 7.0磷酸鹽緩沖液稀釋20 倍使其質量分數為0.025%,設置激發波長290 nm,發射波長掃描范圍300~400 nm。激發和發射的狹縫均為5.0 nm,掃描速率240 nm/min[20]。
1.4 數據處理
2 結果與分析
2.1 共價復合物制備工藝優化
2.1.1 反應溫度對反應產物凍融穩定性的影響
在SPI與糖的質量比2∶1、反應時間3 h、蛋白質量分數4%條件下,研究反應溫度對SPI-G、SPI-M、SPI-D乳化性和1、2、3 次凍融循環后CI的影響。
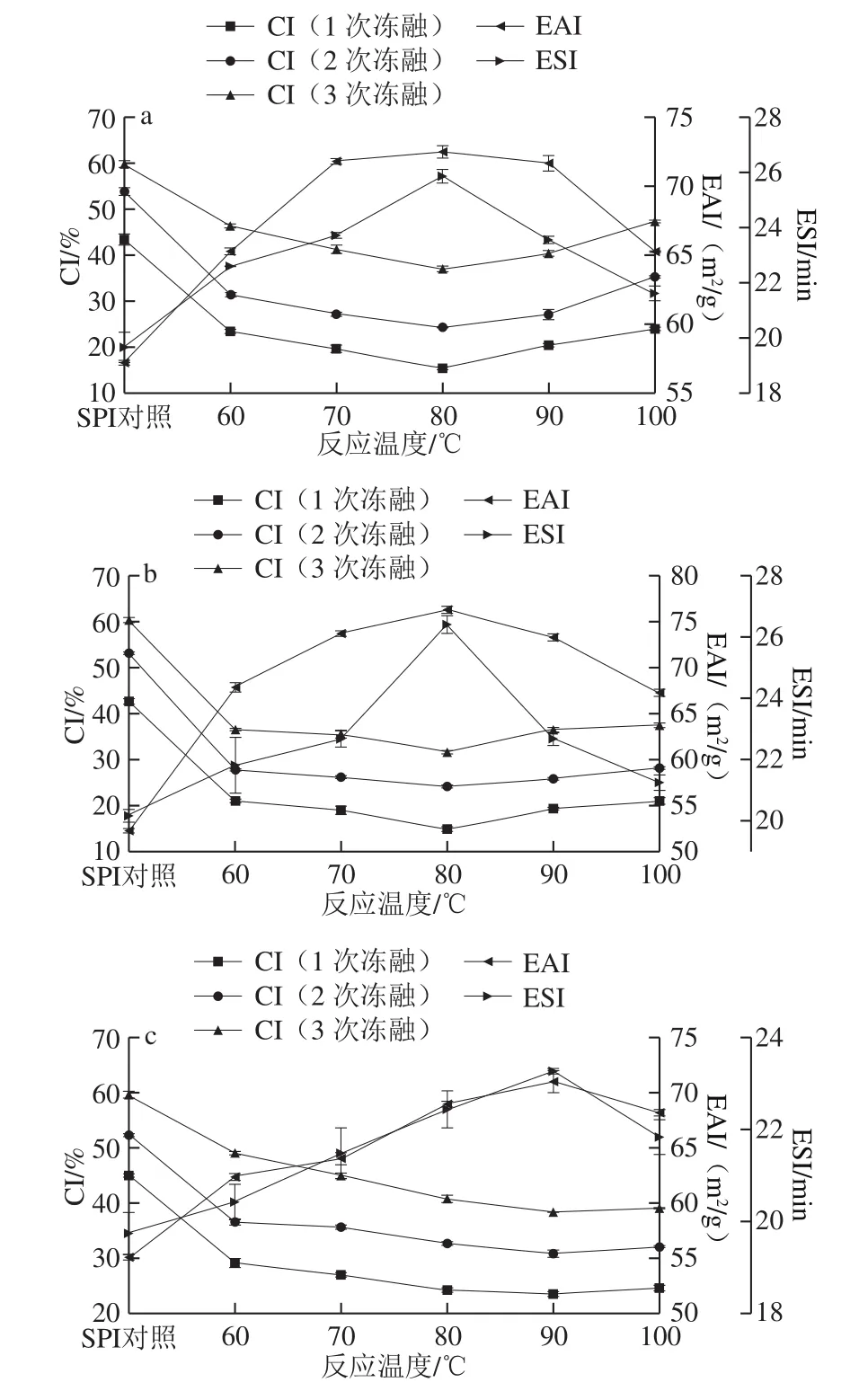
圖1 反應溫度對SPI-G(a)、SPI-M(b)、SPI-D(c)乳化性和CI的影響Fig. 1 Effect of reaction temperature on the emulsifying activity and creaming index of SPI-G (a), SPI-M (b), and SPI-D (c)
研究表明,溫度能夠提高美拉德反應速率,加快反應進程[21]。乳化性是蛋白質作為功能性食品配料應用于冷凍食品中的一項重要的功能性質[22],從圖1a、b可知,EAI和ESI都隨著溫度的升高而上升,并均在80 ℃達到最大。從圖1c可知,SPI-D的EAI和ESI也呈增大趨勢,并在90 ℃達到最大。這是因為在一定范圍內增加溫度,蛋白質的肽鏈展開,增加了游離氨基數量,進而提高了與糖的結合幾率,增加反應效率。但隨著溫度進一步升高,乳化性顯著降低,可能是因為加熱溫度過高,蛋白質嚴重變性[23]。CI是表明乳液凍融穩定性的一個重要指標,CI越低,乳液狀態越穩定[24]。如圖1所示,溫度逐漸升高,CI先減小后增大。SPI-G和SPI-M在80 ℃顯示了最低的CI,SPI-D在90 ℃顯示了最低的CI,但與80 ℃時的CI相差不大。這是因為溫度升高,促進接枝反應,糖包裹了蛋白形成立體網絡,提高了接枝物對外界環境的抵抗力[25]。綜合比較,SPI-M的乳化性升高幅度和CI降低程度,均高于SPI-G和SPI-D。這可能是由于糖的分子結構有所不同,形成不同的空間位阻。考慮到反應溫度過高時蛋白質會變性,選擇80 ℃作為反應溫度進行后續研究。
2.1.2 反應時間對反應產物凍融穩定性的影響
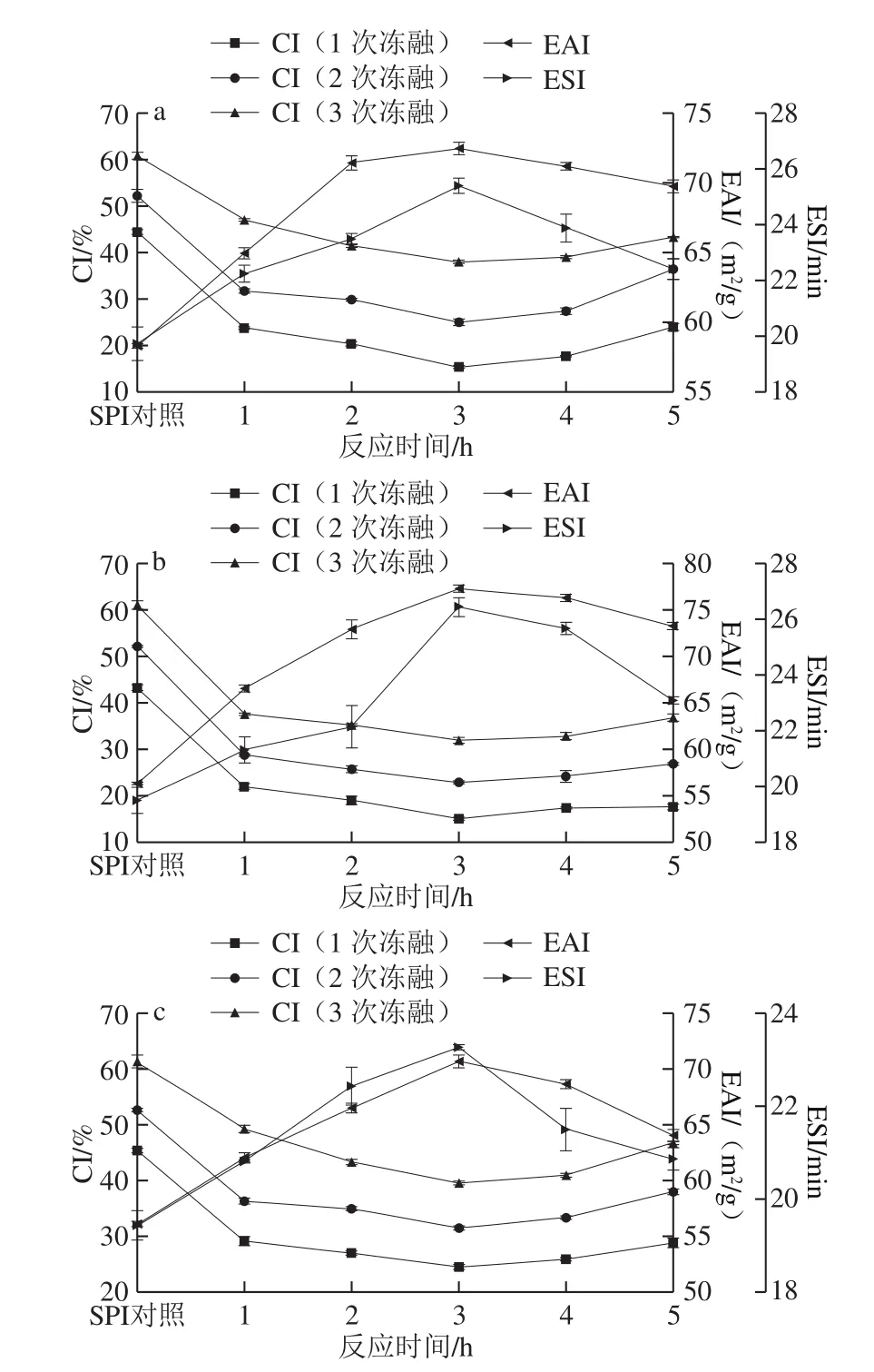
圖2 反應時間對SPI-G(a)、SPI-M(b)、SPI-D(c)乳化性和CI的影響Fig. 2 Effect of reaction time on the emulsifying activity and creaming index of SPI-G (a), SPI-M (b), and SPI-D (c)
在SPI與糖的質量比2∶1、反應溫度80 ℃、蛋白質量分數4%條件下研究反應時間對SPI-G、SPI-M、SPI-D乳化性和1、2、3 次凍融循環后CI的影響。
由圖2可知,隨著反應時間的延長SPI-G、SPI-M、SPI-D的EAI和ESI均呈現先上升后下降的趨勢,反應時間為3 h時最大。可能是因為反應時間延長,使得維持蛋白質結構的次級鍵被破壞,肽鏈變得疏松,SPI的溶解度增加,促進了接枝反應,增加了SPI的表面活性[26]。而反應時間過長,暴露更多疏水基團,促使蛋白質重新聚集,使接枝物的EAI和ESI降低。如圖2所示,CI隨加熱時間的延長,逐漸降低而又上升,同樣是在反應3 h表現出最好的凍融性質,可能是因為加熱時間過長,糖過度引入,疏水基團增多,蛋白質聚集,失去親水親油平衡,破壞穩定的界面膜,使接枝物的CI降低[27]。綜合來看,SPI-M的凍融性質均好于SPI-G和SPI-D。結合考慮能源損耗,最終選擇反應時間3 h進行后續研究。
2.1.3 蛋白質量分數對反應產物凍融穩定性的影響

圖3 蛋白質量分數對SPI-G(a)、SPI-M(b)、SPI-D(c)乳化性和CI的影響Fig. 3 Effect of protein concentration on the emulsifying activity and creaming index of SPI-G (a), SPI-M (b), and SPI-D (c)
在SPI與糖的質量比2∶1、反應時間3 h、反應溫度80 ℃條件下研究蛋白質量分數對SPI-G、SPI-M、SPI-D乳化性和1、2、3 次凍融循環后CI的影響。
由圖3可知,隨著蛋白質量分數的增大,接枝物的EAI和ESI同樣出現先升高又下降的趨勢,在蛋白質量分數達4%時,SPI-G、SPI-M、SPI-D的乳化性最優,其中SPI-M乳化性最好。可能是因為SPI濃度的上升提高了蛋白質分子與糖分子的碰撞機會,促進美拉德反應的發生,提高了乳化性,但隨著蛋白質量分數的進一步提高,導致溶液黏度增大、流動緩慢,進而阻礙了接枝反應的發生[7]。SPI-G、SPI-M、SPI-D接枝物的CI均隨蛋白質量分數的增加而呈現先下降后上升的趨勢,并在4%時凍融性質最佳,SPI-M的下降幅度最大。可能是因為蛋白質量分數越大,反應效率越高,但蛋白質量分數過大,蛋白與糖的空間位阻變大,降低碰撞幾率,不利于接枝反應的發生進而使乳液的凍融穩定性下降[28]。考慮到反應程度及經濟問題,選擇蛋白質量分數4%進行后續研究。
2.1.4 SPI與糖質量比對反應產物凍融穩定性的影響
在反應溫度80 ℃、反應時間3 h、蛋白質量分數4%條件下研究SPI與糖質量比對SPI-G、SPI-M、SPI-D乳化性和1、2、3 次凍融循環后CI的影響。
SPI和糖的美拉德反應是基團之間特定的交聯反應,一定的比例不僅可以提高反應的進程,而且能降低副反應的發生[7]。由圖4a、b可知,在蛋白質量分數一定的情況下,隨著G、M比例的減少,接枝物的EAI呈明顯上升趨勢,ESI與EAI變化趨勢基本一致,這是因為引入適量的糖,親水基團的增多使產物的極性增加,繼而提高溶解性,增加界面活性,所以提高了產物的乳化活性[29]。但隨著糖比例進一步降低,蛋白質與糖接枝物的乳化性逐步降低。由圖4c可知,D的添加會提高SPI-D的乳化性,僅質量比1∶1時有明顯變化,隨糖的比例減少,下降趨勢明顯,這是因為D分子質量大,遷移速率緩慢,醛基濃度太低,較少的糖不足以與蛋白充分發生反應。雖然接枝物的乳化性都有提高,但SPI-G、SPI-D的升高幅度遠小于SPI-M,這可能是由于G、M、D內部結構不同,M更易于與SPI結合。圖4中接枝物的CI均隨著糖的引入而呈現降低的趨勢,這是因為糖有增稠作用,增加了乳液中未凍結水的含量,提高了水相的黏度,增強了膜的厚度,降低了對外界環境的敏感度進而提高產物凍融穩定性[22],但仍是SPI-M在SPI與糖質量比4∶1表現出最好的凍融性質。考慮到改性應當以SPI為主體并分析考慮了乳化性、CI及經濟問題,選取SPI-G、SPI-M、SPI-D分別在SPI與糖質量比3∶1、4∶1、1∶1為最佳反應參數。

圖4 SPI與糖質量比對SPI-G(a)、SPI-M(b)、SPI-D(c)乳化性和CI的影響Fig. 4 Effect of mass ratio between SPI and sugar on the emulsifying activity and creaming index of SPI-G (a), SPI-M (b), and SPI-D (c)
2.2 共價復合物的性質分析
不同改性產物制備的最佳單因素組合條件:SPI-G的制備條件為反應溫度80 ℃、反應時間3 h、蛋白質量分數4%、SPI與G質量比3∶1;SPI-M的制備條件為反應溫度80 ℃、反應時間3 h、蛋白質量分數4%、SPI與M質量比4∶1;SPI-D的制備條件為反應溫度90 ℃、反應時間3 h、蛋白質量分數4%、SPI與D質量比1∶1。在此條件下平行實驗同時設對照組。
2.2.1 美拉德反應產物的出油率分析
乳液凍融后的不穩定作用使部分脂肪游離,通過出油率可以測定乳液的穩定性,出油率越低,乳液越穩定[30]。由圖5可知,隨著凍融次數的增加,SPI的出油率急劇增加。接入糖之后出油率顯著下降,可能是因為糖的加入,使溶液得極性增加,靜電斥力變大,減少了脂肪的聚集。經過3 次凍融循環后,與SPI相比,SPI-G的出油率分別降低了4%、16%、22%;SPI-M的出油率分別降低了4.8%、16.8%、22.6%;SPI-D的出油率分別降低了2%、12%、17%。優化后的產物乳化性能較好,但仍是SPI-M比SPI-G和SPI-D穩定,說明優化的反應參數能夠提高改性產物的凍融穩定性。

圖5 SPI及SPI-G、SPI-M、SPI-D凍融循環3 次的出油率Fig. 5 Oiling off of SPI, SPI-G, SPI-M, and SPI-D after one, two and three freeze-thaw cycles
2.2.2 共價復合物的接枝度分析

圖6 SPI-G、SPI-M、SPI-D的接枝度Fig. 6 Degrees of grafting of SPI-G, SPI-M, and SPI-D
對于蛋白,接枝表示在氨基側鏈的活性基團引入糖分子的側鏈,使復合物表現出糖的親水特性,水溶性增加,一定程度上改善了蛋白質的功能特性[31]。SPI與糖形成共價復合物的比率通過接枝度體現。由圖6可知,SPI-M的接枝度明顯高于SPI-G和SPI-D的接枝度,SPI-G和SPI-D的接枝度分別為24.23%和17.5%,而SPI-M的接枝度最高,達到27.2%。可能是因為不同種類的糖結構不同,而M更易與SPI發生反應。
2.2.3 共價復合物的傅里葉變換紅外光譜分析
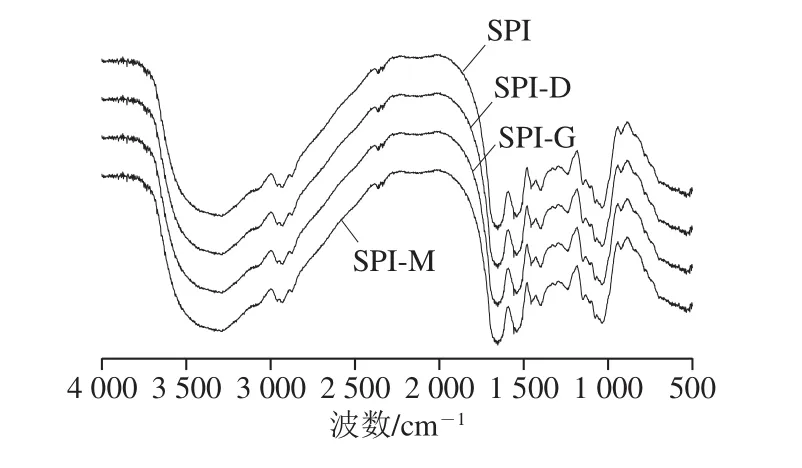
圖7 SPI及SPI-G、SPI-M、SPI-D傅里葉變換紅外光譜圖Fig. 7 Fourier transform infrared spectra of SPI and SPI-G,SPI-M, and SPI-D
大豆蛋白與糖的共價復合改性是將糖分子以共價鍵的形式接入到SPI分子中,其特征是羥基的引入[26],在傅里葉變換紅外掃描特征吸收上體現為在波數為3 700~3 200 cm-1處有一個較寬的伸縮振動峰,CO鍵在波數1 260~1 000 cm-1處也出現較強的振動[32-33]。由圖7可知,復合物SPI-G、SPI-M、SPI-D均在3 700~3 200 cm-1處的吸收峰變寬,說明美拉德反應發生后,羥基數量增加,引起了振動吸收。同時反應產物在1 260~1 000 cm-1處吸收峰明顯增強,表明C—N數量增加。并且SPI-G、SPI-M、SPI-D的吸收振動均強于SPI,其中SPI-M相較于SPI-G和SPI-D復合物,具有更強的吸收振動。蛋白質的二級結構影響蛋白質分子構象的穩定性,由表1可知,反應產物與SPI相比,α-螺旋含量減少,β-轉角含量增加,說明蛋白質從有序向為無序狀態轉變,提高了分子的柔性,其中SPI-M的二級結構改變最大,SPI-D的二級結構改變最小。綜上,證明了SPI與糖是以共價鍵的方式結合發生美拉德反應,改善了復合物的凍融穩定性。

表1 SPI及SPI-G、SPI-M、SPI-D二級結構含量Table 1Secondary structure contents of SPI and SPI-G, SPI-M, and SPI-D%
2.2.4 共價復合物的熒光強度分析

圖8 SPI及SPI-G、SPI-M、SPI-D在激發波長347 nm(a)和290 nm(b)的熒光光譜圖Fig. 8 Fluorescence spectra of SPI and SPI-G, SPI-M, and SPI-D at excitation wavelengths of 347 nm (a) and 290 nm (b)
美拉德反應特征熒光物質的典型熒光光譜為激發波長在320~370 nm處時,發射波長在420~440 nm范圍內有最大的熒光強度[34]。如圖8a所示,激發波長為347 nm進行掃描,SPI在451.6 nm波長處有最大熒光強度,而SPI-G、SPI-M、SPI-D復合物分別在431.6、429.6 nm和433.6 nm波長處有最大熒光強度,λmax向短波長方向移動,發生了藍移,并且復合物的熒光強度均高于SPI,表明發生了美拉德反應。色氨酸主要影響SPI的內源熒光,對環境的變化非常敏感,因此較快反映蛋白質的構象變化[35]。如圖8所示,激發波長為290 nm進行掃描,復合物與SPI相比,λmax均向長波長方向移動,發生了不同程度的紅移,并且可明顯看出SPI-M復合物的紅移程度比SPI-G和SPI-D更大,表明SPI與M發生更深程度的美拉德反應,暴露了更多的色氨酸殘基,使其極性增加。
3 結 論
本實驗以乳化性和CI為指標,分別對SPI與G、M、D的接枝反應條件進行優化,得出SPI-G、SPI-M、SPI-D復合物最佳反應參數分別為:反應溫度80 ℃、反應時間3 h、蛋白質量分數4%、SPI與G質量比3∶1;反應溫度80 ℃、反應時間3 h、蛋白質量分數4%、SPI與M質量比4∶1;反應溫度90 ℃、反應時間3 h、蛋白質量分數4%、SPI與D質量比1∶1。優化的SPI-G的EAI和ESI分別為對照品的1.22 倍和1.29 倍,經過3 次凍融循環后,CI分別降低了28.03%、26.50%、22.84%;優化的SPI-M的EAI和ESI分別是對照品的1.41 倍和1.29 倍,經過3 次凍融循環后,CI分別降低了28.03%、28.30%、29.57%;優化的SPI-D的EAI和ESI分別為對照品的1.26 倍和1.19 倍,經過3 次凍融循環后,CI分別降低了20.9%、20.81%、24.55%,發現無論從凍融穩定性還是經濟能源方面,SPI-M的性質均好于SPI-G和SPI-D。
出油率分析表明優化后的美拉德反應產物凍融性質顯著提高;接枝度分析表明SPI與M形成共價復合物的比率明顯高于SPI與G和D形成共價復合物的比率;傅里葉變換紅外光譜分析表明糖分子以共價鍵的形式接入到SPI分子中;熒光分析表明蛋白結構發生改變。本實驗優化出濕熱條件下SPI與單糖、雙糖、多糖共價復合物最佳反應條件,提高了SPI的凍融穩定性,并降低改性溫度、節約了能源,降低糖的添加,減少了成本,為冷凍食品提供新的技術依據。

