激光剝蝕原位有機碳穩定同位素分析方法
張晗 魏來 廖旭 王佳妮 史秋月 張嫻
摘 要 自行研制了激光剝蝕取樣與穩定同位素質譜聯用接口,建立了以激光剝蝕微量取樣的微區有機碳同位素分析方法。考察了捕集時間、樣品量和激光能量等對同位素分餾的影響,采用3種標樣驗證了分析方法的準確性。結果表明,此裝置可對固體樣品進行高靈敏度的連續在線分析,樣品用量僅10?8 g,比傳統的元素分析同位素質譜聯用方法的樣品用量降低了104倍。本方法有效避免了激光剝蝕在取樣、傳輸和離子化過程的多種分餾因素,獲得了可重復的、高精度的測試結果。以13C標記的水稻為例,在葉尖獲得了橫截面的碳同位素分布差異信息。結合激光剝蝕技術原位取樣的優勢,此技術可用于考察固體樣品微區高分辨的碳同位素分布,在環境、農林學、生態學領域具有良好的應用前景。
關鍵詞 激光剝蝕;有機碳穩定同位素;原位碳同位素分析
1 引 言
激光剝蝕(Laser ablation)顯微取樣技術是地球、環境和考古科學研究中重要的分析工具[1]。 該技術樣品用量少,制樣簡單,可遠程、實時、在線,相對快速地處理、提取樣品,并具備高空間分辨率能力,可將101~102 μm深度的測量剖面劃分成不同區域,以描述其生長帶或擴散梯度空間,具有相當大的分析靈活性。激光剝蝕用于電感耦合等離子質譜(ICP-MS)分析的技術已經很成熟,是高靈敏度、多元素微區微量原位快速分析技術。將激光燒蝕顯微取樣方式與氣體同位素質譜聯用(Laser ablation-isotope ratio mass spectrometry,LA-IRMS)一方面可快速地將固體樣品直接引入同位素質譜,避免離線制樣的種種困難,減免氣體交換風險,提高取樣的準確度和進樣效率;另一方面可充分利用激光燒蝕微區原位取樣優勢,取樣量低,分析時間短,可獲得包含固體樣品空間信息的二維同位素分布圖像。
目前已有一些相關文獻報道,如Moran等[2]采用LSX-500Nd:YAG激光,以266 nm波長輸出,燒蝕固體樣品表面,設計了圓形不銹鋼剝蝕腔體,剝蝕后的樣品通過催化燃燒后,以六通閥門導入定量環,引入氣體穩定同位素質譜。該技術成功將原來至少25 μg碳樣品量降低至65 ng,后續成功應用該技術示蹤了生物墊(Microbial mats)內不同類型藻類微生物群落對標記的碳酸鹽的累積狀況,實現了50 μm的空間分辨率[3]。2019年,該課題組又利用該技術研究了根系碳在土壤中的分配[4]。 van Roij等[5]于2017年設計的ng級激光燒蝕系統與同位素質譜聯用,實現了對單花粉顆粒的激光取樣同位素檢測。該設備采用193 nm DUV(深紫外)ArF激光,設計了微量激光燒蝕腔體與氣相色譜聯用,實現了連續流多點位即時采樣。最近,該研究組采用該技術對單個水蚤進行了多次采樣(常規分析通常需要大于20只水蚤),并獲得了良好的重現性[6]。2019年,Rodionov等[7]采用213 nm激光剝蝕與PreCon聯用,研究了根系分泌物對土壤微生物影響,發現25%~50% 的根系碳在300 μm區域內與土壤/土壤微生物進行交換。
然而,目前相關研究仍存在因同位素質譜載氣流速限制,為了完全吹掃樣品而不得不限制樣品池體積,以致樣品池過小而應用受限的問題[5],以及載氣不純或系統連接處微漏等因素累積導致空白背景信號過高[7]等缺陷。本研究對現有聯用設備的缺陷進行了針對性改進,研制了通用性強、低背景的樣品池,優化了接口設計和測試條件,實現了對固體樣品原位、快速、微量、高精度有機碳同位素分析。
2 實驗部分
2.1 儀器與試劑
UP-213激光剝蝕系統(New Wave公司);Delta V advantage穩定同位素質譜儀、PreCon氣體預濃縮系統(美國Thermo Fisher Scientific公司)。
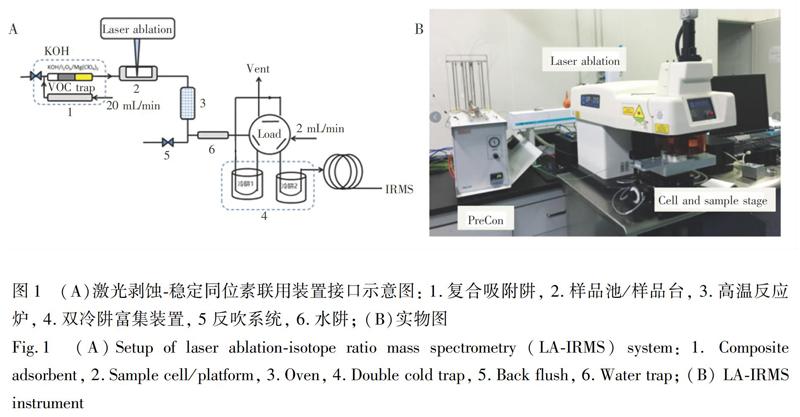
自行研制的激光剝蝕與穩定同位素質譜聯用接口包含: (1)復合吸附凈化裝置 由于激光剝蝕取樣在納克級別,干凈的背景尤為重要。系統背景主要來源于兩方面: 系統管路各接頭和樣品池的密閉性導致空氣中CO2和其它含碳雜質進入;載氣純凈度。由于采用冷阱富集,在富集樣品的同時,載氣中含碳雜質亦同時被累積。本套系統對載氣采用分級凈化,針對烴類雜質,在氦氣管路增加烴類捕集阱(In-line gas purifiers,Agilent);針對CO采用舒茨試劑(I2O5)捕集;針對CO2采用NaOH捕集,另加裝Mg(ClO4)2除去痕微量剝蝕出的H2O,多重復合吸附劑共同作用,確保零背景信號。(2)樣品池和樣品臺 簡化樣品池,除頂部石英玻片采用螺絲固定,其余為不銹鋼拋光加工,一體成型,避免漏氣。樣品池直徑30 mm,體積5.65 mL,遠大于文獻[3]樣品池尺寸,適用范圍更寬。商業化的激光剝蝕一般用于ICP-MS,流量高達1 L/min,而同位素質譜載氣僅為1~2 mL/min。為了保證完整吹掃,樣品池內壁為弧形設計,載氣流量25 mL/min,在雙冷阱處以六通閥切換至1 mL/min后進入質譜。(3)高溫反應爐 由于剝蝕出的樣品為有機氣溶膠,需轉化為CO2進入穩定同位素質譜。采用熱電公司Precon內微量高溫反應爐,在1000℃高溫下,將剝蝕出的氣溶膠定量轉化為CO2。(4)雙冷阱富集裝置 由于樣品傳輸存在先后,為完整收集剝蝕樣品,對高溫爐轉化后的CO2采用冷阱捕集,并二次聚焦,確保完整反映樣品真實信息,并減少樣品間干擾。(5)反吹系統 為避免樣品殘存在樣品池或傳輸管路,加裝反吹載氣,在樣品采集后,開啟反吹,自高溫爐往回吹掃,經過反應池和化學吸附阱后排空。(6)水阱 在進入質譜離子源前加裝半透膜水阱,以氦氣吹掃,除去高溫爐生成并從冷阱內逸出的少量水分。整套裝置設計和實物如圖1所示。
標準樣品: IAEA-CH-7(聚乙烯塑料薄膜,國際原子能機構);IAEA 600(粉末狀半胱氨酸,國際原子能機構);Urea(粉末狀尿素,IVA Analysentechnik)。
2.2 實驗方法
2.2.1 檢出限和靈敏度計算方法 在激光剝蝕前加裝三通,其中兩通連接氣路,一通采用橡膠隔墊密封,用于直接注射CO2,以計算裝置的靈敏度,判斷激光剝蝕的樣品量和無激光剝蝕時整個系統的穩定性和準確性。連續8次注射1 μL CO2標準氣,平均峰面積為83.25 Vs,根據氣體摩爾體積公式計算,1 μL CO2氣體中含有535.2 ng碳,即該套系統的靈敏度(碳)為6.4 ng/(V s)。 同時,Delta V advantage同位素質譜獲得穩定測試結果要求信號在500 mV以上,對應體積約0.7 Vs,由此計算該套系統測試檢測下限為~4.5 ng碳。
2.2.2 激光剝蝕原位有機碳同位素分析方法 (1)測試開始,將六通閥切換至Load模式,放下冷阱1至液氮。打開激光剝蝕,選好能量、光斑、剝蝕方式等參數,預熱6 s后,開始剝蝕。(2)剝蝕時間通常延續5~20 s,富集過程通常持續50~100 s,確保剝蝕出的氣溶膠樣品被捕集完全,然后切換六通閥。(3)放下冷阱2,預冷5 s,同時打開反吹清掃樣品池。(4)提起冷阱1,將富集的樣品轉移至冷阱2。(4) 提起冷阱2,將樣品送入質譜測試。
3 結果與討論
3.1 系統空白
經過多重凈化材料吸附,背景信號被有效控制,冷阱富集載氣50 s時,整體背景信號僅0.015 V s,遠優于文獻[6](50 s富集后,背景近2.0 V s)。富集100 s時,背景也僅0.105 V s,完全滿足測試需求。
3.2 剝蝕樣品捕集條件測試
LA-ICPMS產生的分餾效應發生在激光與樣品的相互作用過程、樣品氣溶膠顆粒的傳輸過程以及樣品氣溶膠在ICP等離子體中的離子化過程。將激光剝蝕應用于同位素測試時,該問題的解決同樣至關重要。激光剝蝕的氣溶膠顆粒能否代表樣品的原始組成,是否產生質量歧視,能否傳輸完全,能否完全轉化為CO2并在離子源中定量檢測,是測試中需要考慮的因素。本研究對各過程影響因素進行了系統優化。
3.2.1 捕集時間 受同位素質譜靈敏度限制,實際采樣根據樣品含碳量確定剝蝕長度/面積,過程將持續數秒,
若實時采集,樣品峰將嚴重拖尾。本套聯用裝置采用雙冷阱富集,能夠對每次剝蝕樣品中不同形態、不同大小和先后傳輸的顆粒進行完整收集,有效避免因前述過程導致的質量歧視和同位素分餾,彌補了LA-ICPMS實時聯用過程中剝蝕氣溶膠和顆粒在傳輸和離子化過程帶來的分餾缺陷。
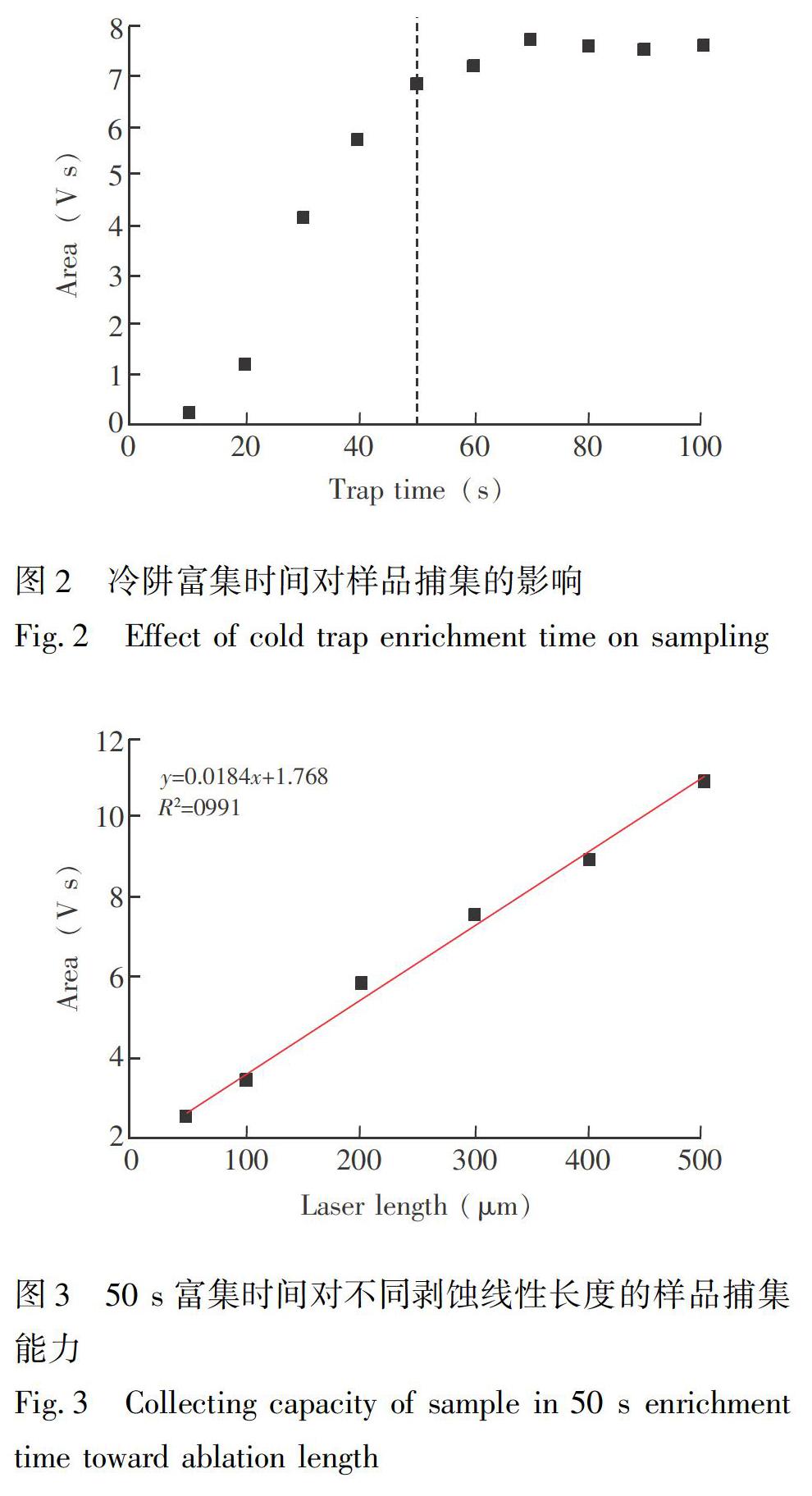
以國際原子能機構提供的IAEA-CH-7聚乙烯塑料膜作為參考,確定冷阱捕集。在激光輸出能量60%、激光光斑55 μm、激光線性剝蝕IAEA-CH-7長度300 μm條件下,(剝蝕出~150 ng碳),考察不同冷阱富集時間對可捕集到樣品量的影響。由圖2可見,冷阱富集50 s時,樣品捕集基本完成。綜合考慮空白背景影響和分析效率因素,選擇樣品捕集時間為50 s。
3.2.2 剝蝕樣品量
對IAEA-CH-7聚乙烯塑料膜進行不同長度剝蝕,測試冷阱富集條件對樣品量的容納程度,如圖3所示,冷阱捕集50 s條件下,剝蝕線性長度為50~500 μm(樣品峰面積2.5~10.87 V s),與同位素質譜捕獲的峰面積呈線性相關(R2=0.991),表明此冷阱富集條件對該信號范圍內的樣品峰可基本實現完全富集。
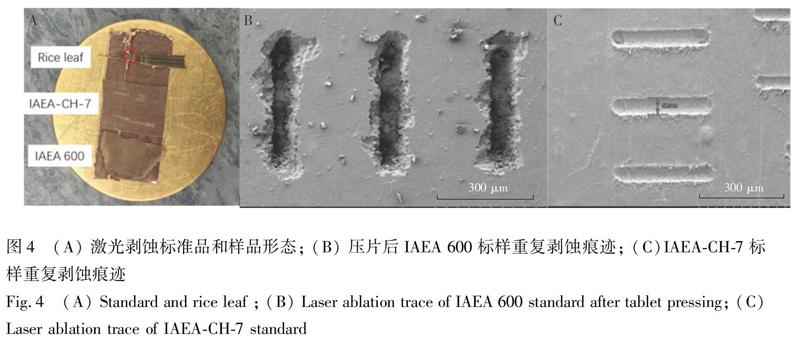
3.2.3 激光能量 由于IAEA-CH-7聚乙烯塑料膜形態相對特殊,相對薄而容易被擊穿,在驗證激光能量時,選擇了常規EA-IRMS常用的粉末狀標物IAEA 600(半胱氨酸)并對其壓片后測試。壓片后的樣品厚度可控,形態如圖4A所示。連續調整激光輸出能量,
由20%調整至100%(20%以下無法剝蝕出足夠樣品),重復3次。激光能量對同位素比值的影響見圖5,激光能量<50%時,同位素比值整體偏正;激光能量>50%時,同位素比值趨于恒定。有研究表明[7],激光能量密度需高于樣品的剝蝕閾值,能量過低會產生嚴重的元素分餾效應。由圖5可推測,激光能量<50%時,對輕質量的同位素產生質量歧視;當激光能量>50%時,方可對標準品進行完整剝離,獲得穩定的、能夠反應基體真實同位素比值的樣品。研究結果也表明,激光能量密度亦影響氣溶膠顆粒尺寸,低能量激光傾向形成小尺寸顆粒氣溶膠,利于傳輸和離子化。綜合考慮尺寸因素,規避分餾效應,選擇在激光能量60%的輸出條件下對樣品進行剝蝕。
值得注意的是,文獻[8]指出激光剝蝕光斑大小同樣會影響元素的分餾效應,激光光斑越小,分餾因子越大,可能與激光剝蝕頻率和剝蝕直徑共同影響的剝蝕坑形狀有關。本研究結果表明,激光光斑大小對穩定同位素比值存在顯著影響,但在恒定光斑尺寸下,同位素比值恒定,可以認為此影響可作為整套設備的系統誤差通過標準樣品進行校正。
3.3 標準樣品測試
在激光能量60%、光斑55 μm、冷阱捕集50 s、剝蝕線性長度300 μm條件下,對IAEA-CH-7和壓片后的IAEA 600和實驗室標準Urea重復測試,剝蝕痕跡電鏡圖見圖4,平行樣剝蝕尺寸、形狀和深度基本可控。3種標準物質平均峰面積分別為6.7、10.7 和3.7 V s,標準偏差分別為0.15‰、0.07‰和0.18‰,精度滿足測試要求。對標準品同時采用元素分析-同位素質譜測試(Element analyzer-isotope ratio mass spectrometry,EA-IRMS),結果見表1和圖6。分別以兩種測試結果與真值作圖,3個標準品以EA-IRMS測試線性相關系數R2=1,而LA-IRMS方法測試的樣品用量僅為元素分析方法樣品用量的萬分之一,線性相關系數R2=0.992。
另外,對IAEA 600在同一個剝蝕痕跡槽內重復剝蝕,以檢驗上一次剝蝕是否存在質量歧視,或是否導致基質同位素比值發生變化。選擇兩個點位,在每個點位連續重復剝蝕5次,均值分別為27.69±0.16和27.78±0.19,在誤差范圍內,可認為剝蝕過程并未產生同位素分餾。
3.4 同位素標記的水稻葉片微區測試
選擇以13C標記的CO2培養的水稻葉片尖部,進行微區碳同位素分布測試(圖4和圖7)。在1 mm寬的葉尖橫面,從右到左,依次間隔剝蝕取樣8次,平行兩次。剝蝕后的葉片電鏡圖和碳同位素測試結果如圖7所示。每個取樣點為55 μm直徑的圓孔,同一葉片在相同培養條件下,不同區域對13C標記的CO2吸收效率不同,呈現中間和邊緣貧化、兩端富集的趨勢。水稻葉片中心葉脈和葉片邊緣處對標記的13CO2吸收相對較弱,而兩邊葉肉部分對13CO2 吸收較強,即葉肉部分光合作用和呼吸作用強于葉脈和葉緣。研究表明[9],植物13CO2短期動態存在同種植物不同器官的差異,植物葉片呼吸釋放CO2碳同位素組成有較大的差異,變化幅度大于樹干/莖呼吸釋放。本研究在葉肉,葉脈和葉緣微觀尺度上研究植物呼吸釋放CO2的行為差異,此差異細節有望為環境生態研究人員提供關于植物呼吸、營養吸收,光合作用等生態過程更詳細的信息,使植物生長過程可視化。
4 結 論
將激光剝蝕取樣技術與穩定同位素質譜聯用,用于微區有機碳同位素測試。自行研制了激光剝蝕與同位素連用接口,定制了多重載氣過濾裝置和低流速微型樣品池,以微量高溫反應爐將剝蝕出的氣溶膠在線轉化為CO2,并采用雙冷阱對轉化后的CO2進行富集和聚焦。該套設備獲得了超低空白信號,并有效避免了激光剝蝕技術在傳輸和離子化過程產生的分餾。分析樣品量僅需數十納克,為傳統元素分析同位素質譜分析方法樣品量的萬分之一,而測試精度相近。對13C標記的水稻葉片尖進行測試,結果表明,葉緣、葉脈對CO2交換速率低于葉肉區域。激光剝蝕取樣與穩定同位素質譜聯用技術能夠原位、在線獲得動植物等生態樣品碳同位素空間分布信息,分辨率低至50 μm,在環境、農林、生態學等領域具有廣闊的應用前景。
References
1 CHEN Jin-Zhong,ZHENG Jie,LIANG Jun-Lu,SU Hong-Xin,LI Guang,WEI Yan-Hong. Spectroscopy and Spectral Analysis,2009,29(10): 2843-2847
陳金忠,鄭 杰,梁軍錄,蘇紅新,李 光,魏艷紅. 光譜學與光譜分析,2009,29(10): 2843-2847
2 Moran J J,Newburn M K,Alexander M L,SamsR L,Kelly J F,Kreuzer H W. Rapid Commun. Mass Spectrom.,2011,25(9): 1282-1290
3 Moran J J,Doll C G,Bernstein H C,Renslow R S,Cory A B,Hutchison J R,Lindemann S R,Fredrickson J K. Environ. Microbiol. Rep.,2014,6(6): 786-791
4 Denis E H,Ilhardt P D,Tucker A E,Huggett N L,Rosnow J J,Moran J J. J. Plant Nutr. Soil Sci.,2019,182,401-410
5 van Roij L,Sluijs A,Laks J J,Reichart G J. Rapid Commun. Mass Spectrom.,2017,31(1): 47-58
6 Schilder J,VanRoij L,Reichart G,Sluijs A,Heiri O. Quat. Sci. Rev., 2018,189: 127-133
7 Rodionov A,Lehndorff E,Stremtan C C,Brand W A,Knigshoven H,Amelung W. Anal. Chem.,2019,91 (9): 6225-6232
8 Jeong S H,Borisov O V,Yoo J H,Mao X L,Russo R E. Anal. Chem.,1999,71(22): 5123-5130
9 Werner C,Gessler A. Biogeosciences, 2011,8(9): 2437-2459

