表現為肺混雜密度磨玻璃結節的微浸潤性腺癌與浸潤性腺癌影像學特征比較
葉圣利 許順良 鄭小平 胡文超 蔣家康 楊莉
隨著高分辨率計算機體層攝影(high resolution computed tomography,HRCT)在肺部平掃中的廣泛應用,肺結節檢出率明顯提高[1-5]。肺結節定義為在肺野內,胸部X線或CT圖像上直徑≤30mm的圓形以及不規則形的密度增高影[6]。在檢出的肺結節中,大部分為良性的,少部分為惡性;而在惡性結節中,大部分結節為肺腺癌。2011年國際肺癌研究協會/美國胸科學會/歐洲呼吸學會公布的國際肺腺癌多學科病理新分型剔除了“細支氣管肺泡癌”這一概念,新增了“原位腺癌(adenocarcinoma in situ,AIS)”“微浸潤性腺癌(minimally invasive adenocarcinoma,MIA)”的概念[7]。相關研究報道,AIS與MIA患者術后5年無病生存率接近100%,且幾乎無淋巴結轉移,只需行肺亞葉切除術。肺腺癌的第3種病理類型為浸潤性腺癌(invasive adenocarcinoma,IAC),5年無病生存率僅74.6%,復發率和淋巴結轉移率均較高[8-11]。因此,術前對MIA與IAC進行準確的鑒別診斷具有重要意義。在CT影像學方面,肺結節分為純磨玻璃結節(pure ground-glass nodule,pGGN)、混雜密度磨玻璃結節(mixed ground-glass nodule,mGGN)和實性結節(solid nodule,SN)。其中 mGGN 是指內部含有部分呈軟組織密度的實性成分,在CT的肺窗上表現為淡薄的云霧狀密度增高影的肺結節[12]。筆者對表現為mGGN且病理檢查證實為MIA和IAC的影像學特征進行比較,現將結果報道如下。
1 對象和方法
1.1 對象 選取2016年6月至2019年5月在浙江樹人大學樹蘭國際醫學院附屬樹蘭杭州醫院行手術治療且術后病理檢查證實為MIA和IAC的178例患者為研究對象,男 38例,女 140例;年齡 26~77(56.8±10.3)歲;1個MIA結節87例(行肺段切除62例,肺葉切除25例),1個IAC結節77例(均行肺葉切除),1個MIA結節和1個IAC結節11例(均行肺葉切除),2個MIA結節3例(均行肺葉切除)。本研究經醫院倫理委員會審查通過,所有患者知情同意。
1.2 HRCT檢查 使用GE-Optima CT660或西門子SOMATOM Force雙源螺旋CT機進行檢查。所有患者取仰臥位,雙臂上舉且頭先進。掃描范圍:肺尖至肺底,兩側胸壁及腋窩。CT檢查、圖像重建的參數:探測器準直0.625×128,管電壓120kV,管電流時間乘積250mAs,螺距 0.516:1,SFOV 400mm,重建層厚 5.0mm,重建間隔5.0mm,重建矩陣512×512,重建算法采用肺部標準算法。明確病灶后進行病灶高分辨率靶重建,重建層厚1.25mm,重建間隔 1.25mm,重建算法ASIR ss30(GEOptima CT660)或 ADMIRE Strength 3(西門子 SOMATOM Force),CFOV180mm,矩陣 512×512,肺窗:窗寬 1500∶1,窗位-600。
1.3 影像資料收集 由2位高年資放射科醫師收集患者mGGN的CT影像資料,內容包括結節實性成分形態(圓形/橢圓形、不規則形)、生長部位(中心性、偏心性)、邊界情況(清楚、模糊)、數量(單發、多發)、大小(≤5mm、>5mm)、CT值等。
1.4 統計學處理 采用SPSS 20.0統計軟件。計量資料用表示,組間比較采用兩獨立樣本t檢驗;計數資料用率表示,組間比較采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
178例患者HRCT圖像表現為mGGN共有192個,其中MIA104個,IAC結節88個。MIA與IAC的mGGN實性成分形態、生長部位、邊界情況、數量、大小、CT值比較,差異均有統計學意義(均P<0.05),見表1。
典型病例1:女性,56歲,左上肺MIA患者。結節大小0.8cm,形態為橢圓形;結節實性成分生長部位為偏心性,單發,大小2mm,CT值-313HU;術后病理檢查證實為MIA,見圖1(插頁)。典型病例2:女性,62歲,右下肺IAC患者。結節大小1.1cm,形態不規則;結節實性成分邊界模糊,多發,最大的實性成分6mm,CT值-87HU;術后病理檢查證實為IAC,見圖2(插頁)。
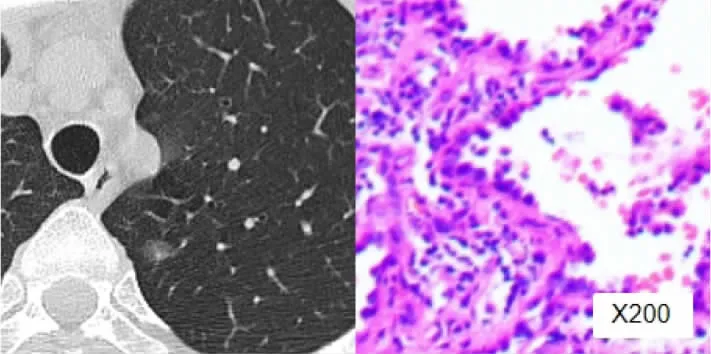
圖1 左上肺MIA患者CT表現及術后病理檢查結果
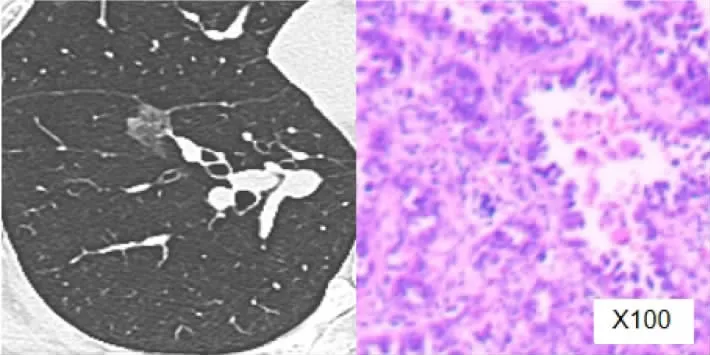
圖2 右下肺IAC患者CT表現及術后病理檢查結果
3 討論
隨著醫學影像學技術的快速發展,胸部HRCT體檢也越來越普遍,肺結節檢出率也明顯提高。但隨之而來的是,術前診斷困難、難以定性的肺結節也明顯增多;其中mGGN的鑒別診斷就較為困難,且惡性的可能性也較大[13],而肺腺癌是惡性肺結節中最主要的病理類型之一[14]。肺腺癌的病理類型包括AIS、MIA和IAC[15],而本文主要分析了表現為mGGN的MIA和IAC的HRCT影像學特征。由于MIA患者通常只需行肺段切除或肺楔形切除,無需行創傷較大的肺葉切除,其5年無病生存率幾乎為100%,且多無區域淋巴結轉移或遠處轉移。但IAC患者不僅行肺亞葉切除術(肺段切除或肺楔形切除),而且需要行肺葉切除,其淋巴結轉移率相對較高,5年DFS僅74.6%。因此,在外科手術前準確鑒別MIA與IAC具有重要意義。
mGGN若為惡性,實性成分不全是浸潤成分,尤其是最終病理檢查診斷為AIS時,實性成分很有可能是良性的,如mGGN實性成分的最終病理診斷可能是局部的肺泡組織塌陷形成的纖維化,也有可能是潴留在小支氣管中的黏液,甚至是纖維瘢痕組織[15]。mGGN生長到一定程度的時候,因為結節中心區域血液供應的相對不足以及腫瘤區域氧飽和度相對較低,結節內部的肺泡結構發生缺氧而萎陷,形成含有液體的空隙,最后發生纖維化。利用肺部HRCT對mGGN實性成分作出正確、合理的判斷,對于結節性質的判斷、術式選擇具有重要意義。已有研究對mGGN實性成分比例、大小、CT值與肺結節侵襲程度進行了相關性研究,結果提示實性成分比例越高、直徑越大、CT值越高,肺結節的侵襲程度越高[16-20]。然而,在表現為mGGN的MIA與IAC中,結節實性成分為局部的肺泡組織塌陷形成的纖維化,潴留在小支氣管中的黏液,或是纖維瘢痕組織,通常為惡性成分。
本研究結果發現,在MIA與IAC的mGGN中,結節實性成分形態比較差異有意義,MIA實性成分形態多為圓形或橢圓形,而IAC多為不規則形。嚴金崗等[21]研究結果顯示,MIA的mGGN實性成分形態為不規則形的比例高于AIS,但未對IAC進行研究。在結節實性成分生長部位方面,本研究顯示MIA與IAC的mGGN中,均以偏心性生長為主;其中MIA的比例更高,與IAC比較差異亦有統計學意義。曹捍波等[15]研究也表明,MIA組mGGN實性成分生長部位為偏心性生長的比例高達84.90%,與本研究結果(82.7%)類似;但是IAC組mGGN實性成分生長部位為偏心性生長的比例高達71.43%,遠高于本研究結果(56.8%)。另外,本研究對結節實性成分邊界情況作了分析,結果提示MIA與IAC的mGGN實性成分邊界多為模糊,其中MIA組邊界模糊比例遠高于IAC組,差異有統計學意義,這與曹捍波等[15]研究結果類似。在結節實性成分數量方面,MIA組mGGN實性成分常為單發,而IAC組mGGN實性成分常為多發(一般為多個小浸潤灶同時存在,部分會融合為一個浸潤灶)。本文對結節實性成分大小作了比較,結果顯示MIA組mGGN實性成分≤5mm,而IAC組通常>5mm,這與曹捍波等[15]、金艷鳳等[22]研究結果類似。然而,Zhang等[23]研究顯示,結節實性成分6.7mm是鑒別MIA與IAC mGGN的最佳截斷值。Yu等[1]研究結果顯示,結節實性成分4.0mm是鑒別MIA與IAC mGGN的最佳截斷值。本研究還比較了CT值,結果顯示MIA與IAC結節實性成分CT值比較,差異有統計學意義。
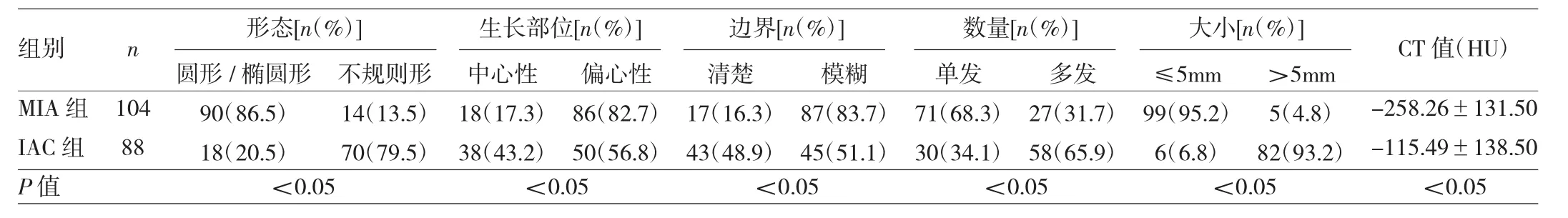
表1 MIA與IAC的mGGN影像學特征比較
綜上所述,表現為mGGN的MIA和IAC,其HRCT影像學特征存在差異;結節實性成分特點有助于鑒別MIA與IAC的mGGN。

