人巨細胞病毒gH蛋白表達及其單克隆抗體的制備
劉 樂,廖旻晶,徐 葉,劉如石,鐘志宏*,王慶林*
(1.湖南省免疫診斷試劑工程研究中心, 長沙410006; 2.湖南師范大學醫學院, 長沙410006)
人巨細胞病毒(human cytomegalovirus,HCMV)是人群中普遍存在的皰疹病毒家族5型的成員,屬于β皰疹病毒亞科。HCMV成熟病毒顆粒的大小為150~200 nm,核心為雙鏈線形DNA,外包呈二十面體對稱的衣殼,核衣殼外有一層被膜,病毒的最外層是含有病毒編碼的多種糖蛋白的脂質包膜。HCMV具有種屬特異性,主要在人與人之間傳播,可通過唾液、尿液、母乳喂養、胎盤、性交、血液和器官移植等多種方式進行傳播。臨床上,免疫系統功能正常的人群感染HCMV后通常是無癥狀的,然而在免疫缺陷個體中則表現為嚴重的系統性疾病[1]。此外,HCMV是引起胎兒先天性畸形最常見的感染原因[2,3],也是造血干細胞和實體器官移植受者感染和死亡的主要原因[4]。
目前沒有較好的治療HCMV感染的方法,其主要治療藥物為更昔洛韋和纈更昔洛韋,但這些藥物有嚴重的副作用。基于社會和經濟負擔以及缺乏有效治療方案,HCMV已被指定為最優先的疫苗目標之一[5]。早期開發的減毒活疫苗如AD169和Towne,雖然可以誘導短暫的中和抗體應答,但不能徹底清除體內病毒,阻斷病毒對上皮細胞的感染。近幾十年來,HCMV亞單位疫苗研究主要集中在刺激機體產生中和抗體(neutralizing antibody,NAb)所必需的包膜糖蛋白gB(glycoprotein B)上。與佐劑MF59混合的重組gB疫苗預防育齡婦女HCMV原發感染的有效率為38%~50%,但無法預防青少年的HCMV原發性感染[6,7]。HCMV gH(glycoprotein H)也是HCMV必需的包膜糖蛋白[8],并能誘導針對病毒的中和抗體,是HCMV亞單位疫苗的候選抗原[9],但目前針對gH中和抗體的研究甚少。
gH由HCMVUL75基因編碼,基因全長為2 232 bp,編碼742個氨基酸。gH與gB、gL(glycoprotein L)構成了HCMV的核心融合機制,在HCMV融合、進入和感染宿主細胞過程中發揮關鍵作用[10,11],是誘導機體產生免疫應答的主要靶點[12]。有研究表明,gH是人巨細胞病毒主要的中和抗原[13,14],機體產生的抗gH抗體可中和進入上皮細胞和成纖維細胞的特異性毒株[15],有效干擾HCMV對上述細胞的感染[8,16,17]。因此,本研究擬通過重組表達及雜交瘤技術,獲得重組gH蛋白及抗gH蛋白的單克隆抗體,以期為HCMV疫苗開發奠定基礎。
1 材料與方法
1.1 質粒和菌株、試驗動物和主要試劑
本試驗所用原核表達質粒為pET32a′,經pET32a改造而來,即去除后者Trx標簽及部分酶切位點,具體去除部位為堿基的203~689位;原核表達質粒pET32a、TransB菌株、TOP10F′菌株及HCMV Toledo由本實驗室保存;BALB/c雄鼠購自湖南斯萊克景達實驗動物有限公司;GAM-IgG-HRP由廈門大學夏寧邵教授惠贈;限制性內切酶EcoR I、XhoI以及DNA相對分子質量標準購自TaKaRat公司;抗6×His-tag單克隆抗體、質粒小提試劑盒、瓊脂糖凝膠DNA回收試劑盒、BCA(bicinchoninic acid)蛋白定量試劑盒購自上海生工公司;HCMV陽性血清由湖南省人民醫院檢驗科惠贈;HT、HAT以及弗氏完全佐劑與弗氏不完全佐劑購自Sigma公司;1640培養基、DMEM/F-12培養基購自GIBCO公司;胎牛血清(fetal bovine serum,FBS)購自上海依科賽生物科技有限公司;ECL(eletrochemiluminescence)顯色液購自莫納生物科技有限公司。
1.2 HCMV gH基因擴增
以含HCMV Toledo全基因組的BAC(bacterial artificial chromosome)為模板,擴增去除信號肽和跨膜區序列的gH基因片段,設計的上游引物: 5′-CCGGAATTCTCCGAAGCGCTGGACCCTC-3′;下游引物:5′-GGGCTCGAGACGACTGTCGGTGGCGTCC-3′(波浪線標注的分別為EcoR I和XhoI的酶切位點,下劃線標注的分別為酶切位點的保護堿基)。引物由長沙擎科生物科技有限公司合成。PCR反應程序為:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 3 min,共28個循環。目的片段經1%的瓊脂糖凝膠電泳分析并回收。
1.3 重組質粒的構建與鑒定

1.4 HCMV gH蛋白的表達與純化
將鑒定后的質粒轉化至大腸桿菌TransB表達菌株,挑單菌落于3 mL液體培養基中培養,待菌液OD600 nm值至0.6~0.8時,加入質量濃度為200 mg/L的異丙基-β-D-硫代半苷 (isopropyl-β-D-thiogalactopryanoside,IPTG)誘導重組蛋白的表達,離心收集誘導前后的菌體并用超聲波破碎,制備誘導前后菌株的蛋白樣進行10%的十二烷基磺酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfonate polyacrylamide gel electrophoresis,SDS-PAGE)和免疫印跡(western blot,WB)鑒定。用同種方法大量誘導表達重組蛋白,離心收菌并用超聲波破碎,將誘導后的菌液、超聲后懸液以及懸液離心后上清、沉淀分別制樣,經10%的SDS-PAGE及WB鑒定重組蛋白的表達方式,WB所用一抗為抗6×His-tag單抗。
用含2%TritonX-100的Buffer I溶液和Buffer I溶液分別洗滌沉淀,然后用4 mol/L尿素溶液變性蛋白,12 000 r/min離心10 min,棄上清,沉淀用磷酸鹽緩沖液(phosphate buffered saline,PBS)重懸、制樣。蛋白樣經10%SDS-PAGE后,切取gH蛋白對應的目的條帶于透析袋內,并在加有Tris-甘氨酸緩沖液的水平電泳槽進行電泳,條件為電壓100 V、2 h。電洗脫后,去掉透析袋中的凝膠,并加入二硫蘇糖醇(dithiothreitol,DTT)至終濃度50.00 mmol/L,將透析袋放在含DTT的PBS中,透析液中DDT濃度依次為50.00、25.00、12.50和6.25 mmol/L,最后將透析液全部換成PBS,4 ℃各攪拌透析2 h。透析結束后,回收透析袋中蛋白溶液并制樣,經SDS-PAGE和WB鑒定重組蛋白。WB所用一抗分別為抗6×His-tag單抗、HCMV陽性血清。
1.5 小鼠免疫
將純化后的蛋白與弗氏完全佐劑等體積混合并充分乳化后,皮下多點免疫8周齡的BALB/c雄鼠,劑量為150 μg/只。2周后,純化蛋白與弗氏不完全佐劑充分乳化,然后以同樣的劑量和方法對小鼠進行3次加強免疫,每次間隔2周。在細胞融合前3 d,對小鼠進行腹腔加強免疫,劑量為150 μg/只。每次免疫前1 d對小鼠進行眼眶靜脈叢取血,通過間接酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)檢測血清效價。
1.6 細胞融合
終免3 d后取免疫小鼠的脾臟,收集脾細胞,按1∶10的比例與生長狀態良好的骨髓瘤細胞sp2/0進行混合,在37 ℃預熱的聚乙二醇(polyethylene glycol,PEG)1500作用下進行細胞融合,并用無血清1640培養基終止融合。用含HAT的20%FBS-1640培養基懸浮細胞,然后均勻鋪于96孔板中,放于37 ℃、5%CO2的培養箱中培養。
1.7 雜交瘤細胞的篩選
融合后的細胞在培養第7天用含10%FBS的HT-1640培養基換液,待細胞集落長至孔底面積的1/3~1/2時,取培養液上清作為一抗,用間接ELISA方法進行檢測。選取OD450 nm值較高且細胞集落數目少的孔,通過有限稀釋法進行克隆化。通過4次亞克隆,以保證重篩選的細胞為可穩定分泌gH抗體的雜交瘤細胞。
1.8 單克隆抗體的制備、純化和鑒定
取9周齡的雄性BALB/c小鼠,按每只500 μL的劑量腹腔注射石蠟油。9 d后用PBS將雜交瘤細胞數調整為2×106個/mL,按每只500 μL的劑量腹腔注射小鼠。10 d后,收集腹水,通過辛酸-飽和硫酸銨沉淀和Protein A柱對腹水進行純化,將純化前后的腹水進行12%SDS-PAGE鑒定。
1.9 單克隆抗體的性質鑒定
1.9.1 亞型檢測
使用間接ELISA法對單克隆抗體進行亞型鑒定。取篩選的每株雜交瘤細胞培養液作為一抗,分別以抗 IgG1、IgG2a、IgG2b、IgG3、IgM、IgGAM的抗體作為二抗,其中IgGAM作為陽性對照。另設陰性對照,以配制的細胞培養基作為一抗,IgGAM作為二抗。
1.9.2 抗體效價
將純化的單克隆抗體作為一抗,使用間接ELISA法測定。檢測效價時,將5種抗體的質量濃度均稀釋為0.59 g/L,然后從1∶800進行2倍比稀釋,直至最終稀釋比為 1∶204 800。
1.9.3 反應性檢測
將純化后的重組gH蛋白作為抗原,分別以篩選并純化后的單克隆抗體作為一抗,同時以抗6×His-tag單抗作為陽性對照,通過WB檢測5種單抗對重組gH蛋白的反應性。
1.9.4 人巨細胞病毒的培養及單克隆抗體的免疫捕獲PCR
用含10%FBS的DMEM/F-12培養液培養 ARPE-19(adult retinal pigment epithelial cell line-19)細胞,待細胞密度達到60%~80%時,向培養液中加入HCMV Toledo病毒液,感染量為1 000 PFU/皿,置于5%CO2、37 ℃的細胞培養箱中孵育,期間每隔15 min輕輕搖動培養皿。2 h后,將培養液換為含2%FBS的 DMEM/F-12 培養液,置于細胞培養箱中繼續培養5~7 d。待細胞大部分發生病變后,用2 mL左右上清液將ARPE-19細胞充分懸浮,并收集于凍存管中。將凍存管反復凍融3次后,在4 ℃環境中10 416 r/min離心30 min,上清即為具有感染性的病毒液,留取上清備用。
單克隆抗體的免疫捕獲試驗分為抗體捕獲病毒陰性對照(不包被抗體僅加病毒液),抗體試驗組(包被抗體加病毒液)和抗體陰性對照(僅包被抗體不加病毒液)。具體操作如下:純化單克隆抗體用PBS(pH 7.4)稀釋至8 μg/mL,包被到0.5 mL離心管中,每個抗體包被兩管,每管100 μL。同時以僅包被等量包被液的離心管作為抗體捕獲病毒陰性對照,4 ℃過夜。1×PBS洗滌3次后,用200 μL ED封閉液于37 ℃封閉2 h,1×PBS 洗滌3次;每個抗體包被管中分別加入100 μL病毒液與正常細胞裂解液,作為抗體實驗組與抗體陰性對照,僅包被包被液的離心管中加入等量病毒液,37 ℃ 孵育2 h;1×PBS洗滌6次。加入30 μL ddH2O,于PCR儀器上95 ℃熱處理 15 min。之后,以水溶液為模板進行gH基因片段的PCR擴增試驗,并用瓊脂糖凝膠電泳分析結果。其中模板陰、陽性對照分別以ddH2O、重組質粒pET32a′-gH為模板,其余操作一樣。PCR反應程序同步驟1.2。
2 結果與分析
2.1 重組質粒pET32a′-gH的構建
以含HCMV Toledo毒株全基因組的BAC為模板,PCR擴增不含信號肽和跨膜區序列的gH基因,理論上PCR產物為2 064 bp。將PCR產物進行瓊脂糖凝膠電泳,發現陰性對照無條帶,陽性樣品在2 000 bp附近有一條較亮的條帶,初步確定為gH基因片段(圖1a)。純化擴增的PCR產物,與pET32a′構建重組表達載體。構建成功的重組質粒經EcoR I和XhoI雙酶切后,理論上會有2條片段,分別為2 064 bp的gH基因和5 414 bp的線性質粒pET32a′。將酶切前后的樣進行瓊脂糖凝膠電泳,結果發現,雙酶切后有2條條帶,分別位于5 000 bp和2 000 bp左右,與理論相符(圖1b)。同時,提取重組質粒進行測序,插入片段的核苷酸序列與預期相符,提示該重組質粒可用于后續的蛋白表達。
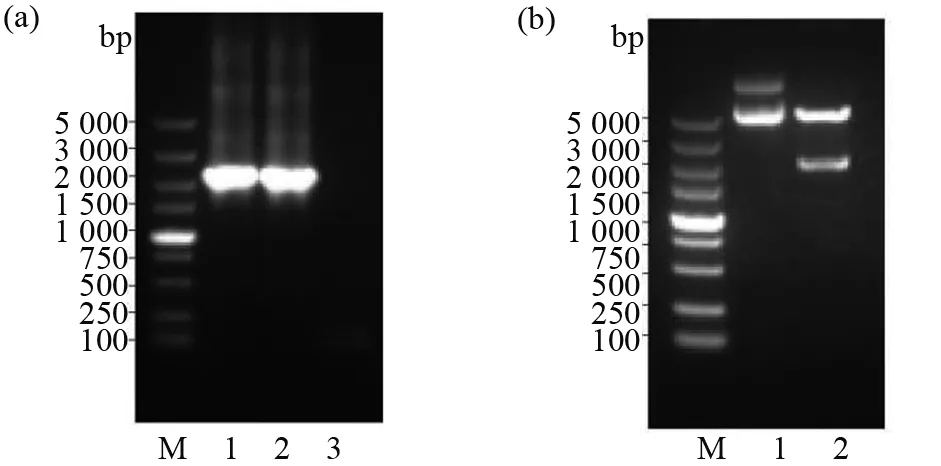
圖1 重組表達質粒pET32a′-gH的構建Fig.1 Construction of recombinant expression plasmid pET32a′- gH(a)gH基因擴增產物的瓊脂糖凝膠電泳結果。Lane M:DNA的相對分子質量標準;Lane 1、2:gH基因特異性擴增產物;Lane 3:以ddH2O為模板的陰性對照;(b)重組質粒pET32a′-gH的雙酶切鑒定結果。Lane M:DNA的相對分子質量標準;Lane 1:構建成功的重組質粒;Lane 2:重組質粒經EcoR I/Xho I雙酶切后產物(a)The results of agarose gel electrophoresis of amplified products of gH gene.Lane M:Relative molecular mass standard of DNA;Lane 1 and Lane 2:Specific amplification products of gH gene;Lane 3:Negative control with ddH2O as template;(b)Results of double enzyme digestion of recombinant plasmid pET32a′-gH. Lane M:The relative molecular mass standard of DNA;Lane 1:The successful construction of a recombinant plasmid;Lane 2:The pro-duct of the recombinant plasmid after digestion by EcoR I/Xho I
2.2 重組gH蛋白的表達及純化
將構建成功的重組質粒轉化TransB菌株,并用IPTG誘導蛋白表達。分別留取IPTG誘導前后的蛋白樣,并通過SDS-PAGE、WB鑒定蛋白表達情況。SDS-PAGE結果顯示,與誘導前相比,誘導后的重組菌株表達了一個約70 kD的蛋白(圖2a)。為驗證誘導表達蛋白是否為gH蛋白,我們以抗6×His-tag抗體作為一抗,使用WB對重組蛋白的表達情況進行鑒定,結果顯示,經IPTG誘導的表達菌株在70 kD處出現了特異性條帶,而對照菌株中沒有出現(圖2b),提示菌株所表達的70 kD蛋白處為含有6×His-tag的重組蛋白。超聲波破碎后經IPTG誘導的重組表達菌株,SDS-PAGE結果顯示,重組蛋白主要存在于沉淀中,說明該蛋白主要以包涵體的形式表達(圖2a)。使用WB對重組蛋白的表達情況進行鑒定,與SDS-PAGE結果一致(圖2b)。大量表達gH,收集沉淀,后者經洗滌、尿素變性后,用電洗脫方法進行純化,收集純化前后的蛋白樣,并通過SDS-PAGE和WB鑒定gH純化情況(圖3)。結果顯示:與純化前相比,純化后gH僅有1條較亮的條帶,gH重組蛋白純化率達90%以上,達到免疫小鼠制備單克隆抗體的要求。
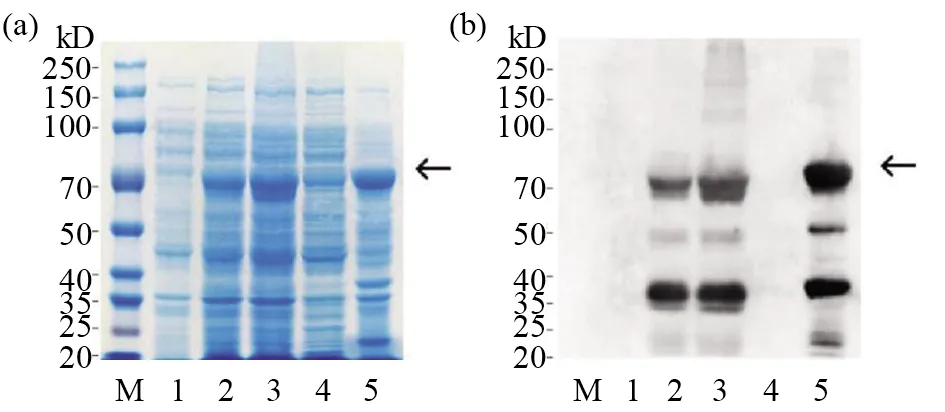
圖2 重組gH蛋白的原核表達Fig.2 Eukaryotic expression of recombinant gH protein 通過SDS-PAGE(a)及WB(b)鑒定重組gH蛋白的表達情況。Lane M:預染蛋白質相對分子質量標準;Lane 1:未經IPTG誘導菌株;Lane 2:IPTG誘導后菌株;Lane 3:超聲懸液;Lane 4:超聲懸液離心后上清;Lane 5:超聲懸液離心后沉淀Identification of the expression of recombinant gH protein by SDS-PAGE (a) and WB (b).Lane M:Relative molecular mass standard of predyed protein;Lane 1:Strains not induced by IPTG;Lane 2:Strains induced by IPTG;Lane 3:Ultrasonic suspension;Lane 4:Ultrasonic suspension supernatant after centrifugation;Lane 5:Ultrasonic suspension precipitation after centrifugation
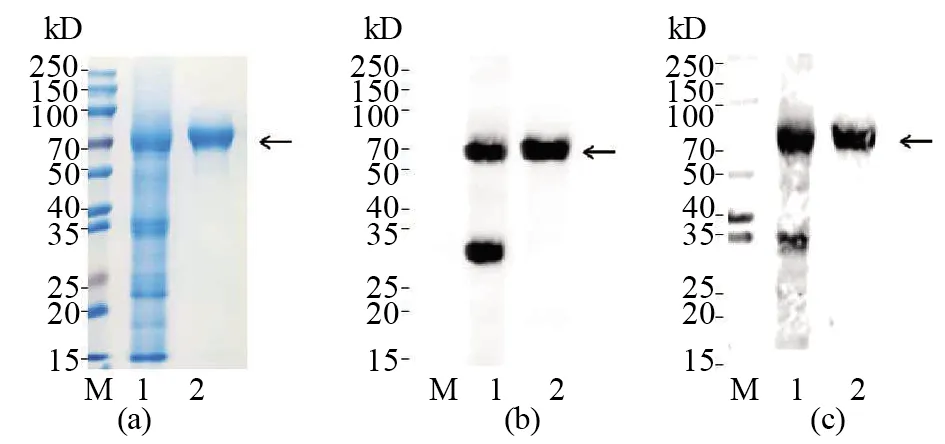
圖3 重組gH蛋白的純化鑒定Fig.3 Identification of purified recombinant gH (a)SDS-PAGE 鑒定純化后重組gH蛋白;(b)WB 鑒定純化后重組gH蛋白(所用一抗為抗6×His-tag);(c)WB 鑒定重組gH蛋白表達方式 (所用一抗為HCMV陽性血清);Lane M:預染蛋白質相對分子質量標準;Lane 1:未經純化的蛋白;Lane 2:經電洗脫純化后的蛋白(a)The purified recombinant gH were identified by SDA-PAGE;(b)The purified recombinant gH were identified by WB,and the first antibody used was anti 6×His-tag;(c)The purified recombinant gH were identified by WB,and the first antibody used was HCMV positive serum.Lane M:Relative molecular mass standard of predyed protein;Lane 1:The unpurified protein;Lane 2:The protein purified by electroelution
2.3 抗gH單克隆抗體的制備及純化
用純化后的gH蛋白免疫小鼠,將小鼠免疫前的血清1∶4 000稀釋后作為陰性對照,以大于2.1倍陰性值作為陽性。結果顯示,經5次免疫后,小鼠血清抗體含量明顯升高,效價可達1∶100 000(圖4),達到制備單克隆抗體的要求。免疫后取小鼠脾細胞,經細胞融合、亞克隆化培養,篩選出5株能穩定分泌抗HCMV gH 單克隆抗體的雜交瘤細胞,分別命名為8A9、8B4、8C4、8D9、8D12。

圖4 免疫小鼠的血清效價檢測Fig.4 The examination of serum titer in mice after immunization
將適量雜交瘤細胞注射入小鼠腹腔,7~15 d后收集小鼠腹水。使用辛酸-飽和硫酸銨沉淀和Protein A柱進行純化,將純化前后的抗體進行SDS-PAGE,結果顯示,純化后的抗體樣品未經煮沸時出現3條帶,分別為50 kD的重鏈、25 kD的輕鏈和大小約100 kD的條帶。100 kD的條帶為重鏈與重鏈的聚合體,由于兩條重鏈間的二硫鍵沒有完全破壞所形成(圖5)。煮沸后的抗體樣品主要有2條帶,分別為50 kD的重鏈和25 kD的輕鏈,且與煮沸前相比,50 kD處條帶變粗。凝膠電泳結果顯示,樣品中雜帶很少,提示單克隆抗體達到很高純度,可用于后續試驗。

圖5 純化單克隆抗體的SDS-PAGE鑒定Fig.5 Identification of purified monoclonal antibodies by SDS-PAGELane M:預染蛋白質相對分子質量標準;Lane 1:經10倍稀釋處理的未煮沸腹水樣品;Lane2:經10倍稀釋處理的煮沸腹水樣品;Lane 3:未煮沸的辛酸硫酸銨沉淀處理后的腹水樣品;Lane 4:煮沸的辛酸硫酸銨沉淀處理后的腹水樣品;Lane 5:未煮沸的經protein A柱純化處理的腹水樣品;Lane 6:煮沸的經protein A柱純化處理的腹水樣品Lane M:Relative molecular mass standard of predyed protein;Lane 1:Unboiled ascites treated by 10 times dilution;Lane 2:Boiled ascites treated by 10 times dilution;Lane 3:Unboiled ascites treated by purification after precipitation of ammonium caproate sulfate;Lane 4:Boiled ascites treated by purification after precipitation of ammonium caproate sulfate;Lane 5:Unboiled ascites treated by purification after proteinA-column;Lane 6:Boiled ascites treated by purifi-cation after proteinA-column
2.4 單克隆抗體性質鑒定
2.4.1 亞型鑒定
將OD450 nm>1.0作為陽性結果,結果顯示,除IgGAM外,5株抗體僅與IgG2a呈陽性反應,故8A9、8B4、8C4、8D9、8D12亞型均為IgG2a型(圖6)。
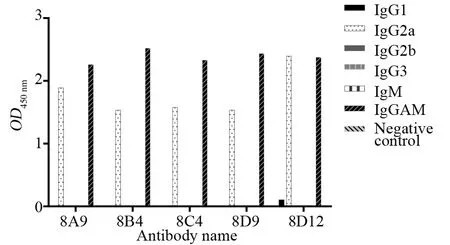
圖6 五株單克隆抗體的亞型檢測Fig.6 Examination of the subtype of 5 monoclonal antibodies
2.4.2 單克隆抗體的效價測定
以PBS作為陰性對照,以大于2.1倍陰性值作為陽性,結果顯示,8A9的效價達1∶51 200,8B4的效價達1∶6 400,8C4的效價達1∶102 400,8D9的效價達1∶102 400,8D12的效價達1∶6 400。試驗結果提示,這5株單克隆抗體的活性為8C4=8D9>8A9>8B4=8D12(圖7)。
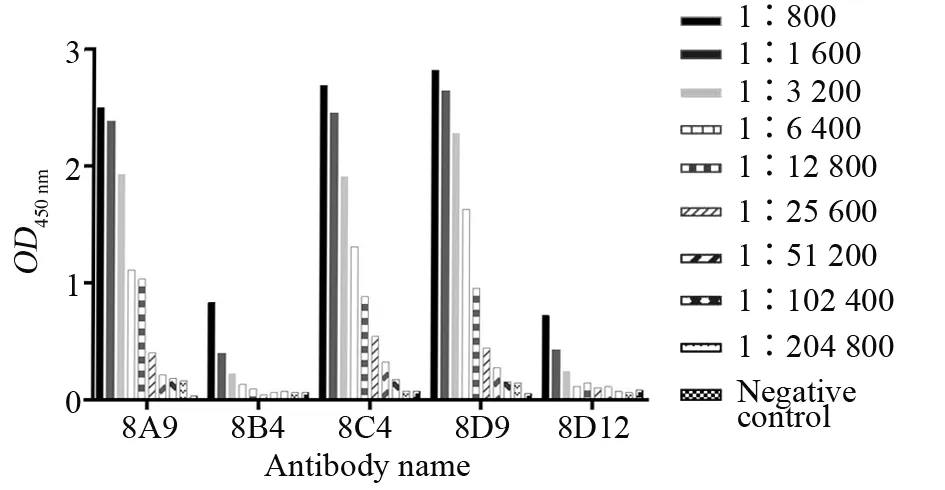
圖7 五株單克隆抗體的效價檢測Fig.7 Titer test of 5 monoclonal antibodies
2.4.3 單克隆抗體的免疫反應性檢測
分別以單抗8A9、8B4、8C4、8D9、8D12和抗6×His-tag為一抗,利用WB鑒定單克隆抗體對重組gH蛋白的免疫反應性(圖8),結果顯示,5種單克隆抗體與純化的重組gH蛋白反應后均在目標位置出現一條明顯的條帶,提示這5種單克隆抗體能特異性識別重組gH蛋白。

圖8 五株單克隆抗體對gH蛋白的免疫反應性檢測Fig.8 The immunoreactivity of monoclonal antibodies with gH protein(a)重組gH蛋白的SDS-PAGE結果;(b)單克隆抗體對重組gH蛋白的WB結果;Lane M:預染蛋白質相對分子質量標準;Lane 1:純化的gH蛋白;(1)~(6)對應一抗分別為8A9、8B4、8C4、8D9、8D12和抗6×His-tag(a)Result of recombinant gH protein by SDA-PAGE;(b) Immunoreactivity of monoclonal antibodies with gH protein by WB detection;Lane M:Relative molecular mass standard of predyed protein;Lane 1:Purified gH protein;(1)~(6) Corresponding antibodies are 8A9,8B4,8C4,8D9,8D12,and 6×His-tag,respectively
2.4.4 單克隆抗體的免疫捕獲PCR
用免疫捕獲PCR 檢測抗gH單克隆抗體捕獲HCMV的能力。當抗體可以捕獲病毒時,二者可特異性結合,不能結合的病毒則被PBS洗掉。抗體-病毒結合物在95 ℃可釋放病毒于水溶液中,以水溶液作為模板,利用gH特異性引物進行PCR反應。其中模板陰性對照、抗體捕獲病毒試驗陰性對照與8C4試驗組、陰性對照均無條帶;模板陽性對照,8A9、8B4、8D9、8D12抗體試驗組在2 000 bp附近有一條特異的條帶,條帶大小與理論一致。說明抗體8A9、8B4、8D9、8D12均可以捕獲HCMV,且8D9和8D12的捕獲能力較強,8C4不可以捕獲病毒(圖9)。
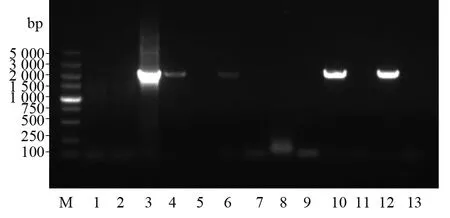
圖9 五株單克隆抗體的病毒捕獲能力檢測Fig.9 Detection of virus capture ability of monoclonal antibodiesLane M:DNA的相對分子質量標準;Lane 1:模板陰性對照;lane 2:抗體捕獲病毒試驗陰性對照;Lane 3:模板陽性對照;Lane 4:8A9試驗組;Lane 5:8A9陰性對照;Lane 6:8B4試驗組;Lane 7:8B4陰性對照;Lane 8:8C4試驗組;Lane 9:8C4陰性對照;Lane 10:8D9試驗組;Lane 11:8D9陰性對照;Lane 12:8D12試驗組;Lane 13:8D12陰性對照Lane M:Relative molecular mass standard of DNA;Lane 1:Template negative control;Lane 2:Negative control of antibody capture virus test;Lane 3:Template positive control;Lane 4:Test group sample of 8A9;Lane 5:Negative control of 8A9;Lane 6:Test group sample of 8B4;Lane 7:Negative control of 8B4;Lane 8:Test group sample of 8C4;Lane 9:Negative control of 8C4;Lane 10:Test group sample of 8D9;Lane 11:Negative control of 8D9 ;Lane 12:Test group sample of 8D12;Lane 13:Negative control of 8D12
3 討論
本試驗利用HCMV臨床株Toledo作為gH基因擴增模板及后續的免疫捕獲試驗。Toledo是從一名先天性感染HCMV的兒童中分離出來的低傳代毒株,用于人類巨細胞病毒感染研究[18]。與HCMV實驗室標準病毒株AD169相比,Toledo毒株基因組DNA具有一段長達15 kb左右的基因區域(UL133-UL151),可能與HCMV介導的免疫致病機制有關[19]。有研究表明,試驗株如AD169、Towne在試驗過程中已經失去了感染上皮細胞和內皮細胞的能力[20],而臨床株可以彌補這個缺陷[21]。故Toledo在HCMV培養及與抗體研究方面具有一定的優越性。
本研究中gH全基因在大腸桿菌表達系統中無法表達,而去除了信號肽和跨膜區序列的gH基因片段可成功表達。說明信號肽和跨膜區基因序列對蛋白在大腸桿菌中的表達有一定的影響,這與金映紅等研究者的觀點一致[22-25]。此外,誘導溫度和誘導時間可影響蛋白的表達量及表達方式[26]。本試驗在16、25、30、37 ℃分別誘導表達15、9、10、4 h,發現該gH蛋白在25 ℃、誘導表達9 h后,蛋白的表達量最高,故在該條件下進行gH蛋白的表達。表達的gH蛋白均以包涵體的形式存在,且不溶于尿素,故本試驗利用電洗脫方式進行純化[27]。電洗脫純化蛋白方法簡單、純化效率高,蛋白純度可達90%以上,可用于BALB/c小鼠免疫。本試驗每次免疫小鼠的蛋白量為150 μg/只,該免疫量可刺激BALB/c小鼠持續產生免疫應答,且不會產生免疫耐受。在進行5次免疫后,小鼠血清效價達1∶100 000以上,說明gH蛋白具有較好的免疫原性。免疫后的小鼠可用于后期的細胞融合。細胞融合后,為篩選得到可穩定分泌的、專一的抗gH抗體的雜交瘤細胞,進行了4次亞克隆試驗,最終篩選出5株雜交瘤細胞,將其分別命名為8A9、8B4、8C4、8D9和8D12。
利用WB及間接ELISA等試驗鑒定發現,5株抗體均具有良好的免疫反應性,其中8A9、8C4和8D9具有較高的效價和親和力。通過捕獲試驗發現,8A9、8B4、8D9、8D12可捕獲HCMV Toledo,說明這4種抗體與HCMV Toledo有較好的親和力,為后續檢測抗體的中和能力奠定了基礎,同時也說明這4種抗體具有應用于HCMV診斷的潛力。鑒于8D9、8D12捕獲能力較強,后續將利用病毒中和試驗和阻斷試驗,檢測這2種抗體能否中和病毒、阻斷HCMV在細胞間傳播,從而進一步完善抗體的性質,以便為中和抗體的篩選提供原材料。

