高效液相色譜法同時測定香灰菌發酵液中L-苯丙氨酸和2-苯基乙醇
,,*
(1.福建農林大學食品科學學院,福建福州 350002;2.福建農林大學菌物研究中心,福建福州 350002)
2-苯基乙醇是一種玫瑰香型的風味物質,世界每年產量約10000噸[1],有抑菌、抗腫瘤、強心的作用[2-4];它還是合成一些高附加值藥物比如苯乙醇苷的底物,故2-苯基乙醇在醫藥衛生領域也有重要應用[5]。除此之外,2-苯基乙醇作為香味物質在飲料[6]、香水以及化妝品[7]中應用較多。天然2-苯基乙醇可以在玫瑰花瓣中提取得到,但是成本過高,得率較低[8-9],因此目前主要通過化工合成的方式來獲得,由于化工合成的過程中會含有苯類以及乙烯類有毒有害物質,添加到食品中會對食品安全造成一定的威脅[10-11],因此生物合成2-苯基乙醇的方式成為當今研究的熱點。
目前發現生物合成2-苯基乙醇的方式是利用釀酒酵母的艾里希通路(Ehrlich pathway),通過L-苯丙氨酸生物轉化合成2-苯基乙醇或者利用碳源從頭合成[12-13],也可以通過基因工程[14-15]、酵母菌株雜交[16]、原位產物提取[17]等方法來提高2-苯基乙醇的生物合成量。除此之外,發現香灰菌也可以利用L-苯丙氨酸生物轉化合成2-苯基乙醇。經鑒定,香灰菌(Hypoxylon sp.)為子囊菌亞門碳團菌屬的真菌[18-20],是銀耳的伴生菌[21],只有與香灰菌共生培養時才有生長能力[22-23]。為了研究香灰菌如何利用L-苯丙氨酸生物合成香味物質2-苯基乙醇,建立一種準確的檢測香灰菌發酵液中L-苯丙氨酸和2-苯基乙醇含量的方法尤為重要。
目前L-苯丙氨酸的檢測方法主要有GSP分析儀和試劑盒等方法,主要應用于醫療臨床研究,尤其是在新生兒干燥血片苯丙氨酸的含量與新生兒胎齡體重的關系方面[24-26],針對發酵液中L-苯丙氨酸含量的檢測目前報道不多。發酵液中2-苯基乙醇的檢測方法目前有紫外分光光度法[27]、氣相色譜分析法[28-29]以及氣質聯用法[30],同時檢測發酵液中2-苯基乙醇和L-苯丙氨酸含量的相關研究較少。劉東亞等[31]利用高效液相色譜法對酵母菌發酵液進行了檢測,將該檢測方法應用于香灰菌發酵液的檢測時,發現存在以下問題:一方面,L-苯丙氨酸出峰較早,不能很好的與雜峰分離;另一方面,L-苯丙氨酸解離容易形成拖尾峰,這些均影響結果的準確度,此外流動相甲醇∶水=1∶1會導致柱壓較高,對色譜柱和儀器損傷較大。
鑒于以上問題,本文擬建立一種新的同時檢測香灰菌發酵液中L-苯丙氨酸和2-苯基乙醇的方法,通過改變不同時間段流動相的配比,以期使L-苯丙氨酸和2-苯基乙醇與雜質峰分離,并且使L-苯丙氨酸和2-苯基乙醇分離開來,實現一個樣本同時對兩種物質進行檢測;另外,流動相中加入弱酸,擬解決L-苯丙氨酸峰拖尾問題,為今后香灰菌生物轉化合成2-苯基乙醇的研究和開發提供依據。
1 實驗材料與方法
1.1 材料與儀器
2-苯基乙醇標準品 純度>99.5%,阿拉丁試劑(上海)有限公司;L-苯丙氨酸標準品 純度>99%,上海麥克林生化科技有限公司;甲醇 色譜純,默克化工技術(上海)有限公司;超純水 電導率18.25 MΩ;PDA培養基 馬鈴薯200 g/L,葡萄糖20 g/L,瓊脂20 g/L,水1000 mL;發酵培養基 馬鈴薯200 g/L,葡萄糖20 g/L,L-苯丙氨酸4 g/L,水1000 mL。
LC20AD高效液相色譜儀配可變波長紫外檢測器、Inert Sustain C18色譜柱 島津公司;SB25-12DTDN超聲波清洗 寧波新芝生物科技有限公司;LE104E/02分析天平 METTLER TOLEDO,精度0.1 mg;有機系0.45 μm微孔過濾膜 津騰;ZQTY-70N恒溫搖床 上海知楚儀器有限公司。
1.2 實驗方法
1.2.1 實驗溶液的配制
1.2.1.1 標準儲備液的制備 準確稱取0.5 g L-苯丙氨酸,用移液槍吸取0.5 mL 2-苯基乙醇(ρ=1.02 kg/L),用0.6%的乙酸溶液將L-苯丙氨酸和2-苯基乙醇定容于50 mL容量瓶中,配制成標準混合儲備液,其中L-苯丙氨酸的濃度為10 g/L,2-苯基乙醇的濃度為10.2 g/L。
1.2.1.2 標準工作溶液的制備 于5只10 mL容量瓶中分別加入1、2、3、4、5 mL標準混合儲備液,并用0.6%的乙酸溶液定容,得到濃度梯度為1、2、3、4、5 g/L的L-苯丙氨酸和濃度梯度為1.02、2.04、3.06、4.08、5.10 g/L的2-苯基乙醇標準混合液,標準混合液過0.22 μm有機系微孔濾膜后待上機檢測。
1.2.1.3 香灰菌發酵液樣品的制備 香灰菌菌種在PDA試管培養基上轉接活化2次,將香灰菌菌種用接種針挖取約1 cm3的小塊接種到含有PDA培養基的培養皿中培養4 d,在培養皿同一半徑上用直徑0.5 cm的打孔器打孔制備菌種塊,接種至含有100 mL發酵培養基的三角瓶中,每瓶接種兩塊,置于28 ℃恒溫搖床中,以160 r/min的振蕩速度培養6 d,將發酵液4000 r/min離心10 min,取上清液0.22 μm尼龍微孔濾膜過濾,濾液即為香灰菌發酵液樣品,待上機檢測。
1.2.2 液相色譜條件 色譜柱:C18(5 μm,250 mm×4.6 mm);柱溫30 ℃;進樣量10 μL;流速0.7 mL/min;DAD檢測器,檢測波長258 nm;流動相A:0.6%乙酸水溶液;流動相B:甲醇,流動相洗脫梯度見表1。
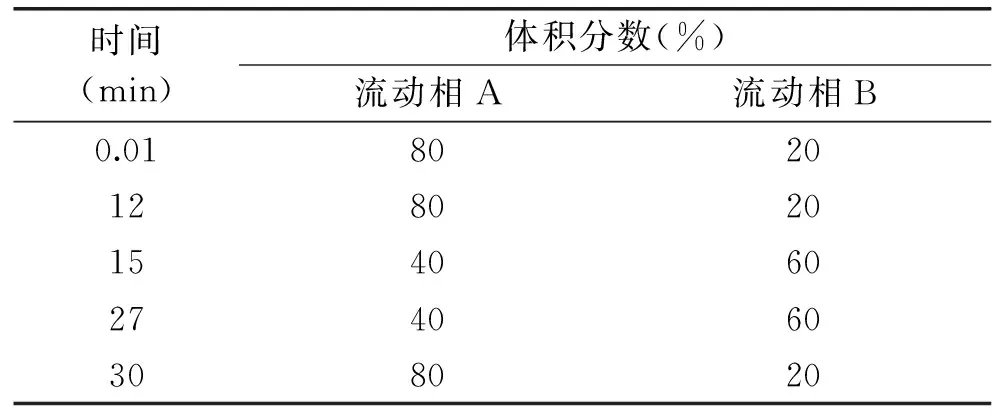
表1 流動相梯度洗脫條件Table 1 Gradient elution conditions of mobile phase
1.3 數據處理
實驗數據統計分析采用SPSS 17.0,色譜采集及處理采用島津液相色譜儀配套的LC Solution色譜處理系統。
2 結果與分析
2.1 流動相以及流動相成分的優化
分別以乙腈和甲醇作為流動相的有機相部分進行了實驗,結果表明,兩種溶液對L-苯丙氨酸以及2-苯基乙醇的分離效果相似,考慮到成本問題,選擇甲醇作為流動相的有機相部分。分別配制了20 mmol/L的磷酸二氫鉀、磷酸二氫銨、磷酸二氫鈉以及1%(V/V)的乙酸溶液作為流動相無機相部分進行了實驗,結果如圖1所示,發現四種溶液均可出現較好的峰型,無拖尾峰形成,考慮到磷酸鹽溶液在色譜柱中純甲醇的環境下容易析出導致色譜柱堵塞,最終選用乙酸溶液作為流動相。
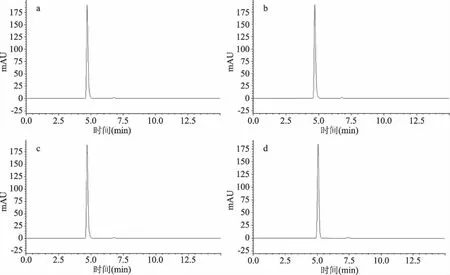
圖1 不同種類磷酸鹽水溶液以及乙酸水溶液色譜圖Fig.1 Chromatograms of different kinds of phosphate aqueous solutions and acetic acid aqueous solutions注:a:20 mmoL/L(M/V)磷酸二氫鉀;b:20 mmoL/L(M/V)磷酸二氫銨;c:20 mmoL/L(M/V)磷酸二氫鈉;d:1%(V/V)的乙酸。
同時分別以純水、0.3%、0.6%、0.9%的乙酸溶液作為流動相無機相部分進一步實驗,結果如圖2所示,發現濃度0.6%、0.9%乙酸溶液均無拖尾峰形成,因此選擇0.6%(V/V)的乙酸溶液作為流動相。

圖2 不同濃度乙酸水溶液色譜圖Fig.2 Chromatogram of different concentration of acetic acid aqueous solution注:a:純水;b:0.3%乙酸水溶液;c:0.6%乙酸水溶液;d:0.9%乙酸水溶液。
2.2 紫外檢測器檢測波長的確定
在200~800 nm進行全波長掃描檢測L-苯丙氨酸和2-苯基乙醇,結果見圖3和圖4,從圖3和圖4可知:L-苯丙氨酸和2-苯基乙醇均在258 nm處有吸收峰,最終選擇紫外檢測波長為258 nm。

圖3 L-苯丙氨酸全波長掃描光譜圖Fig.3 Full wavelength scan image of L-phenylalanine
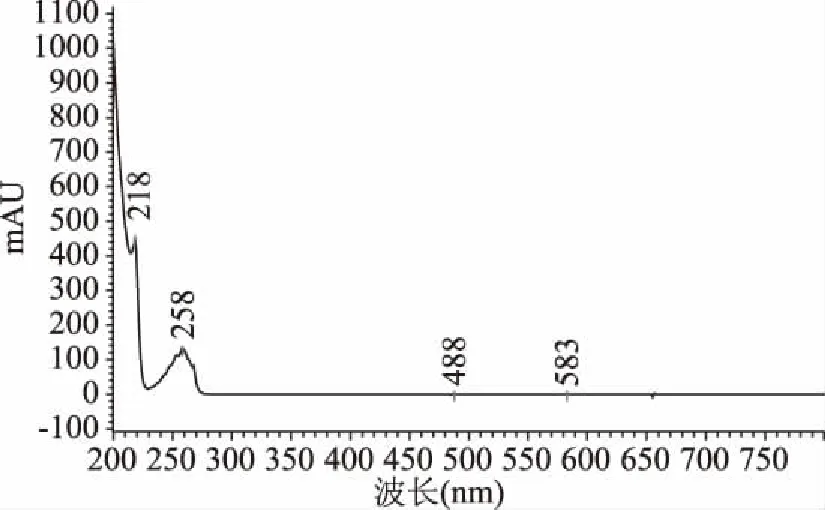
圖4 2-苯基乙醇全波長掃描光譜圖 Fig.4 Full wavelength scan image of 2-phenylethanol
2.3 流速的確定以及方法優化對比實驗
在劉東亞等[31]方法基礎上把流動相無機部分改為0.6%的乙酸水溶液,即以流動相甲醇:0.6%乙酸∶溶液=1∶1,流速1 mL/min,柱溫30 ℃,C18色譜柱(5 μm,250 mm×4.6 mm),進樣量10 μL,在258 nm波長下進行檢測,結果如圖5所示,圖5a為標品色譜圖,圖5b為香灰菌發酵液樣品色譜圖,結果顯示樣品中L-苯丙氨酸分離效果較差,2-苯基乙醇可以分開,但峰形較寬,此時柱壓較高可達17.1 MPa,柱壓較高,不利于儀器的高效穩定運轉,綜上所述,此條件下不能高效準確的同時檢測發酵液樣品中兩種物質的含量。
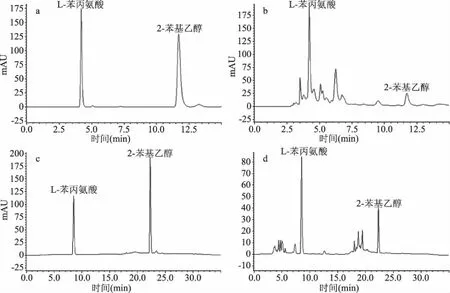
圖5 兩種不同方法檢測色譜圖Fig.5 Chromatograms of two different detect methods注:a:傳統方法標品色譜圖;b:傳統方法樣品色譜圖;c:優化方法標品色譜圖;d:優化方法樣品色譜圖。
鑒于流動相的流速問題,流速較低保留時間較長,分離效果較差。流速過高則柱壓過大,因此對流動相流速0.5、0.6、0.7、0.8、0.9、1.0 mL/min進行了實驗,實驗結果表明:流速0.8、0.9、1.0 mL/min與0.7 mL/min分離效果均較好,考慮流速過快柱壓過高,最終選擇流速為0.7 mL/min。
以1.2.2步驟的液相色譜條件即檢測的最優條件進行檢測,結果如圖5c、5d所示,圖5c為標品色譜圖,圖5d為香灰菌發酵液樣品色譜圖,兩種物質分離效果均較好,且柱壓會隨時間的變化而變化,均小于17.1 MPa,有利于儀器的穩定運行與保養。該方法分離效果好,柱壓低,準確高效,可以很好的同時檢測發酵液中L-苯丙氨酸和2-苯基乙醇的含量。
2.4 實驗方法的驗證
2.4.1 標準曲線、檢出限和定量限 以1.2.1.2步驟配制6個不同濃度梯度的標準溶液,在1.2.2步驟所描述最優色譜條件下進行測定,取3次平行測定的平均值,以標準液6個濃度為橫坐標,峰面積為縱坐標建立標準曲線,以外標法定量,建立線性回歸方程(表2),相關系數均大于0.999,線性關系良好。

表2 線性回歸方程Table 2 Linear regression equation
逐步稀釋標準混合溶液的濃度,上機檢測,結果表明:當L-苯丙氨酸和2-苯基乙醇的峰高為基線噪音高的3倍和10倍時,檢測限分別為1.023和0.567 mg/L,定量限分別為3.409和1.890 mg/L。
2.4.2 方法的加標回收率和精確度 按照1.2.1.3步驟的方法制備發酵液樣品,在其中添加兩種標準品,濃度分別為0.5、1.0、1.5 g/L,在最優色譜條件進行檢測,每個樣品檢測6次,取平均值,得到樣品的檢測量,結果為L-苯丙氨酸和2-苯基乙醇的含量分別是1.023和1.109 g/L。以平均值計算加標回收率和方法的平均標準偏差,如表3所示,加標回收率在98.53%~101.58%之間,由此證明方法的準確度高。平均標準偏差在0.67%~1.22%之間,精確度較高,符合試驗要求。
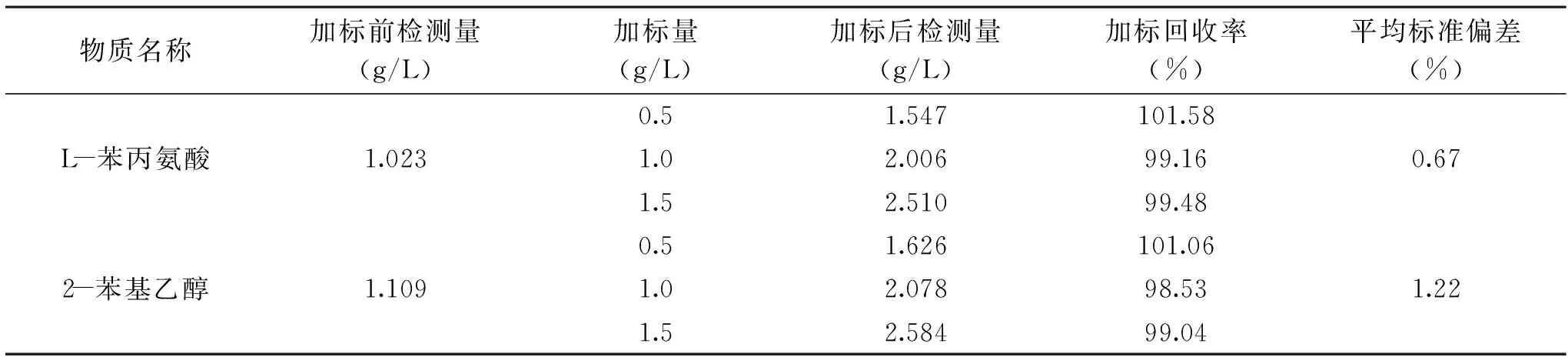
表3 加標回收率測定結果Table 3 Standard recovery measurement results
2.4.3 儀器精密度實驗 取標準品混合液重復檢測6次(表4),結果L-苯丙氨酸和2-苯基乙醇的RSD分別為0.18%和0.31%。由此證明儀器精密度良好。
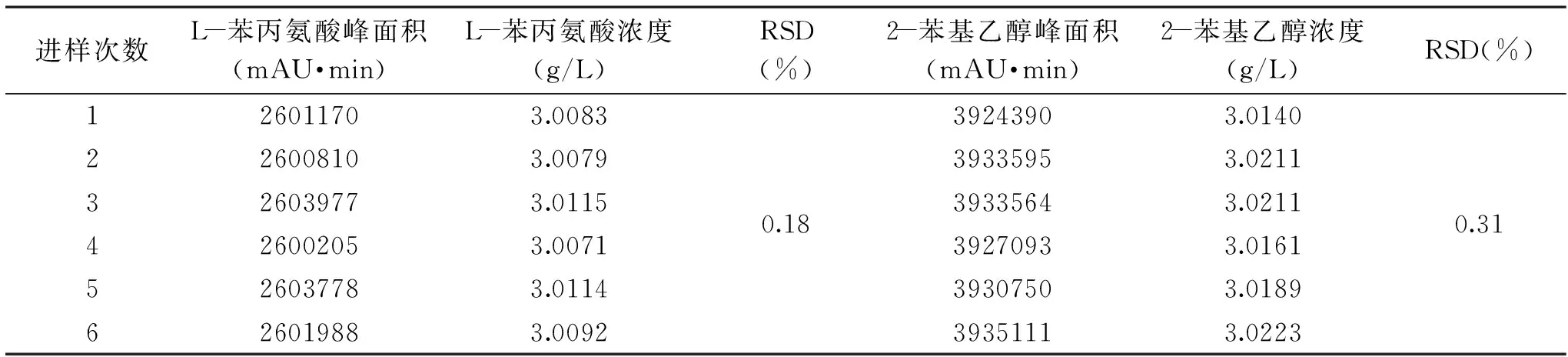
表4 儀器精密度實驗結果Table 4 The test results of instrument precision
2.5 樣品分析結果
在最優色譜條件下對同批次相同條件下培養的6瓶香灰菌發酵液同時測定L-苯丙氨酸和2-苯基乙醇的含量,發酵培養基中L-苯丙氨酸的添加量均為4 g/L,每瓶香灰菌發酵液上機檢測3次取平均值,結果如表5所示,發酵液中2-苯基乙醇的產量較穩定,在1.1153~1.3930 g/L之間,標準差在0.03~0.19之間,重復性良好,實驗誤差小,此方法可以很好的同時測定香灰菌發酵液中L-苯丙氨酸和2-苯基乙醇的含量。
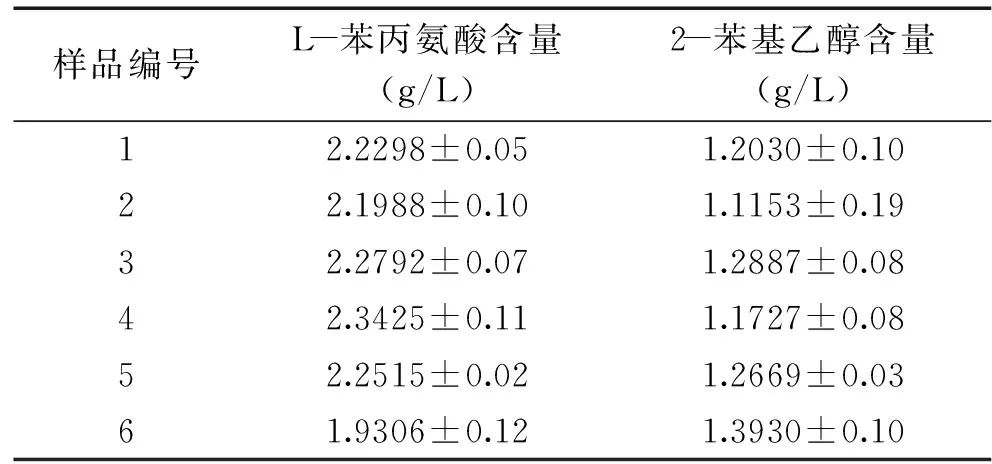
表5 樣品檢測結果Table 5 The test results of samples
3 結論
本文通過優化高效液相色譜法可以同時檢測香灰菌發酵液中的L-苯丙氨酸和2-苯基乙醇的含量,在最優檢測條件下,即色譜柱:C18(5 μm,250 mm×4.6 mm);柱溫30 ℃;進樣量10 μL;流速0.7 mL/min;DAD檢測器,檢測波長258 nm;流動相A:0.6%乙酸水溶液;流動相B:甲醇,流動相梯度洗脫,可以較好的分離目標檢測物,線性關系良好,L-苯丙氨酸加標回收率為99.16%~101.58%,2-苯基乙醇的加標回收率為98.53%~101.06%,L-苯丙氨酸檢出限和定量限分別為1.023和3.409 mg/L,2-苯基乙醇檢出限和定量限分別為0.567和1.890 mg/L。該方法精確度和準確度高,簡單高效,結果穩定,且可以準確高效的同時檢測發酵液中L-苯丙氨酸和2-苯基乙醇的濃度,為利用L-苯丙氨酸生物轉化合成天然香味物質2-苯基乙醇的研究和開發奠定了理論基礎。

