亨氏馬尾藻巖藻聚糖結構鑒定及其對氧化型低密度脂蛋白誘導HMVEC損傷的保護作用
林沛純,諶素華,王維民,劉海韻,黃丹思,楊志強
亨氏馬尾藻巖藻聚糖結構鑒定及其對氧化型低密度脂蛋白誘導HMVEC損傷的保護作用
林沛純1,2,諶素華2,3,王維民2,劉海韻2,黃丹思2,楊志強2
(1. 廣東海洋大學 化學與環境學院,廣東 湛江 524088;2. 廣東海洋大學食品科技學院,廣東 湛江 524088;3. 廣東海洋大學深圳研究院,廣東 深圳 518108)
【】探討4種亨氏馬尾藻巖藻聚糖的結構及其對氧化型低密度脂蛋白誘導HMVEC損傷的保護作用。以亨氏馬尾藻巖藻聚糖(FD1)為原料,過 Sepharose Cl-6B瓊脂糖凝膠柱層析得到組分FS11,對FS11進行化學組成分析和單糖分析,測定F、FD1、FS1、FS11等4種巖藻聚糖的相對分子質量、糖鏈構象和紅外光譜,進行結構鑒定;采用MTT法測定3種巖藻聚糖對HMVEC存活率的影響,研究4種巖藻聚糖對氧化型低密度脂蛋白誘導HMVEC損傷的保護作用。與F、FD1、FS1比,FS11硫酸基和多糖含量最高。FS11中巖藻糖含量高達52.744%;F、FD1、FS1、FS11的相對分子質量分布分別為474 576、459 032、201 285、190 049;I-KI紫外掃描和剛果紅實驗表明巖藻聚糖具有復雜樹狀分支和多股螺旋結構;紅外光譜結果表明各組分均有O—H、C—H多糖特征官能團、S==O活性特征官能團;加藥培養24 h,質量濃度為500 μg/mL和1 000 μg/mL的4種巖藻聚糖(F、FD1、FS1、FS11)均能顯著減弱受氧化型低密度脂蛋白損傷的HMVEC的增殖抑制(<0.01)。尾藻巖藻聚糖對氧化型低密度脂蛋白誘導的HMVEC損傷具有保護作用。
亨氏馬尾藻;巖藻聚糖;結構鑒定;誘導損傷;HMVEC
馬尾藻()屬褐藻門(Phaeophyta)、墨角藻目(Fucales)、馬尾藻科(Sargassaceae)、馬尾藻屬()。我國馬尾藻種類繁多,資源豐富,但開發利用的程度較低[1]。馬尾藻中多糖含量豐富,其特征多糖巖藻聚糖為高度吸濕性多
糖[2],最早由Kylin在二十世紀初提出并命名[3]。研究發現巖藻聚糖具有抗腫瘤、抗炎、抗菌、抗氧化、抗凝血等多種活性[4-10],目前關于巖藻聚糖結構研究已有重要突破。Gerbst[11]發現巖藻聚糖中存在α糖苷鍵,Bilan[12]在2010年提出3種巖藻聚糖結構并初步確定硫酸基的位置,黃桂華[13]采用核磁共振(NMR)、高效液相色譜(HPLC)、傅氏轉換紅外線光譜分析(FTIR)等方法研究巖藻聚糖的結構。馬尾藻巖藻聚糖主要成分是L-巖藻糖和硫酸根[14],其結構特性對生物活性和藥物作用有很大影響[15]。
目前,對于巖藻聚糖抗血栓活性的研究多集中在海帶()[13]上,關于馬尾藻巖藻聚糖抗血栓活性的研究甚少。本課題組劉海韻[16]采用 DEAE-52 和 Sepharose CL-6B 柱層析法制得不同馬尾藻巖藻聚糖組分,發現其對小鼠黑尾血栓有較好的抑制效果,但是其體外抗血栓的機制尚不清楚。本研究采用Sepharose CL-6B瓊脂糖凝膠柱層析法對亨氏馬尾藻進行分離純化,得到馬尾藻巖藻聚糖,對其進行結構鑒定,并通過使用氧化型低密度脂蛋白誘導HMVEC損傷,研究馬尾藻巖藻聚糖對HMVEC的保護作用,為深入研究馬尾藻巖藻聚糖對HMVEC的保護作用和抗血栓的作用機制提供實驗數據和理論依據。
1 材料與方法
1.1 材料與試劑
亨氏馬尾藻,采自廣東省湛江市硇洲島附近海域,經清洗、曬干、粉碎得到粉末。對粉末采用超聲波輔助水提法,經過二次醇沉、脫蛋白和去脂肪得到組分F,將F分別采用DEAE-52、Sepharose CL-6B柱層析法得到組分FD1和FS1。F、FD1和FS1的化學組成和單糖組成參見文獻[16]。
人肺微血管內皮細胞(HMVEC)購自北納創聯生物技術有限公司。DEAE-52纖維素購自北京鼎國昌盛生物技術有限公司;PBS緩沖液、DMEM高糖基礎培養基、胎牛血清(FBS)、0.25%-EDTA胰酶均購自gibco公司;雙抗(PS)購自Hyclone公司;噻唑藍(MTT)、氧化型低密度脂蛋白、肝素鈉和Sepharose CL-6B瓊脂糖凝膠均購自上海源葉生物科技有限公司。
1.2 儀器與設備
UV-5100紫外可見光光度計,上海元析儀器有限公司;HR/T20MM高速冷凍離心機,湖南赫西儀器裝備有限公司;LDZX-50 KBS立式壓力蒸汽滅菌器,上海申安醫療器械廠;DMI4000B智能型倒置熒光顯微鏡,德國 Leica 公司;Varioskan Flash全自動酶標儀,美國 Thermo 公司。
1.3 實驗方法
1.3.1 馬尾藻巖藻聚糖分離純化 采用Sepharose CL-6B瓊脂糖凝膠柱層析法[16]。用濃度0.1 mol/L的NaCl對FD1進行洗脫,將得到的樣品命名為FS11。
1.3.2 化學組成測定 苯酚硫酸法[17]測定多糖含量;半胱氨酸鹽酸鹽法[18]測定L-巖藻糖含量;明膠比濁法[19]測定硫酸根含量;間羥基聯苯法[9]測定糖醛酸含量。
1.3.3 單糖組成測定 采用高效液相色譜法測定FS11的單糖組成。色譜條件:Agilent 1100高效液相色譜儀;色譜柱為XDB-C18,柱溫為30 ℃,柱流量為1.0 mL/min,以磷酸二氫鉀緩沖液(0.05 mol/L,pH 7.6)/乙腈(體積比83∶17)為流動相,進樣量為10 μL。
1.3.4 相對分子質量分布測定 采用高效液相色譜法測定F、FD1、FS1和FS11的相對分子質量,分別稱取一定量的各相對分子質量葡聚糖標準品,以0.2 mol/L NaCl 為溶劑配制成10 mg/mL的溶液并過濾。水相儀器為PL-GPC 220,檢測器為PL-GPC 50(RI),色譜柱采用PL aquqgel-OH MIXED 8 μm 兩根串聯,以0.2 mol/L NaNO3和0.01 mol/L NaH2PO4為流動相,調整流速為1 mL/min。
1.3.5 多糖糖鏈測定 配置1 mg/mL巖藻聚糖樣品溶液,取2 mL,加入1.2 mL I-KI試劑,混勻后在300 ~ 700 nm波長范圍內掃描,根據掃描結果即可判斷樣品的糖鏈構象。
以蒸餾水為空白對照,向2 mL蒸餾水中加入2 mL剛果紅試劑,混勻,在450 ~ 550 nm波長下進行掃描,記錄最大吸光值所對應的波長;滴加NaOH溶液,使其濃度從0.05 mol/L上升到
0.50 mol/L,同上進行掃描。將5 mg多糖樣品加入2 mL水溶解,加入2 mL剛果紅試劑,混勻,重復以上步驟。以NaOH濃度為橫坐標,樣品最大吸收波長為縱坐標,作圖。將樣品的曲線與剛果紅曲線進行比較。
1.3.6 紅外光譜測定四種巖藻聚糖組分 將溴化鉀用瑪瑙研缽研磨,過孔徑0.147 mm網篩,紅外燈下干燥4 h,以溴化鉀壓成半透明薄片做空白,以樣品與溴化鉀混合制成壓片,在4 000 ~ 400 cm-1范圍內進行掃描[20]。
1.3.7 馬尾藻巖藻聚糖對HMVEC存活影響 選擇匯合度80%以上的HMVEC,用胰酶酶解成細胞懸液,接種到96孔板中,細胞密度為30 000 mL-1。培養24 h,加入質量濃度為62.5、125.0、250.0、500.0、1 000.0、2 000.0 μg/mL的馬尾藻巖藻聚糖溶液(F、FD1、FS1)、空白對照組和質量濃度為50、500、5 000 μg/mL的肝素鈉作為陽性對照組,分別培養24、48、72 h,后進行MTT檢測。96孔板內加入100 μL完全DMEM培養液和20 μL 5 mg/mL MTT溶液,置于培養箱中反應4 h,棄去上清夜,加入150 μL DMSO,在室溫下震蕩10 min,最后于570 nm測值[21],計算HMVEC存活率。
存活率=/0×100%,
式中,為實驗組酶標儀所測量的值,0為空白組所測量的值
1.3.8 氧化型低密度脂蛋白造模濃度與造模時間的確定 根據楊為亞[22]的方法并略做修改。培養細胞至進入對數期,加入質量濃度為6.25、12.50、25.00、50.00、100.00 μg/mL的氧化型低密度脂蛋白溶液和空白對照組,培養12 h,用倒置熒光顯微鏡觀察并記錄細胞生長狀態,參照1.3.7 MTT方法測定值,計算HMVEC存活率。
1.3.9 馬尾藻巖藻聚糖對受氧化型低密度脂蛋白損傷的HMVEC增殖影響 細胞培養12 h后,棄去上清液。加入由完全培養基配制的500 μg/mL和1 000 μg/mL 的F、FD1、FS1、FS11和500 μg/mL肝素鈉,每孔100 μL,培養12 h后,加入100 μL的氧化型低密度脂蛋白溶液造模,培養12 h,按照1.3.8 MTT法測定值,計算HMVEC存活率。
2 結果與分析
2.1 FD1洗脫曲線
FD1的洗脫曲線如圖1。由圖1可得,FD1經過Sepharose Cl-6B凝膠柱之后,除極少量的小分子被分離外,大部分組分集中在一個糖峰,將其命名為FS11。
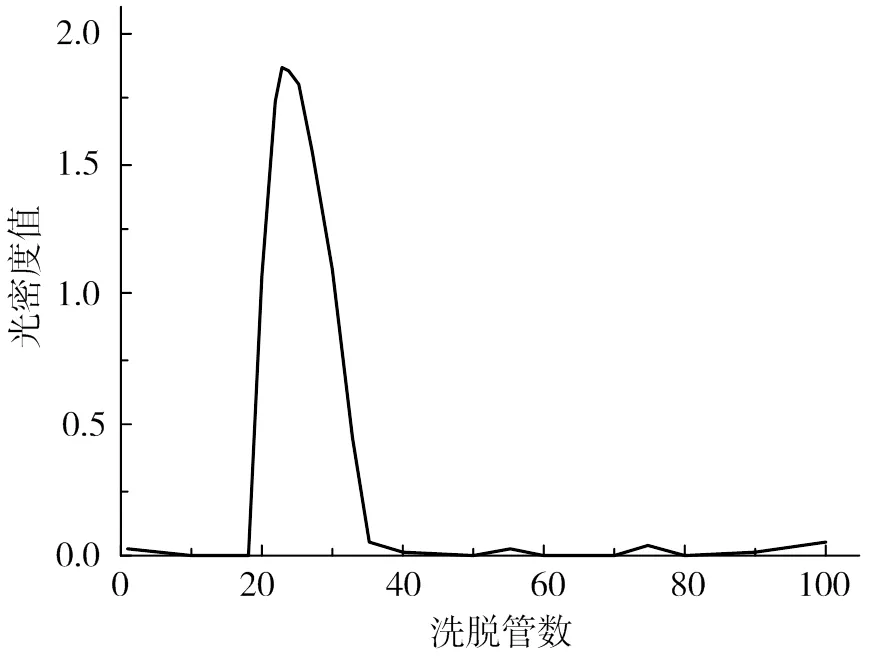
圖1 FD1 Sepharose Cl-6B洗脫曲線
2.2 化學組成分析
組分FS11的化學組成分析結果見表1。與FD1[16]比較,組分FS11的四項化學組成指標均有所提高,分別上升11.514%、2.377%、0.493%、1.177%。與F、FS1比較,FS11多糖含量分別提高16.341%和1.339%,硫酸基含量也提高18.445%和17.889%。
2.3 單糖組成分析
FS11的單糖組成分析結果見表2。表2可知,組分FS11含有阿拉伯糖,含有甘露糖、鼠李糖、葡萄糖、半乳糖、巖藻糖6種單糖,與F、FD1和FS1結果一致。但4種組分中各種單糖的含量存在差異。單糖組成成分與含量取決于來源和提取方法,Lim[23]使用不同的提取方法從不同的海藻中提取的巖藻聚糖單糖組成也不一樣。4個組分均主要由巖藻糖組成,這是巖藻聚糖的主要特征[24],其中,組分FS11的巖藻糖含量超過50%。

表1 FS11化學組分質量分數
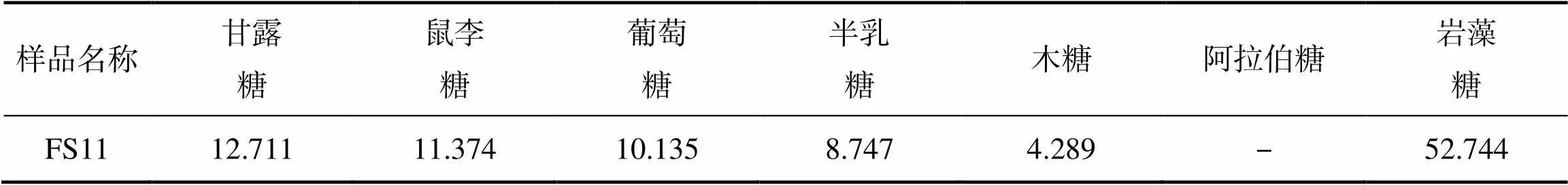
表2 FS11單糖質量分數
2.4 相對分子質量分布
F、FD1、FS1和FS11相對分子質量分布的結果見圖2。
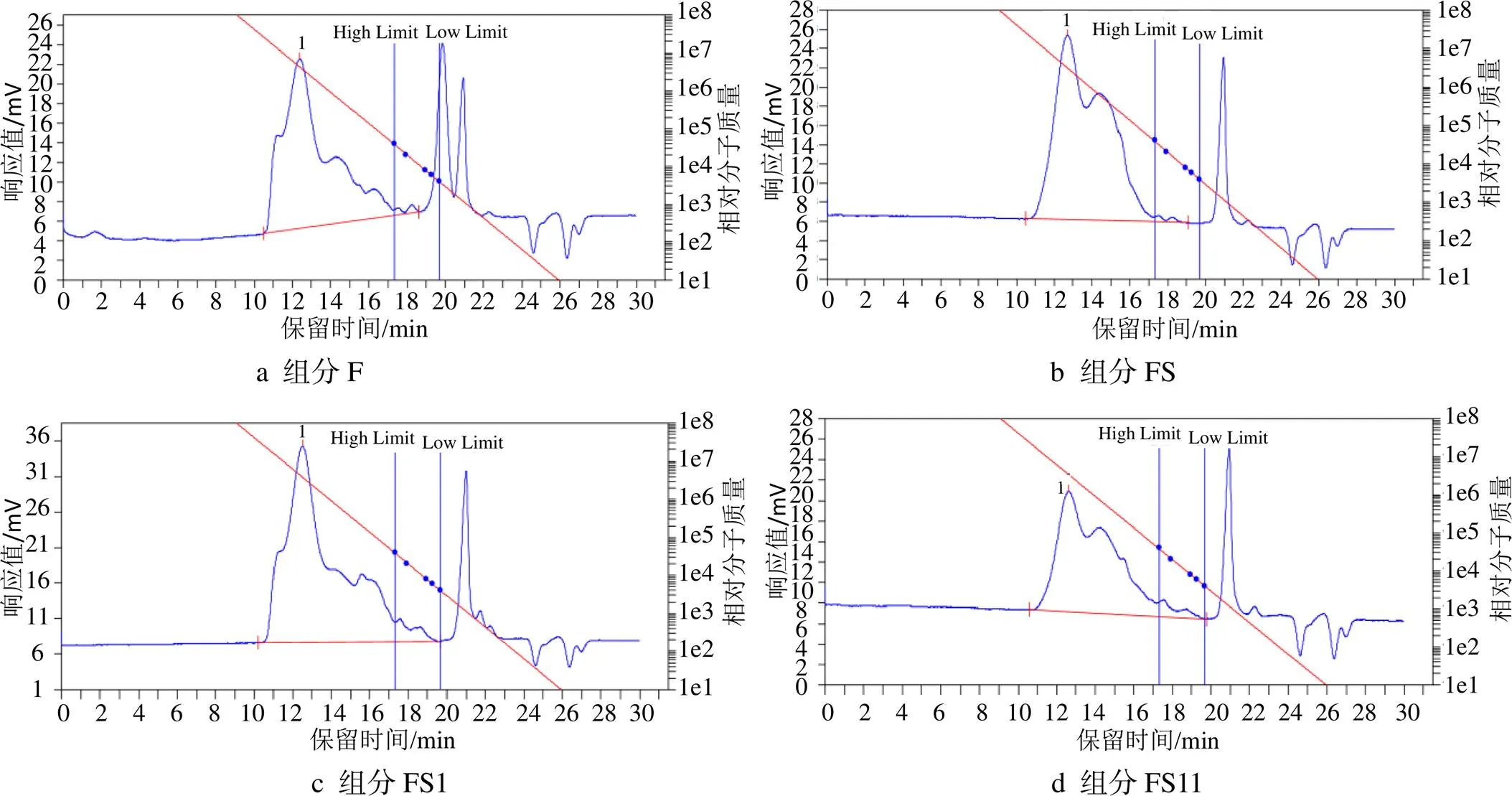
圖2 4種巖藻聚糖相對分子質量洗脫曲線
從圖2中4條洗脫曲線中得出,組分F、FD1、FS1、FS11的洗脫峰值出現的時間分別為12.40、12.70、12.52、12.62 min,計算得到對應組分的重均相對分子質量分別為474 576、459 032、201 285、190 049。分離純化的方法不同,多糖的相對分子質量分布也會不同[25]。通過對比發現,組分FD1的相對分子質量分布比F窄,而F和FD1分別經過Sepharose-Cl 6B瓊脂糖凝膠柱層析后得到FS1和FS11的相對分子質量分布更窄,說明瓊脂糖凝膠對不同分子質量的物質有很好的分離作用。
2.5 糖鏈構象分析
組分F、FD1、FS1、FS11糖鏈的構象分析結果如圖3和圖4。
圖3可看出,各組分均在350 nm處有吸收峰,在500 nm處均無吸收峰,證明了馬尾藻巖藻聚糖的糖鏈構象為較為復雜的支鏈結構,可能含有多個樹狀分支;350 nm處的吸收峰峰型不穩定,但是隨著不斷地分離純化,峰與峰之間的間隔變大,峰型變得較為清晰,證實多糖的純度有所提高。
各個組分的多糖與剛果紅結合后,最大吸收波長與剛果紅相比明顯紅移(圖4)。根據剛果紅可與多股螺旋構象的物質形成配合物從而導致最大吸收波長增大的理論依據,說明剛果紅與粗多糖兩者形成了配合物,并在堿性條件下形成亞穩區,表明馬尾藻巖藻聚糖中存在著多股螺旋構象[26]。
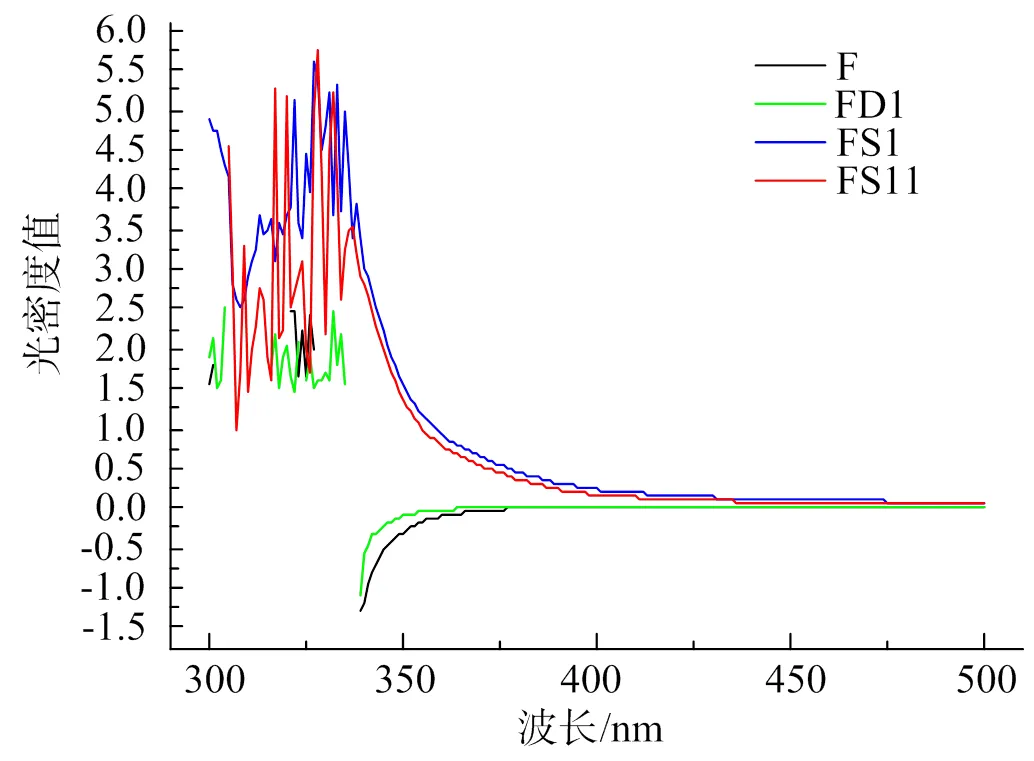
圖3 4種巖藻糖的I-KI紫外掃描
2.6 紅外光譜分析
組分F、FD1、FS1、FS11巖藻聚糖的紅外光譜圖見圖5。
圖5可知,4個組分的紅外光譜圖大致相似,在2 904.7 ~ 2 920.2 cm-1處有C—H伸縮振動形成的尖銳吸收峰,O—H和C—H形成的吸收峰為多糖類物質的特征吸收峰;1 597.0 ~ 1 631.7 cm-1處有C==O伸縮振動峰,FD1和FS11在該處形成的振動吸收峰較強;在1 228.6 ~ 1 238.3 cm-1處有S==O的伸縮振動,S==O為硫酸基的特征基團;在960.5 ~ 964.4 cm-1處有吡喃環末端次甲基產生橫搖振動所形成的小吸收峰;在887.2 ~ 904.6 cm-1處有特征吸收峰,證明多糖組分中含有β糖苷鍵;在806.2 ~ 831.3 cm-1處的特征吸收基團為α糖苷鍵和C—O—S。
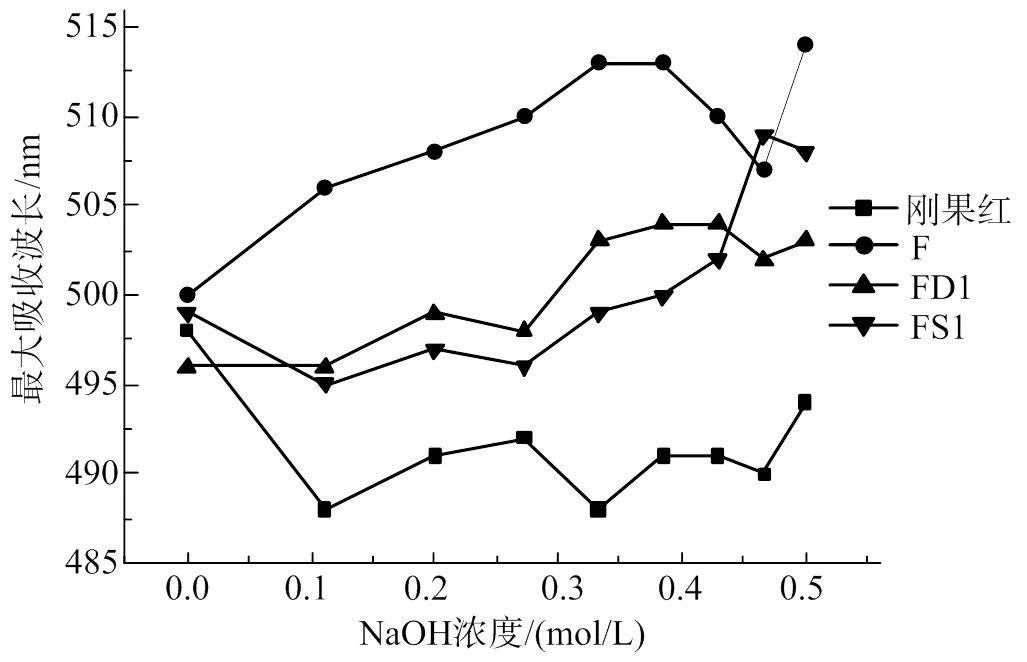
圖4 3種巖藻糖與剛果紅結合后的最大吸收波長變化曲線
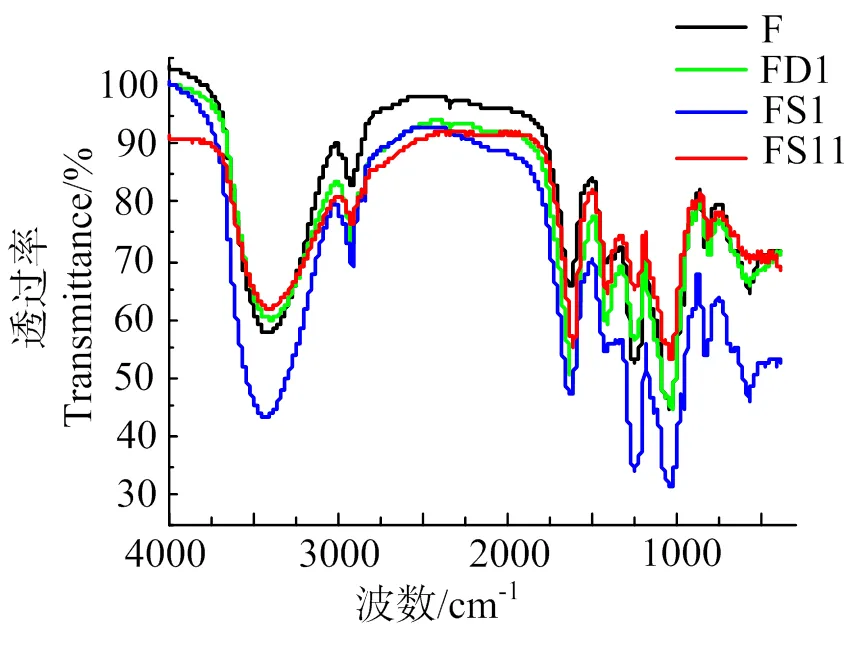
圖5 4種巖藻聚糖紅外光譜
2.7 氧化型低密度脂蛋白造模條件確定
圖6顯示,在造模12 h時,相比于空白組,各濃度組的細胞生長均受到極顯著抑制(< 0.01),HMVEC存活率從最高濃度組(100.00 μg/mL)至最低濃度組(6.25 μg/mL)依次為17.17%、27.94%、39.88%、49.66%、58.41%。本研究選用質量濃度50 μg/mL,作用時間12 h為造模條件。
2.8 馬尾藻巖藻聚糖對HMVEC存活率的影響
馬尾藻巖藻聚糖對HMVEC存活率的影響,結果如圖7和圖8。
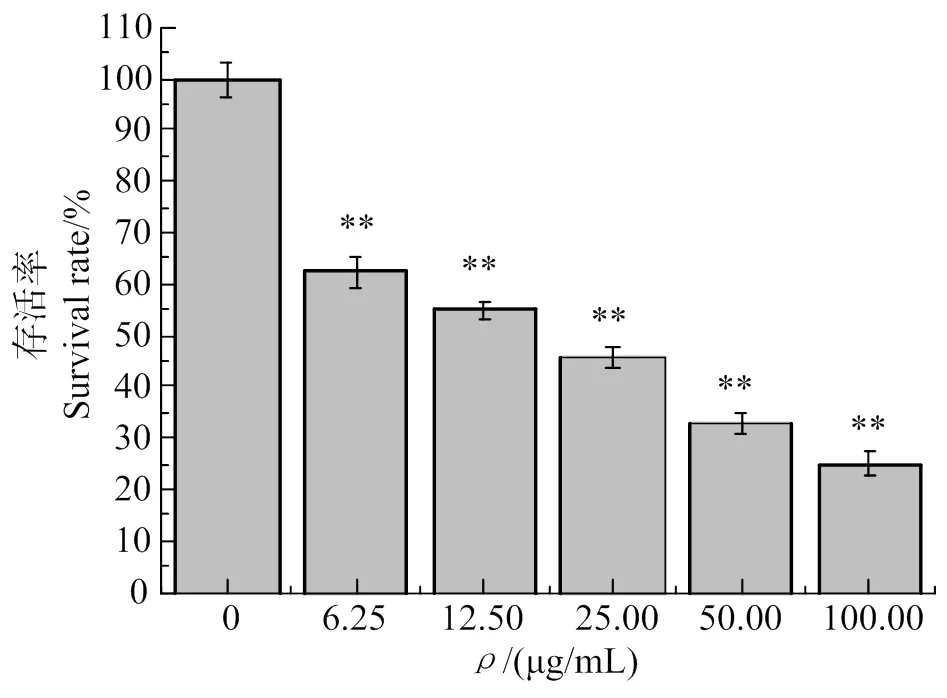
與空白組比較,**表示有極顯著差異,< 0.01。
Compared with the control group, ** indicates a very significant difference,< 0.01.
圖6 不同濃度氧化型低密度脂蛋白對HMVEC存活率的影響
Fig. 6 Effects of different concentrations of oxidized low-density lipoprotein on HMVEC proliferation rate
圖7-a可知,和空白組相比,24 h時各濃度組的存活率均在80%以上,即組分F在24 h對細胞生長沒有抑制作用。圖7-b可看出,隨著組分濃度的增大,3個時間段的細胞存活率呈現出顯著的劑量依賴效應。24 h和48 h低濃度組對HMVEC的存活率影響不顯著(> 0.05)。圖7-c可以看出,24 h和48 h,FS1對HMVEC存活率沒有影響。綜合以上分析,最終選用巖藻聚糖質量濃度500 μg/mL和1 000 μg/mL用于后續實驗,給藥培養時間控制在24 h之內。
圖8可知,中濃度(500 μg/mL)對細胞影響最小,低濃度(50 μg/mL)和高濃度(5 000 μg/mL)在3個時間段里均不同程度的制約細胞增殖。500 μg/mL中濃度組對細胞存活率的影響不顯著(>0.05)。結合上述馬尾藻巖藻聚糖對HMVEC增值的影響分析,決定選擇加藥培養時間24 h,質量濃度為500 μg/mL,肝素鈉的濃度確定與廖敏[27]實驗結果一致。
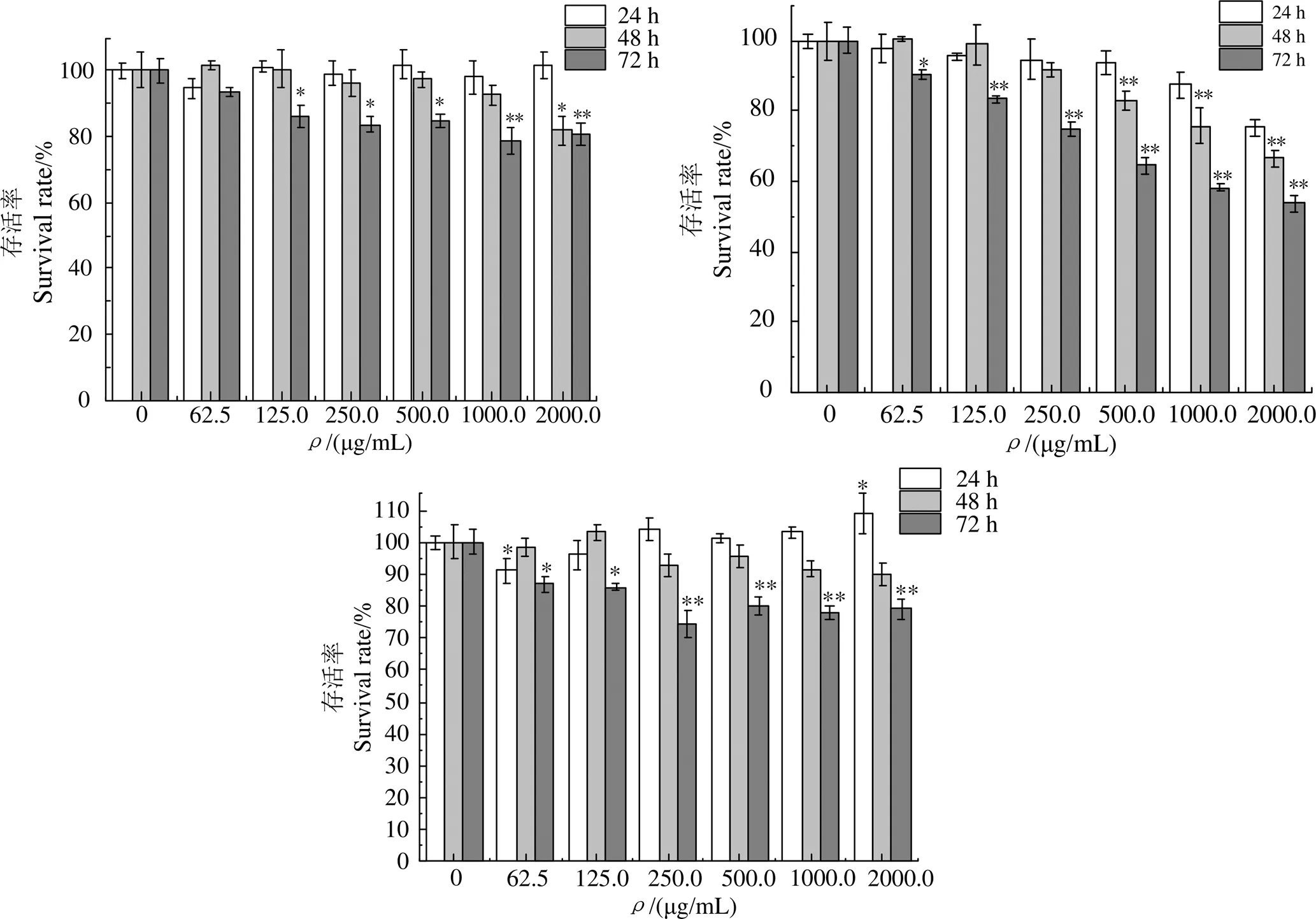
與空白組比較,*表示有顯著差異,P < 0.05; **表示有極顯著差異,P < 0.01。
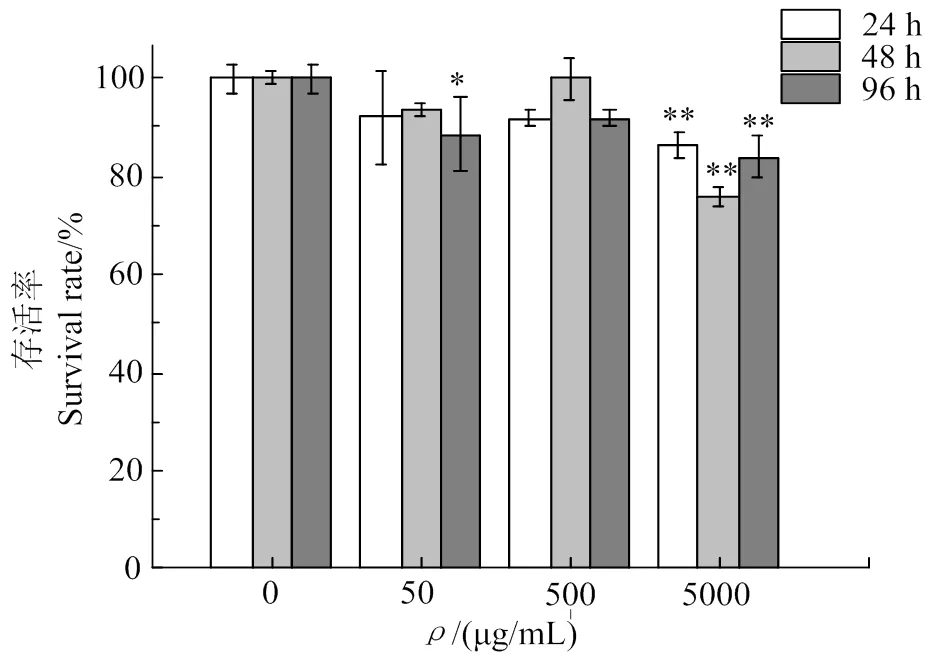
與空白組比較,*表示差異顯著,< 0.05; **表示差異極顯著,< 0.01。
Compared with the control group, *indicates a significant difference,< 0.05, ** indicates a very significant difference,< 0.01.
圖8 不同濃度的肝素鈉對HMVEC存活率的影響
Fig. 8 Effects of different concentrations of sodium heparin on the survival rate of HMVEC
2.9 馬尾藻巖藻聚糖對受氧化型低密度脂蛋白損傷的HMVEC增殖影響
馬尾藻巖藻聚糖對受氧化型低密度脂蛋白損傷的HMVEC增殖的影響,結果見表3。
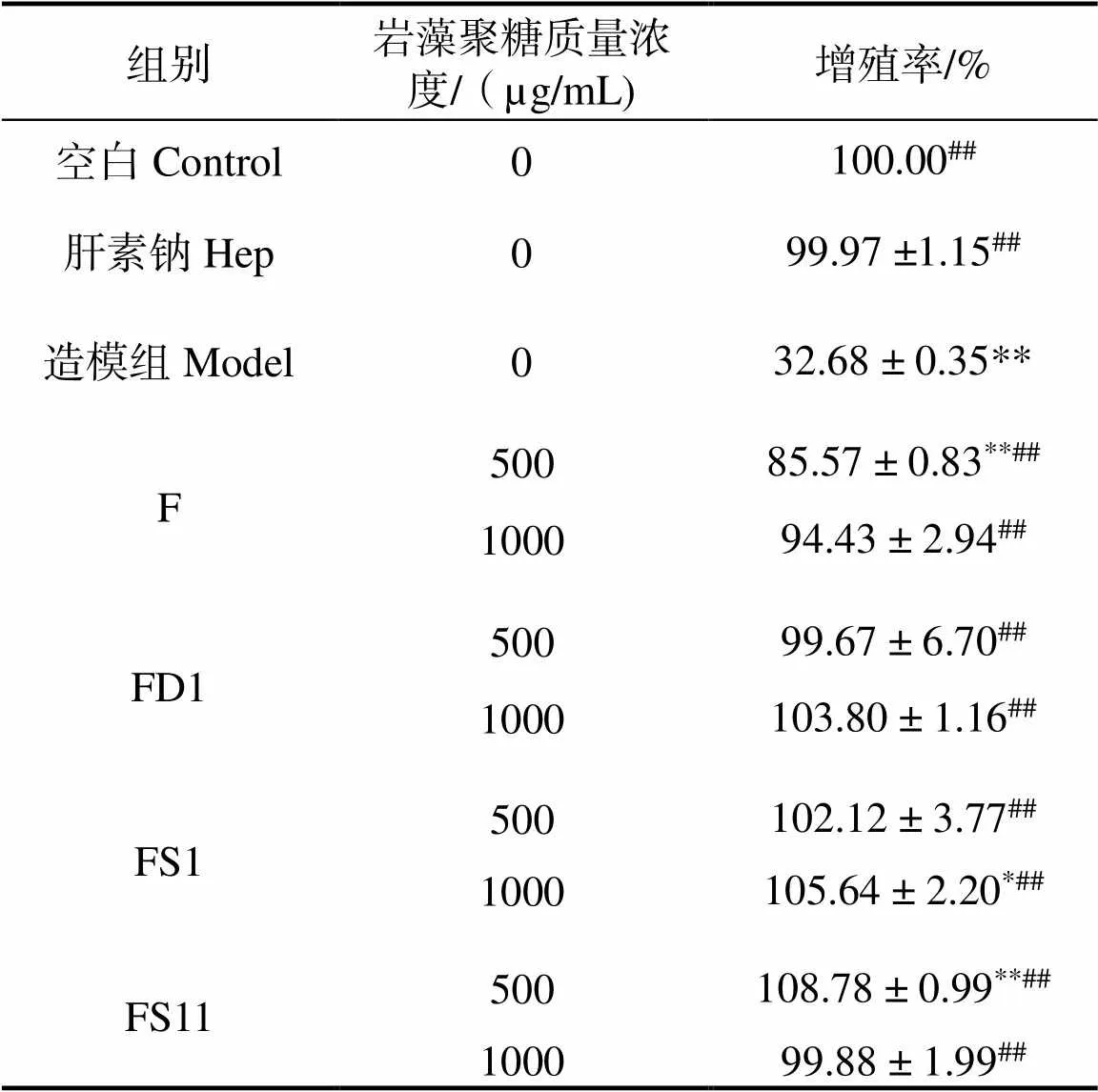
表3 馬尾藻巖藻聚糖對氧化型低密度脂蛋白損傷的HMVEC增殖影響
注:與空白組比較,*表示差異顯著,< 0.05;**表示差異極顯著,< 0.01;與造模組比較,#表示差異顯著,< 0.05;##表示差異極顯著,< 0.01
Note: Compared with the control group, *indicates a significant difference,< 0.05 ** indicates a very significant difference,< 0.01.Compared with the model group,#indicates a significant difference,< 0.05##indicates a very significant difference,< 0.01.
表3可得,與空白組相比,造模組增殖率最小(< 0.01),500 μg/mL FS11對HMVEC的保護作用最強(< 0.01),其次是1 000 μg/mLFS1(< 0.05)。與造模組比較,其他組分增殖率均顯著性提高(< 0.01),說明馬尾藻巖藻聚糖對HMVEC有保護作用。當4種組分質量濃度為500 μg/mL時,保護能力從強到弱依次是FS11、FS1、FD1、F。當巖藻聚糖濃度較低時,其相對分子質量分布會影響對HMVEC的保護作用。Lu等[28]發現低相對分子質量分布對乳腺癌細胞增殖的抑制作用強于高相對分子質量。Huang等[29]發現硫酸基含量高的巖藻聚糖比含量低的清除自由基的能力更強。硫酸基和巖藻糖的高含量,可能會產生高密度負電荷的特定序列,這會增強巖藻聚糖的抗凝血和抗血栓形成活性[30]。Ben等[31]研究發現,巖藻糖殘基的高硫酸化含量賦予該多糖重要抗凝血作用,FS11硫酸基團高達30%,這可能與其對損傷的HMVEC保護作用強有關。與肝素鈉組比較,1 000 μg/mL FD1、500和1 000 μg/mL FS1、500 μg/mLFS11對細胞的保護作用強于陽性對照組Hep。
3 討論
本研究采用Sepharose Cl-6B瓊脂糖凝膠對FD1進一步純化,得到組分FS11。FS11是一種復雜的硫酸多糖,包含有阿拉伯糖,含有甘露糖、鼠李糖、葡萄糖、半乳糖、巖藻糖,硫酸基團和糖醛酸。分離純化后FS11多糖含量高達80.276%,高于課題組前期提取的巖藻聚糖(F、FD1、FS1)[16]。F、FD1、FS1、FS11的主要差異表現在化學組成、分子質量分布和單糖組成。單糖組成、I-KI和剛果紅實驗結果進一步證實,亨氏馬尾藻巖藻聚糖含有6種單糖,具有復雜的支鏈結構和多股螺旋構象。紅外光譜表明,除多糖的特征性官能團O—H、C—H外,巖藻聚糖還含有諸如S==O、次甲基等活性官能團,主要糖鍵的鍵型為β糖苷鍵和α糖苷鍵。
在正常生理狀態下,血管內皮細胞具有抑制血栓形成的功能,一旦內皮細胞受損或者被激活,其正常功能出現異常,這是導致血栓形成的首位因素[32]。潘君枝[33]研究發現,丁苯酚可以通過調控細胞因子的分泌,改善血管內皮細胞,從而抑制血栓形成。氧化型低密度脂蛋白是一種對人體有害的膽固醇,可以導致動脈粥樣硬化[34],從而激發血栓的形成。因此,本研究選擇HMVEC作為研究對象,采用氧化型低密度脂蛋白來誘導細胞損傷。肝素鈉是傳統的抗凝藥物,它是通過抑制Xa因子活性,從而抑制凝血和血栓形成[35],本研究采用它作為陽性對照。本研究發現F、FD1、FS1、FS11四種巖藻聚糖均對HMVEC有保護作用,其中質量濃度500 μg/mL的FS11和1 000 μg/mL的FS1保護作用最強。FS1與FS11的相對分子質量分布相差很小,但FS1的巖藻糖含量高于FS11 ,FS11的硫酸基團含量高于FS1。有報道稱巖藻聚糖的活性可能與巖藻糖和硫酸基團的比例相關[16],巖藻聚糖的濃度可能也與其保護作用有關。本研究發現巖藻聚糖具有保護損傷的HMVEC,但其對血管內皮細胞的作用機制尚需進一步研究。
4 結論
F、FD1 、FS1和FS11這4種巖藻聚糖組分中,FS11純度最高,其巖藻糖含量和多糖含量最高。亨氏馬尾藻巖藻聚糖的結構特征為具有多股螺旋構象且含有較長側鏈和樹狀分支的復雜多糖。通過比較 F、FD1、FS1和FS11的化學組成、單糖組成、分子量分布、紅外光譜和糖鏈構象,發現巖藻聚糖對損傷的HMVEC保護作用與其多糖含量、巖藻糖含量、硫酸基含量、單糖組成、相對分子質量有密切關聯。本研究結果表明巖藻聚糖能夠有效保護氧化型低密度脂蛋白損傷的HMVEC,且純度最高的組分FS11在濃度為500 μg/mL時,保護作用最強。
[1] 黃冰心, 丁蘭平, 譚華強, 等. 我國沿海馬尾藻屬()的物種多樣性及其區系分布特征[J]. 海洋與湖沼, 2013, 44(1): 69-76.
[2] CUI K Y, TAI W J, SHAN X D, et al. Structural characterization and anti-thrombotic properties of fucoidan from[J]. International Journal of Biological Macromolecules, 2018, 120(Pt B): 1817-1822.
[3] KYLIN H. Biochemistry of sea algae[J]. Phys Chem, 1913, 83:171-197.
[4] WU S Y, ZHANG X, LIU J, et al. Physicochemical characterization offucoidan fractions and their antagonistic effect against P-selectin-mediated cell adhesion[J]. International Journal of Biological Macromolecules, 2019, 133: 656-662.
[5] FAN S R, ZHANG J F, NIE W J, et al. Antitumor effects of polysaccharide from,, against human hepatocellular carcinoma HepG2 cells[J]. Food and Chemical Toxicology, 2017, 102: 53-62.
[6] LI Y T, CHEN B J, WU W D, et al. Antioxidant and antimicrobial evaluation of carboxymethylated and hydroxamated degraded polysaccharides from[J]. International Journal of Biological Macromolecules, 2018, 118: 1550-1557.
[7] NARAYANI S S, SARAVANAN S, RAVINDRAN J, et al. In vitro anticancer activity of fucoidan extracted fromagainst Caco-2 cells[J]. International Journal of Biological Macromolecules, 2019, 138: 618-628.
[8] LIU J, WU S Y, CHEN L, et al. Different extraction methods bring about distinct physicochemical properties and antioxidant activities offucoidans[J]. International Journal of Biological Macromolecules, 2020, 155: 1385-1392.
[9] BORAZJANI N J, TABARSA M, YOU S G, et al. Purification, molecular properties, structural characterization, and immunomodulatory activities of water soluble polysaccharides from[J]. International Journal of Biological Macromolecules, 2017, 109: 793-802.
[10] OBLUCHINSKSYA E D, MAKAROVA M N, POZHARITSKAYA O N, et al. Effects of ultrasound treatment on the chemical composition and anticoagulant properties of dry Fucus extract[J]. Pharmaceutical Chemistry Journal, 2015, 49(3): 183-186.
[11] GERBST A G, GRACHEV A A, USTYUZHANINA N E, et al. The Synthesis and NMR and conformational studies of fucoidan fragments: VI.1 Fragments with an α(1→2)-linked fucobioside unit[J]. Russian Journal of Bioorganic Chemistry, 2004, 30(2): 137-148.
[12] BILAN M I, GRACHEV A A, SHASHKOV A S, et al. Further studies on the composition and structure of a fucoidan preparation from the brown alga[J]. Carbohydrate Research, 2010, 345(14): 2038-2047.
[13] 黃桂華. 高純度海帶巖藻聚糖的制備及其生物活性研究[D]. 泉州:華僑大學, 2018.
[14] 諶素華, 王維民, 劉輝, 等. 亨氏馬尾藻巖藻聚糖硫酸酯提取工藝的研究[J]. 食品工業科技, 2011, 32(8): 269-272.
[15] WU L, SUN J, SU X T, et al. A review about the development of fucoidan in antitumor activity: Progress and challenges[J]. Carbohydrate Polymers, 2016, 154:96-111.
[16] 劉海韻, 王維民, 諶素華, 等.馬尾藻巖藻聚糖分離純化及其對小鼠黑尾血栓的效果[J]. 食品科學, 2019, 41(9): 91-97.
[17] 陳鳳, 趙萬嶺, 王星儀, 等. 苯酚-硫酸法測定明日葉根中多糖含量[J]. 化工管理, 2019(26): 11-13.
[18] DAVID G. Methods of biochemical analysis[M]. California Interscience Publishers, 1954: 279-311.
[19] 吳元鋒, 李亞飛, 劉士旺, 等. 裙帶菜中褐藻糖膠的提取純化及其組成的研究[J].農業工程學報, 2008, 24(6): 273-276.
[20] HUANG C Y, KUO J M, WU S J, et al. Isolation and characterization of fish scale collagen from tilapia (sp.) by a novel extrusion-hydro-extraction process[J]. Food Chemistry, 2016, 190: 997-1006.
[21] WAN Y, YANG Z Q. LncRNA NEAT1 affects inflammatory response by targeting miR-129-5p and regulating Notch signaling pathway in epilepsy[J]. Cell Cycle, 2020, 19(4):419-431.
[22] 楊為亞, 楊林. 紅芪多糖對氧化低密度脂蛋白誘導人腦微血管內皮細胞氧化損傷模型保護作用機制分析[J]. 四川中醫, 2018, 36(1): 60-63.
[23] JOE L S, MUSTAPHA W A W, MASKAT M Y, et al. Characterisation of fucoidan extracted from Malaysian[J]. Food Chemistry, 2016, 209: 267-273.
[24] ALE M T, MIKKELSEN J D, MEYER A S. Important determinants for fucoidan bioactivity: A critical review of structure–function relations and extraction methods for fucose-containing sulfated polysaccharides from brown seaweeds[J]. Marine Drugs, 2011, 9(10): 2106-2130.
[25] VAN WEELDEN G, BOBI?SKI M, OK?A K, et al. Fucoidan structure and activity in relation to anti-cancer mechanisms[J]. Marine Drugs, 2019, 17(1): 32.
[26] 徐雅琴, 杜明陽, 楊露, 等. 超聲波處理對黑加侖果實多糖性質與生物活性的影響[J]. 食品科學, 2019, 40(15): 148-153.
[27] 廖敏.不同分子量馬尾藻巖藻聚糖硫酸酯對血栓及血管內皮細胞作用的研究[D]. 湛江: 廣東海洋大學, 2017.
[28] LU J, SHI K K, CHEN S P, et al. Fucoidan extracted from the new zealand: physicochemical comparison against five other fucoidans: unique low molecular weight fraction bioactivity in breast cancer cell lines[J]. Marine Drugs, 2018, 16(12): 461.
[29] HUANG C Y, WU S J, YANG W N, et al. Antioxidant activities of crude extracts of fucoidan extracted fromby a compressional-puffing- hydrothermal extraction process[J]. Food Chemistry, 2016, 197(Pt B): 1121-1129.
[30] MOURAO P A S. Use of sulfated fucans as anticoagulant and antithrombotic agents: future perspectives[J]. Current Pharmaceutical Design, 2004, 10(9): 967-981.
[31] MANSOUR M B, BALTI R, YACOUBI L, et al. Primary structure and anticoagulant activity of?fucoidan from the sea cucumber[J]. International Journal of Biological Macromolecules, 2019, 121: 1145-1153.
[32] 彭黎明, 唐寧. 血管內皮細胞分子標志物與血栓性疾病的關系[J]. 中國實驗診斷學, 2003, 7(5): 462-465.
[33] 潘君枝, 程超禪, 陳瑞炳. 丁苯酞治療對急性腦梗死患者血管內皮功能與血栓形成的影響[J]. 中國老年學雜志, 2015, 35(13): 3580-3582.
[34] OBERMAYER G, AFONYUSHKIN T, BINDER C J. Oxidized low-density lipoprotein in inflammation-driven thrombosis[J]. Journal of Thrombosis and Haemostasis, 2018, 16(3): 418-428.
[35] 劉偲, 蔡桂玉, 李德維. 低分子肝素鈉聯合丹參酮治療產后下肢血栓性靜脈炎的效果觀察[J]. 白求恩醫學雜志, 2018, 16(3): 258-260.
Structural Identification of. Agardh Fucoidan and Its Protective Effect on HMVEC Damage Induced by Oxidized Low Density Lipoprotein
LIN Pei-chun1,2, CHEN Su-hua2,3, WANG Wei-min2, LIU Hai-yun2, HUANG Dan-si2, YANG Zhi-qiang2
(1.,524088,;2.,,524088,; 3.,518108,)
【】To investigate the structure of four fucoidans fromC. Agardhand its protective effect on oxidized low-density lipoprotein-induced HMVEC damage.【】UsingC. Agardh fucoidan (FD1) as raw material, FD1 was subjected to Sepharose Cl-6B agarose gel column chromatography to obtain the component FS11. Chemical composition and monosaccharide analysis of FS11 were performed. Four fucoidans(i.e. F, FD1, FS1,FS11)were implemented by molecular weight determination, sugar chain conformation and infrared spectroscopy. The MTT method was used to determine the effect of three fucoidan treatments of HMVEC on cell viability and to study the protective effect of 4 fucoidans on oxidized low density lipoprotein-induced HMVEC damage. 【】FS11 had the highest sulfate and polysaccharide contents as compared with F, F, FD1. In the monosaccharide composition of FS11, the fucose content is as high as 52.7%. The estimated molecular weight of F, FD1, FS1, and FS11 are 474 576, 459 032, 201 285, and 190 049, respectively. Fucoidans have complex dendritic branches and multiple spiral structures as confirmed by I-KI UV scanning and Congo red experiment. Infrared spectroscopy results show that each component has O—H, C—H polysaccharide characteristic functional groups, S==O active characteristic functional groups. After 24 hours of treatment, the four components (i.e. F, FD1, FS1, FS11) at a concentration of 500 μg/mL and 1 000 μg/mL can significantly reduce the proliferation inhibition of HMVEC damaged by oxidized low-density lipoprotein (< 0.01).【】C. Agardh fucoidan has a protective effect on HMVEC damage induced by oxidized low density lipoprotein.
C. Agardhfucoidan; structure identification; induced damage; HMVEC
TS254.1
A
1673-9159(2020)05-0072-09
10.3969/j.issn.1673-9159.2020.05.009
2020-05-08
廣東省自然科學基金項目(編號:2018A0303130020); 國家級廣東海洋大學大學生創新創業訓練計劃項目(CXXL2018005)
林沛純(1997-),女,碩士研究生。E-mail:pclin1997@163.com
諶素華(1973-),女,高級實驗師,主要從事食品科學的研究。E-mail:cshh1111@126.com
林沛純,諶素華,王維民,等. 亨氏馬尾藻巖藻聚糖結構鑒定及其對氧化型低密度脂蛋白誘導HMVEC損傷的保護作用[J]. 廣東海洋大學學報,2020,40(5):72-80.
(責任編輯:劉朏)

