完全胸腔鏡引導下肺癌切除術的短期療效及對感染指標的影響
趙巖,焦英潔,翟所鍇
淄博市第一醫院1心胸外科,2外三科,山東 淄博 255200
肺癌發病率、病死率居惡性腫瘤首位[1-2],手術是治療肺癌的主要方式。近年來,胸腔鏡肺癌切除術以微創、術后恢復快、并發癥少等優勢在臨床應用逐漸增多[3],但目前研究多關注胸腔鏡肺癌切除術的臨床療效,較少關注對感染指標的影響。腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、超敏C反應蛋白(high-sensitivity C-reactive protein,hs-CRP)、降鈣素原(procalcitonin,PCT)和白細胞介素-10(interleukin-10,IL-10)是臨床常用的感染指標。本研究在觀察胸腔鏡肺癌切除術短期療效的基礎上,探討其對感染指標的影響,為臨床治療提供參考,現報道如下。
1 對象與方法
1.1 研究對象
選擇2013年5月至2018年10月淄博市第一醫院收治的103例肺癌患者為研究對象。納入標準:①經皮穿刺細胞檢查初次確診為肺癌;②腫瘤直徑<5 cm;③切緣超過病灶邊緣2 cm。排除標準:①癌灶累及主氣管;②合并臟器功能障礙;③既往胸部手術史。根據隨機數字表法將103例肺癌患者分為觀察組和對照組。觀察組51例,男31例,女20例;年齡51~69歲,平均(62.35±5.94)歲;病理類型:腺癌25例,鱗狀細胞癌20例,腺鱗癌6例;臨床分期:Ⅰ期19例,Ⅱa期20例,Ⅱb期12例;腫瘤直徑1~4 cm,平均(3.21±0.24)cm。對照組52例,男33例,女19例;年齡46~71歲,平均(63.02±6.17)歲;病理類型:腺癌27例,鱗狀細胞癌18例,腺鱗癌7例;臨床分期:Ⅰ期22例,Ⅱa期23例,Ⅱb期7例;腫瘤直徑0.5~4 cm,平均(3.16±0.35)cm。兩組患者基線特征比較,差異均無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準,向所有患者及其家屬介紹研究目的、方法及注意事項,患者及家屬均簽署知情同意書。
1.2 治療方法
對照組采用傳統開胸手術,于第5/6肋骨間行25~30 cm切口,手術切除腫瘤并行淋巴結清掃,常規放置引流管;術后預防性使用抗生素預防感染,嚴密觀察病情。觀察組采用完全胸腔鏡引導下肺癌切除術,于腋中線第7肋間做一長約1.5 cm的切口,腋前線中心3~4 cm為主操作口,腋后線第8、9肋間為副操作口。主操作孔下依次暴露、離斷肺門部位軟組織,逐漸深入處理肺裂,由前向后自第3肋間切除上葉,從下向上自第4肋間切除下葉,淋巴結清掃方法和術后處理同對照組。
1.3 觀察指標
①觀察兩組患者手術時間、術中出血量、淋巴結清掃數目、術后3天引流總量、術后疼痛程度視覺模擬評分(visual analogue scale,VAS)、拔管時間、住院時間的差異。VAS評分共0~10分,其中0分為無痛,10分為不可忍受的劇痛[4]。②治療前后采用Vmax229肺功能儀(美國森迪斯公司)參照美國胸科協會肺功能檢查操作規范進行常規肺功能檢查,記錄第1秒用力呼氣容積(forced expiratory volume in one second,FEV1)、FEV1與用力肺活量(forced vital capacity,FVC)的比值(FEV1/FVC)、FEV1占預計值百分數(PFEV1/pred)。③感染指標:術前、術后3天采用酶聯免疫吸附試驗檢測血清TNF-α、hs-CRP、PCT和IL-10水平。④觀察兩組患者肺部感染、漏氣、低氧血癥、膿胸、心律失常等術后并發癥發生情況以及圍手術期死亡率。
1.4 統計學分析
采用SPSS 25.0軟件進行數據分析,符合正態分布的計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;計數資料以例數及率(%)表示,組間比較采用χ2檢驗;以P<0.05為差異有統計學意義。
2 結果
2.1 肺功能的比較
術前兩組患者 FEV1、PFEV1/pred、FEV1/FVC水平比較,差異均無統計學意義(P>0.05);術后,兩組患者FEV1、PFEV1/pred、FEV1/FVC水平均出現不同程度降低,但觀察組患者FEV1、PFEV1/pred、FEV1/FVC水平均高于對照組,差異均有統計學意義(P<0.05)。(表1)
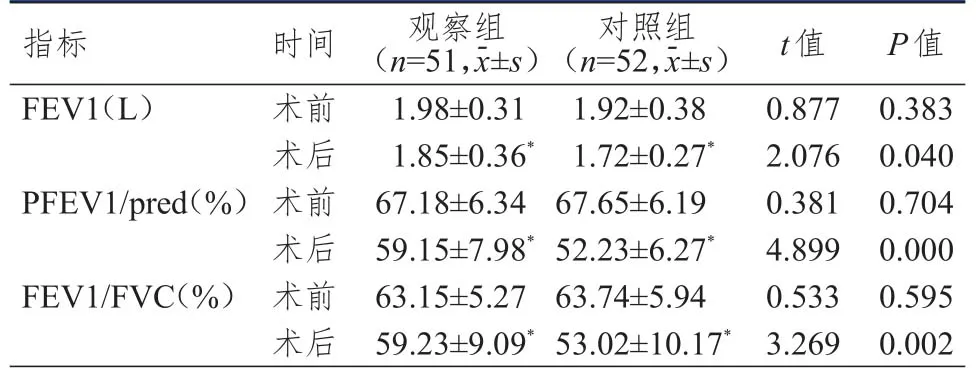
表1 手術前后兩組患者FEV1、PFEV1/pred、FEV1/FVC水平的比較
2.2 圍手術期指標的比較
觀察組患者手術時間、拔管時間、住院時間均明顯短于對照組,術中出血量、術后3天引流量均明顯少于對照組,VAS評分明顯低于對照組,差異均有統計學意義(P<0.01);兩組患者術中淋巴結清掃數目比較,差異無統計學意義(P>0.05)。(表2)
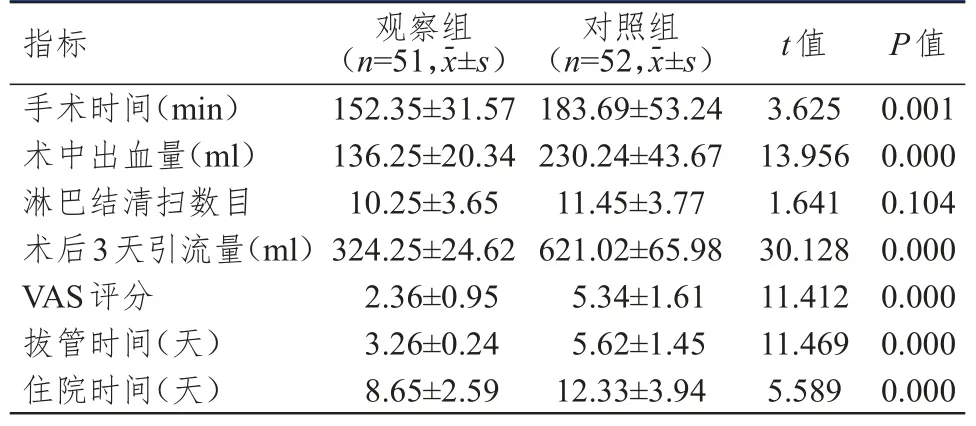
表2 兩組患者圍手術期指標的比較
2.3 感染指標的比較
術前,兩組患者血清TNF-α、hs-CRP、PCT、IL-10水平比較,差異均無統計學意義(P>0.05);術后,兩組患者血清TNF-α、hs-CRP、PCT、IL-10水平均增高,但觀察組患者術后血清TNF-α、hs-CRP、PCT、IL-10水平均明顯低于對照組,差異均有統計學意義(P<0.01)。(表3)
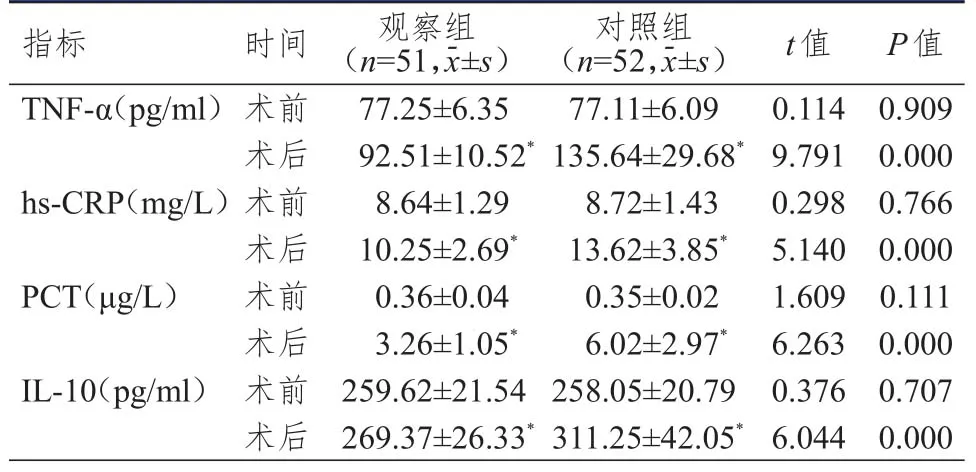
表3 手術前后兩組患者感染指標的比較
2.4 并發癥發生情況的比較
兩組患者術后肺部感染、漏氣、低氧血癥、膿胸、心律失常發生率比較,差異均無統計學意義(P>0.05);觀察組死亡0例,對照組死亡1例,兩組比較,差異無統計學意義(P>0.05)。(表4)

表4 兩組患者并發癥發生情況
3 討論
傳統開胸手術可有效切除肺部腫瘤,效果確切,但術后并發癥發生率高,影響患者術后康復[5]。近年來,隨著微創手術在臨床的廣泛應用,術者經驗不斷積累,操作水平逐漸提高,熟練程度逐漸加深,其臨床療效逐漸得到認可,可與傳統開胸手術媲美[6-8]。
臨床對胸腔鏡手術是否能有效清除淋巴結一直存有較大爭議,本研究中觀察組術中淋巴結清掃數目與對照組無明顯差異,提示胸腔鏡下肺癌切除術可對病灶、周圍淋巴結進行有效清除,疾病控制率滿意。胸腔鏡放大作用可擴大手術視野,精確找到淋巴結位置,同時胸腔鏡手術術中出血少,視野清晰,為術中準確清掃淋巴結提供了有力的條件[9-10]。本研究中觀察組術后肺功能指標FEV1、PFEV1/pred、FEV1/FVC水平均高于對照組,且手術時間、拔管時間、住院時間均明顯短于對照組,術中出血量、術后3天引流量均明顯少于對照組,VAS評分明顯低于對照組,提示胸腔鏡下肺癌切除術可大大縮短手術時間,減少術中出血量,減輕術后患者疼痛程度,使患者痛苦小、恢復快。胸腔鏡肺葉切除術切口小,操作簡單,通過有效利用胸腔鏡等儀器,保證手術視野清晰,并能顯示更深層次組織,減少對肺的損傷和術中出血量,促進患者術后恢復。由于胸腔鏡手術創傷小,對免疫系統損傷也明顯減小,患者術后肺部感染率明顯降低[11-13]。本研究中兩組患者術后肺部感染率比較差異雖無統計學意義,且觀察組為1.96%,對照組為5.77%,均處于較低水平,提示胸腔鏡手術與開胸手術均具有較高的安全性。以上結果證實完全胸腔鏡下肺癌切除術治療具有較高可行性、有效性和安全性,這一點也在多數臨床研究中得到證實[14-16]。
TNF-α、hs-CRP、PCT、IL-10是炎性因子,可反映機體創傷程度、炎性反應和免疫反應狀態,患者手術時受到創傷程度越嚴重,血清TNF-α、hs-CRP、PCT、IL-10水平越高[17-18]。本研究兩組患者術后血清TNF-α、hs-CRP、PCT、IL-10水平均出現不同程度升高,提示手術創傷可引起機體炎性因子釋放,誘導炎癥免疫反應發生,而觀察組患者血清TNF-α、hs-CRP、PCT、IL-10水平均明顯低于對照組,提示胸腔鏡手術可降低手術帶來的炎性創傷,術后患者整體免疫狀態較好,炎性反應輕微,感染率更低。本研究觀察組術后肺部感染率較低,與該組患者血清低水平TNF-α、hs-CRP、PCT、IL-10結果相吻合。有研究同樣顯示完全胸腔鏡肺葉切除手術可顯著減輕手術對機體的創傷,降低手術對腫瘤周圍正常組織的影響,術后患者應激反應程度更輕微[19-20]。
綜上所述,本研究結果顯示完全胸腔鏡引導下的肺癌切除術短期療效優于傳統開胸手術,且創傷小,術后恢復快,并發癥發生率低,對感染指標影響小,是值得臨床推廣的術式。

