水化氯鋁酸鈣脫氟的pH相關性研究
張陸軍,王寧寧,章興華,2,曹建新,2,易蕓,2,許爭
(1.貴州大學 化學與化工學院,貴州 貴陽 550025;2.貴州省綠色化工與清潔能源技術重點實驗室,貴州 貴陽 550025)
王寧寧,現在工作單位為北京中持凈水材料技術有限公司;許爭,華南理工大學在讀博士生。
根據資料顯示,烏江已成為貴州水污染最嚴重的流域,總磷、氟化物超標[1]。吸附法是處理氟廢水最常用的方法,有成本低、除氟穩定及適用范圍廣等特點[2-3],但其回收利用困難、吸附容量低等限制其發展應用。因此,一種帶永久正電荷的水化氯鋁酸鈣作為新型層狀陰離子吸附材料[4],可通過溶解-再沉淀將水體中氟[5]和磷[6]固定。鑒于工業上所排放的大多是酸性廢水。因此,對酸性廢水中氟去除的研究非常必要。
我們曾討論了水化氯鋁酸鈣對水體中氟的動力學和熱力學,對氟吸附是以化學吸附為主的復雜過程,水化氯鋁酸鈣脫氟具有顯著的pH相關性。
1 實驗部分
1.1 試劑與儀器
氟化鈉,保證試劑;氫氧化鈉,分析純;聚合氯化鋁、濃鹽酸(36%~38%)、石灰均為工業品;實驗用水為自制超純水(電導率18.25 MΩ·cm)。
PHS-3C型數字酸度計;232-01參比電極;PF-1-01氟離子電極;SHZ-82水浴恒溫振蕩器;ZR4-6混凝試驗攪拌機;JS94H型微電泳儀;JSM-6490LV掃描電鏡;INCA-350 X射線能譜儀;X’Pert Powder X射線衍射儀(XRD);Nicolet iS50型傅里葉紅外光譜儀(FTIR);K-α+X-射線光電子能譜儀[用非單色Al-Kα輻射(1 486.6 eV)拍攝樣品的X射線光電子能譜(XPS)]。
1.2 水化氯鋁酸鈣
水化氯鋁酸鈣合成,以Ca/Al摩爾比為2∶1計量,分別取適量石灰乳液和聚合氯化鋁溶液在室溫強攪拌條件下導向合成,產品呈乳白色水化氯鋁酸鈣漿液,靜置陳化24 h,抽濾沉淀,用去離子水洗滌3次,80 ℃烘干,研磨過100目篩。通過化學分析、TG-DTG與XRD檢測,確定產品的近似公式為Ca2.4Al(OH)6Cl1-x(CO3)x·2.0H2O (x≤0.05,M.W.≈ 297.847 g/mol)。XRD圖譜與文獻報道(JCPDS 78—1219)一致。
1.3 除氟實驗
取不同濃度氟化鈉溶液100 mL,加入相應質量水化氯鋁酸鈣,用HCl或NaOH調節溶液pH值,在SHZ-82水浴恒溫振蕩器上進行吸附實驗,上清液經0.45 μm微孔濾膜過濾后測定溶液中剩余氟離子濃度;沉淀于100 ℃干燥,進行XRD、FTIR、XPS及SEM-EDS表征。
1.4 分析方法
采用離子選擇電極法(GB 7847—1987)測定氟離子濃度,0.2 mol/L檸檬酸鈉和1 mol/L硝酸鈉作為總離子強度調節緩沖溶液。
1.5 水化氯鋁酸鈣及其含氟絮體的ζ電位測定
水化氯鋁酸鈣及其含氟絮體的ζ電位測定在JS94H型微電泳儀上進行。在ZR4-6混凝試驗攪拌機上的慢速攪拌結束后,不等絮體沉降,吸取少量水樣,用HCl和NaOH溶液調節pH值,分別測定不同pH條件下水化氯鋁酸鈣絮體及其處理含氟絮體的ζ電位值。
2 結果與討論
2.1 原水pH值對除氟效果的影響
稱0.1 g水化氯鋁酸鈣,加入到100 mL氟離子濃度為27.25 mg/L(溶液pH=7.32)的氟化鈉溶液中,常溫下160 r/min恒溫振蕩,考察pH值對水化氯鋁酸鈣除氟效果的影響,結果見圖1。

圖1 pH對水化氯鋁酸鈣除氟效果的影響Fig.1 Effect of initial pH on hydrated calcium chloroaluminate defluoridation
由圖1可知,水化氯鋁酸鈣去除不同pH值溶液中的氟呈現出在pH=3和pH=7.5時溶液中剩余氟離子最低濃度與相對應的水化氯鋁酸鈣的吸附容量的雙峰曲線。
2.2 水化氯鋁酸鈣及其含氟絮體的ζ電位
水化氯鋁酸鈣及其含氟絮體的ζ電位測定結果見圖2。

圖2 水化氯鋁酸鈣及其含氟絮體的ζ電位隨pH值的變化Fig.2 The ζ potential of hydrated calcium chloroaluminate and its fluorine-containing flocs varied with pH value
由圖2可知,水化氯鋁酸鈣絮體的ζ電位隨pH值的變化是:在酸性區域,為較高的正值,接近中性,ζ電位由正趨于零,在堿性區域(pH值>10),ζ電位由正變負;而吸附氟后,絮體的ζ電位在整個酸性區域為微小正值;接近中性區域ζ電位由正趨于零,在整個堿性區域,ζ電位是微小負值。由此判斷,在整個酸性區域,水化氯鋁酸鈣除氟過程主要為靜電吸附。最直接的證據是水化氯鋁酸鈣含氟絮體由于吸附了帶負電荷的F-,正電荷被全部中和。
2.3 水化氯鋁酸鈣及其含氟絮體的XRD、FTIR及XPS表征
水化氯鋁酸鈣去除不同pH值溶液中的氟呈現pH=3和pH=7.5時的雙峰曲線,這應該是吸附形態物不同所致。為了驗證這一說法,對在pH值3和pH值7.5脫氟前后水化氯鋁酸鈣的沉淀物進行了XRD(圖3)及FTIR檢測(圖4)。
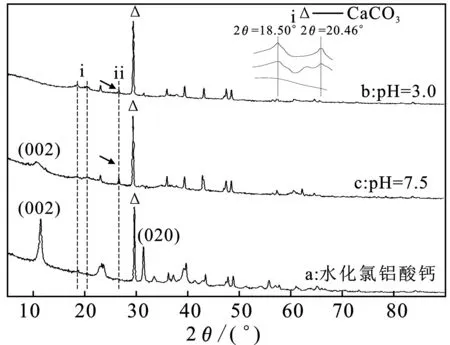
圖3 不同pH條件下氟離子吸附前后水化氯鋁酸鈣的XRD圖譜Fig.3 XRD patterns of hydrated calcium chloroaluminate before and after adsorption fluoride ion at different pH
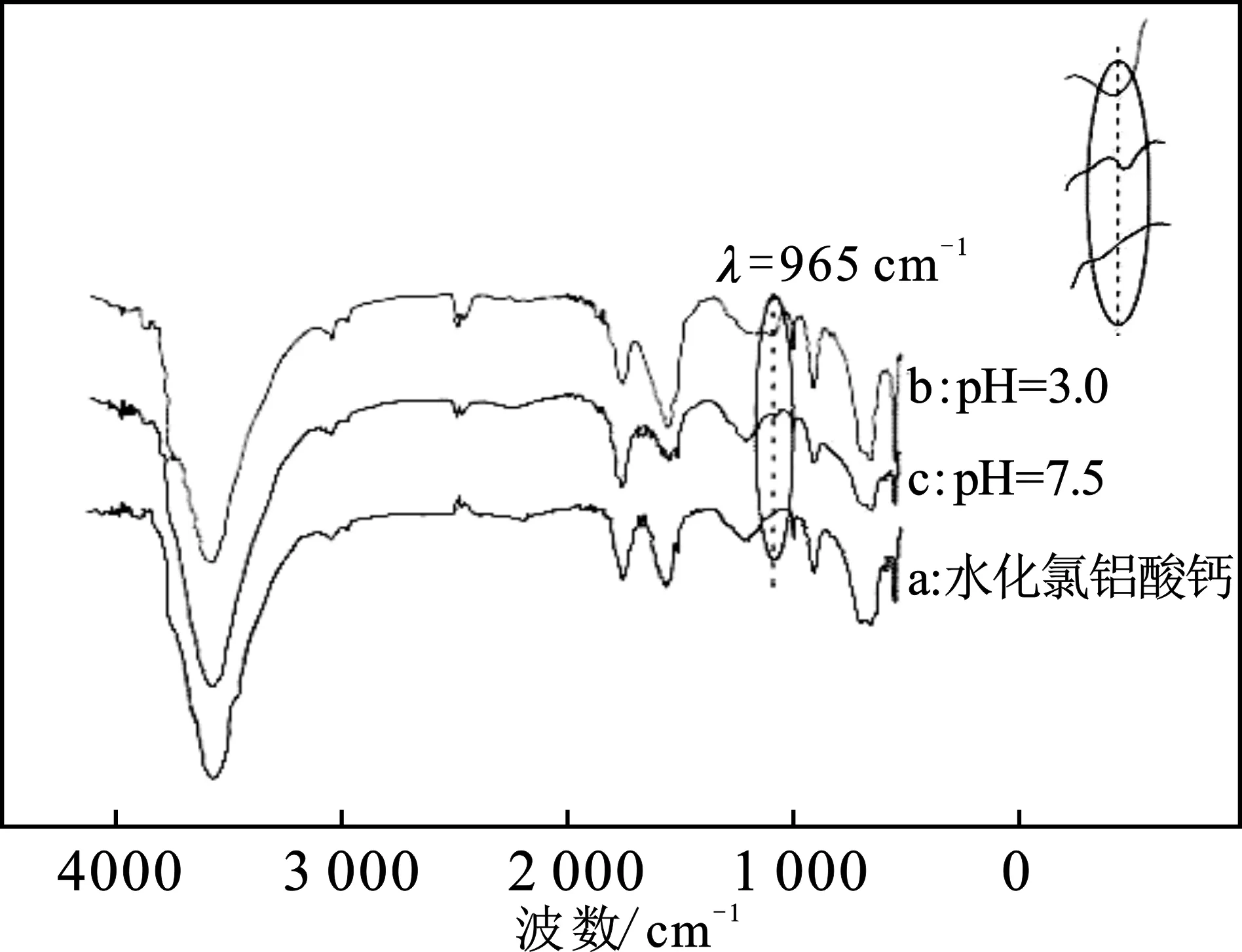
圖4 不同pH條件下氟離子吸附前后水化氯鋁酸鈣紅外光譜的比較Fig.4 The comparison of FTIR spectrum of hydrated calcium chloroaluminate before and after adsorption fluoride ion at different pH
由圖3可知,在pH=3.0條件下水化氯鋁酸鈣全部溶解,代表水化氯鋁酸鈣層狀結構的d002和d020衍射峰完全消失[5](見圖3b),生成新鮮氫氧化鋁(見圖3的插圖i)和碳酸鈣(于2θ=29.399°的碳酸根)峰大大增強。特別地,pH=3.0沉淀的鮮氫氧化鋁在2θ=18.50°和20.46°的雙峰明顯強于pH值7.5[7];位于2θ=26.66°的新峰歸屬于CaF2[5](見圖3的ⅱ)。因此,在酸性區域對F-的沉淀主要由Ca2+實現,對F-的吸附主要由Al3+和無定型氫氧化鋁絮體完成;而在pH值7.5,代表水化氯鋁酸鈣層狀結構的d002衍射峰減弱并偏移至0.759 66 nm(見圖3c),表明水化氯鋁酸鈣部分溶解,對F-的去除由鈣與氟的沉淀、水化氯鋁酸鈣的離子交換、和氫氧化鋁絮體對氟的吸附。
由圖4可知,脫氟前后指紋區最明顯的變化是水化氯鋁酸鈣吸附氟后在965 cm-1(弱)產生新峰(圖4 b,c)。965 cm-1處的吸收峰,是由絮體中的AlF3、AlF2+或AlF2+等絡離子引起[8-9]。pH=3.0處965 cm-1吸收峰遠高于pH=7.5處吸收峰,與圖3插圖ⅰ所證實水化氯鋁酸鈣溶解產生的新生態氫氧化鋁絮體更多相對應。
水化氯鋁酸鈣脫氟前后的XPS圖譜見圖5。

圖5 水化氯鋁酸鈣脫氟前后的XPS圖譜:氟化鈣685.17 eV峰面積比較Fig.5 XPS patterns of hydrated calcium chloroaluminate before and after defluoridation:Comparison of CaF2 685.17 eV peak area
由圖5可知,水化氯鋁酸鈣F1s軌道的XPS峰基本是一條直線,通過XPSPEAK41軟件擬合發現在683.68 eV處出現很小的結合能峰。脫氟后兩個pH值條件下沉淀物中氟化物的結合能峰分別為685.17 eV和685.16 eV,與XPS化學狀態表[10]中CaF2峰685.2 eV峰相吻合,可以確認兩個峰均為以CaF2存在的氟化物,與XRD檢出的2θ=26.66° CaF2峰相呼應;pH=3.0沉淀物的結合能峰擬合出686.25 eV峰,與XPS化學狀態表中AlF3峰686.3 eV相符,支持了FTIR圖譜中水化氯鋁酸鈣吸附氟后在965 cm-1產生的新峰歸屬于AlF3、AlF2+或AlF2+等絡離子的指認;pH=7.5沉淀物的結合能峰還可擬合出684.21 eV峰,該峰也屬于CaF2,由于吸附作用,使得氟離子與鈣離子之間的結合能稍被減弱;該沉淀物中還顯示682.07 eV弱峰,此峰在文獻卡片中無對應者。我們推測這應該是離子交換進入水化氯鋁酸鈣層間的氟的貢獻。明顯地,pH=3.0沉淀物的結合能峰面積遠高于pH=7.5,說明前者中CaF2的含量高于后者。XPS的檢測結果與XRD和FTIR的表征分析形成了相互支撐的證據鏈。
2.4 水化氯鋁酸鈣含氟絮體的SEM-EDS表征
水化氯鋁酸鈣在pH 3.0和pH 7.5脫氟沉淀的SEM-EDS檢測結果分別見圖6、圖7。

圖6 水化氯鋁酸鈣在pH 3.0脫氟吸附沉淀的SEM圖象和EDS檢測結果Fig.6 The BEI-SEM image and the EDS test results of hydrated calcium chloroaluminate after adsorption fluoride ion at pH 3.0

圖7 水化氯鋁酸鈣在pH 7.5脫氟吸附沉淀的BEI-SEM圖象和EDS檢測結果Fig.7 The BEI-SEM image and the EDS test results of hydrated calcium chloroaluminate after adsorption fluoride ion at pH 7.5
由圖6、圖7可知,無論是在酸性區域還是堿性區域,水化氯鋁酸鈣溶解的Ca2+主要是形成碳酸鈣(pH=3.0能譜圖1和pH=7.5能譜圖1指示的方解石晶體)。兩個pH值條件下形成的氫氧化鋁絮狀沉淀中,其中的F∶Al∶Ca摩爾比都是約在11∶1∶4 (pH=3.0能譜圖3;pH=7.5能譜圖3)。此外,EDS檢測還表明,Ca∶Al∶Cl ≈ 2∶1∶1 [pH=3.0脫氟沉淀中為1.72∶1∶0.77(pH 3.0圖譜2)];而pH=7.5脫氟沉淀中為1.68∶1∶0.72(pH=7.5圖譜1)的晶型顆粒物始終存在,顆粒中的F∶Cl摩爾比分別在0.68~0.33之間。
pH=3.0和pH=7.5條件下水化氯鋁酸鈣脫氟前后沉淀物的XRD、FTIR、XPS以及SEM-EDS檢測結果,有力地支持了水化氯鋁酸鈣吸附F-的雙峰曲線對應于多種不同的吸附形態物。為從酸性區域到堿性區域水化氯鋁酸鈣的脫氟機理提供了合理解釋的依據。
2.5 水化氯鋁酸鈣脫氟機理討論
2.5.1 新生態鋁鹽混凝吸附除氟 水化氯鋁酸鈣在整個酸性區域的絮凝沉降過程中發生溶解-再結晶:
Ca2.4Al(OH)6Cl1-x(CO3)x·2.0H2O →
3CaCO3↓+2Al3++3(OH)-+Ca2++2Cl-
(1)
Al3++xF-→AlFx(3-x)+
(2)
反應式(2)中和作用造成水化氯鋁酸鈣含氟絮體的ζ電位在整個酸性區域微小正值,見圖2。在中性和堿性環境下:
Al3++3(OH)-→Al(OH)3(am)↓
(3)
Al(OH)3(am)+xF-→2Al(OH)3(am)Fx-+xCa2+→Al(OH)3(am)·xCaF2
(4)
Ca2++2F-→ CaF2
(5)
反應(3)生成具有很大比表面積的無定型的Al(OH)3(am)絮體,對F-陰離子產生氫鍵吸附。XPS實驗表明,絮體Al(OH)3(am)對HF的吸附為分子吸附[2]。這種吸附的具體作用方式尚有待進一步研究,在本研究中最有可能的是F-先以氫鍵或靜電作用方式吸附在絮體上,然后Ca2+作為電荷平衡離子吸附于上面而構成分子吸附。
2.5.2 離子交換脫氟 水化氯鋁酸鈣在整個堿性區域的絮凝沉降過程中僅發生部分溶解[5-6],此時吸附脫氟的還有水化氯鋁酸鈣。水化氯鋁酸鈣屬于Ca-Al LDHs,而LDHs對各種水溶液中陰離子的吸附主要是離子-離子交換,這種離子-離子交換是LDHs對各種陰離子和其層間陰離子之間的競爭吸附。
Prasad等[11]通過層間陰離子交換產生的電勢,研究了不同陰離子插層的Mg-Al LDHs的熱力學穩定性。結果表明:在幾種單價陰離子中,相比于含硝酸根的LDHs,最穩定的是含氟離子的LDHs(ΔG°=-48.7 kJ/mol)。在幾種單價陰離子均相溶液的自-自交換中,標準自由能變化均為負值,且F->Cl->Br->NO3-,說明將NO3-交換為其它陰離子都是熱力學穩定的過程。
Isra?li等[12]研究了常溫下ZnAl-Cl LDHs離子交換反應的熱力學特性。結果表明:F-、Br-、I-等陰離子與插層Cl-的交換是弱放熱反應,依照I- ZnAl-Cl LDHs的Cl-→OH-交換過程中的標準摩爾熱力學參數見表1。熵增效應有利于Cl-→OH-的交換;類似地,反應式(6)中,水化氯鋁酸鈣的Cl-→F-交換過程也是如此。 表1 描述ZnAl-Cl LDHs和水化氯鋁酸鈣上陰離子交換的標準摩爾熱力學量Table 1 Standard molar thermodynamic quantities characterizing the anion exchange on a LDHs of the ZnAl-Cl and hydrated calcium chloroaluminate type Ca-LDHs·Cl+yF-→Ca-LDHs·(Cl1-yFy) +yCl- (6) 基于電鏡對絮體的觀察和EDS對絮體的檢測,反應式(6)中,0.33 本文研究表明,水化氯鋁酸鈣進行Cl-→F-交換過程的產物似乎并不穩定。Rapin等[13-15]分別進行了水化氯鋁酸鈣的Cl-→I-、Cl-→Br-交換過程研究;但始終未見水化氯鋁酸鈣進行Cl-→F-交換過程的報道可能與此有關。 中性及堿性環境下,水化氯鋁酸鈣對F-的吸附是以顆粒內(層間)擴散控制為主的離子-離子交換,主要是由于吸附劑和吸附質之間的邊界層擴散、顆粒內(層間)擴散和吸附平衡三個吸附過程所引起,這表明水化氯鋁酸鈣對溶液中氟離子吸附是一個復雜的過程,顆粒內(層間)擴散在該吸附反應中可能起到了慢反應控制步驟[16]。 (1)水化氯鋁酸鈣脫氟具有顯著的pH相關性,在pH值3~4區域的第一峰值點脫氟效率最高,在pH值7~8區域存在脫氟的第二峰值點。 (2)無論是在酸性、中性及堿性環境,水化氯鋁酸鈣對氟離子的去除始終存在著溶解-再沉淀(CaF2);在整個酸性區域帶正電荷的絮體促進了水化氯鋁酸鈣溶解產生的氫氧化鋁對氟的絡合作用;在中性區域存在無定型的Al(OH)3(am)絮體對CaF2的分子吸附脫氟;在堿性環境中存在以擴散控制為主的水化氯鋁酸鈣層間Cl-F離子交換吸附。 (3)水化氯鋁酸鈣含氟絮體的ζ電位滴定及XRD、FTIR、XPS和SEM-EDS表征結果對脫氟過程所包含的溶解-再沉淀、分子吸附、絡合反應及離子-離子交換,是造成水化氯鋁酸鈣對氟離子吸附顯示復雜的化學吸附過程的根本原因。
3 結論

