實時熒光定量 PCR檢測斑點熱立克次體方法的建立
羅婉蓉,劉伯玉,陳 振,任翠平,高 越,楊 莉,朱 禹,余東陽,柳 燕
斑點熱是一種由斑點熱群立克次體(spotted fever group rickettsiae,SFGR)感染引起、經蜱蟲叮咬傳播的人畜共患疾病。目前國際上已證明有19種SFGR對人類有致病性[1]。國內已鑒定的SFGR有5種:R.heilongjiangiensis、CandidatusR.tarasevichiae[2-7]。斑點熱的臨床表現為發熱、皮疹、頭痛、局部淋巴結腫大等[1]。病程早期缺乏特異性臨床癥狀,患者往往因為誤診而延誤病情,嚴重時可致死亡[8]。若患者能在早期得到快速準確的診斷,并給予抗菌藥物則可以被治愈,減少死亡率。目前,斑點熱的實驗室診斷技術包括常用但缺乏特異性、敏感性的血清學檢測和分子生物學檢測。其中巢式PCR與常規PCR比較具有更高的特異性[9-10],但操作相對繁瑣。分離培養斑點熱立克次體是確診最直接、最可靠的依據[11],但是耗時且有一定技術要求,難以在一般實驗室開展。因此,建立快速檢測立克次體感染的方法就顯得尤為重要。
實時熒光定量PCR(quantitative real-time PCR,qPCR)技術是一種敏感特異的核酸檢測方法,可用于病毒、細菌的快速檢測[12]。該研究運用qPCR技術,根據SFGR外膜蛋白A基因(outer membrane protein A,ompA)建立SFGR的快速檢測方法。
1 材料與方法
1.1 研究對象日本斑點熱立克次體(R.janponicaAnhui 120 strain,本實驗室分離培養并保存菌種);其他立克次體屬病原體(斑疹傷寒立克次體、恙蟲病東方體、無形體)DNA以及常見非立克次體病原菌(大腸埃希菌、金黃色葡萄球菌、支原體、螺旋體)DNA。
1.2 試劑及儀器PCR儀(德國Biometra公司);實時熒光定量PCR儀(瑞士Roche公司);瓊脂糖凝膠成像儀器(上海勤翔科學儀器有限公司);Nanodrop2000分光光度計(美國ThermoFisher公司)。DNeasy Blood &Tissue Kit(德國QIAGEN公司);pMD18-T Vector Cloning Kit、Gel DNA Extraction Kit、PremixTaq、PremixExTaq、DL2000 DNA Marker(日本TaKaRa公司),瓊脂糖凝膠(西班牙BIOWEST公司),Plasmid Miniprep Kit(美國AXYGEN公司)。引物和探針由通用生物系統(安徽合肥)有限公司合成。
1.3 引物和探針的設計與合成參考GenBank中Rickettsiajaponicastrain Anhui 120ompA基因序列(序列號:KY484160.1)以及R.heilongjiangiensis054 ompA基因序列(序列號:AF179362.2)、R.raoultiistrain Khabarovsk ompA基因序列(序列號:AH015610.2),利用Beacon Designer引物設計軟件設計斑點熱立克次體ompA基因特異性引物和探針(表1)。將設計好的引物和探針在NCBI官網上進行Primer-BLAST分析,驗證該對引物和探針的特異性。
1.4 陽性標準品的構建用DNeasy Blood&Tissue Kit提取日本斑點熱立克次體(Anhui120株)培養物核酸。使用本實驗常規使用的兩對巢式PCR引物(表1)擴增斑點熱立克次體ompA基因。一輪PCR反應體系25 μl:2×PremixTaq反應液12.5 μl,上、下游引物(ompA-70F、ompA-701R)各0.7 μl,模板5 μl,去離子水補足體系。二輪PCR反應體系25 μl:2×PremixTaq反應液12.5 μl,上、下游引物(ompA-180F、ompA-602R)各0.7μl,模板1 μl,去離子水補足體系。相同的PCR反應條件參數設置:94 ℃預變性5 min;94 ℃變性45 s,51 ℃退火45 s,72 ℃延伸45 s,39個循環;72 ℃延伸10 min。配制1.2%瓊脂糖凝膠對PCR產物進行電泳鑒定,切膠回收目的條帶。按照pMD18-T Vector Cloning Kit說明書將ompA基因片段克隆到T載體上,并轉化到DH5α大腸桿菌中。通過藍白斑篩選以及菌落PCR(表1)鑒定,篩選出含陽性重組質粒菌液后收集菌液標本進行基因測序。將測序結果進行BLAST分析驗證,符合試驗預期的陽性重組質粒可作為qPCR的陽性標準品。大量培養含重組質粒的細菌提取重組質粒,Nanodrop2000分光光度計測量DNA濃度,計算拷貝數。將制備好的標準品分裝后置于-80 ℃冰箱凍存備用。
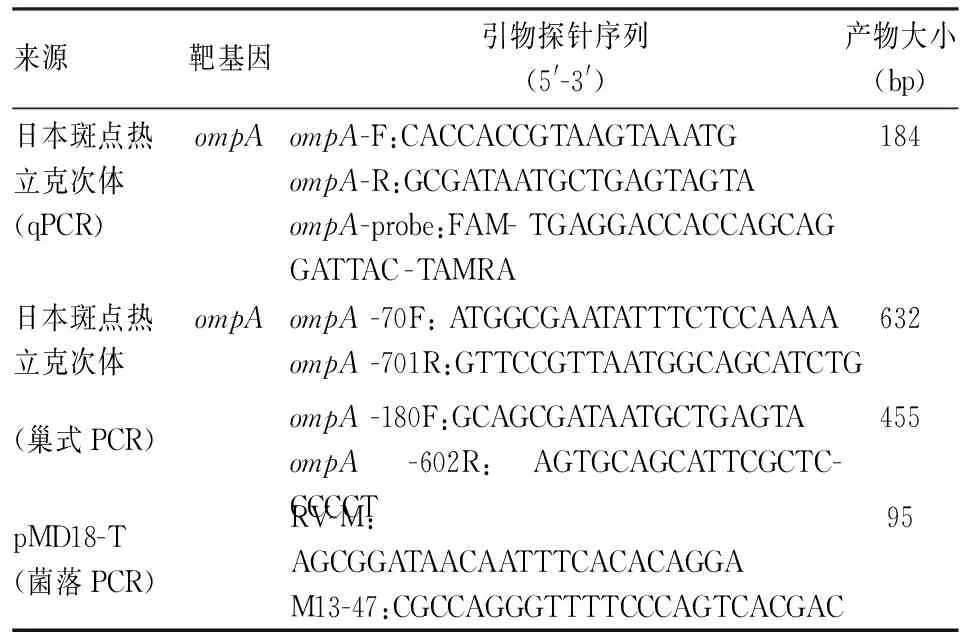
表1 PCR引物序列
1.5 反應條件的優化及標準曲線的建立按照PremixExTaq(Probe qPCR)試劑盒說明書配制20 μl的qPCR反應體系,引物濃度0.1、0.2、0.4 μmol/L,探針濃度0.4、0.5、0.6 μmol/L進行TaqManqPCR反應,對反應條件進行優化。分別以質粒含量為1.9×108、1.9×107、1.9×106、1.9×105、1.9×104、1.9×103、1.9×102、1.9×101和1.9×100拷貝作為模板,用優化后的反應條件進行擴增,獲得擴增動力學曲線。以標準品起始濃度的常用對數為橫坐標,以循環閥值縱坐標,推導出標準曲線。
1.6 特異性檢測用優化后的TaqManqPCR條件分別對SFGR(日本斑點熱立克次體)、立克次體科其他常見病原體(斑疹傷寒立克次體、恙蟲病東方體、無形體)、常見非立克次體病原菌 (大腸埃希菌、金黃色葡萄球菌、螺旋體、支原體)DNA進行qPCR檢測。
1.7 敏感性試驗分別對質粒含量為1.9×103、1.9×102、1.9×101、1.9×100和1.9×10-1拷貝的標準品進行檢測,以優化后的條件進行TaqMan qPCR檢測,明確建立方法的最低檢測限。
1.8 重復性試驗用建立的TaqMan qPCR方法分別對質粒含量為1.9×106、1.9×105、1.9×104、1.9×103和1.9×102拷貝的標準品進行檢測,每種質粒含量重復3次,計算變異系數。再以相同標準質粒為模板,在不同時間段進行3次獨立重復試驗,以分析組間差異。
1.9 臨床樣品檢測對來自臨床采集的80份不明原因發熱患者的血標本進行核酸提取。用建立的TaqMan qPCR檢測方法和巢式PCR方法同時對該臨床患者血標本核酸進行檢測,計算2種檢測方法之間的符合率。
1.10 統計學處理質粒構建及測序結果分析采用Lasergene 7.0軟件。分別用SPSS 20.0 及GraphPad Prism 5.0 軟件進行描述性統計分析和作圖。兩種PCR方法陽性率比較采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 重組質粒的構建ompA基因經巢式PCR擴增后,目的條帶大小為455 bp。將目的條帶插入到T載體中構建重組質粒并測序驗證。見圖1。
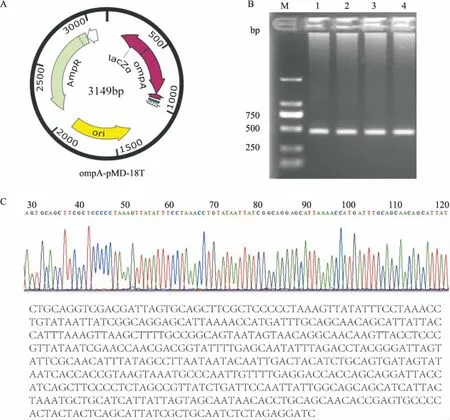
圖1 插入R.janponica(Anhui120株)ompA基因重組質粒的構建與鑒定
2.2 TaqManqPCR標準曲線優化后的TaqMan qPCR最佳反應體系是:PremixExTaq(Probe qPCR)10 μl,上下游引物(10 μmol/L)各0.4 μl,探針(10 μmol/L)1.0 μl,模板2 μl,滅菌去離子水補足至20 μl體系。以各標準品中質粒濃度的常用對數值為橫坐標,以循環閥值為縱坐標,獲得ompAqPCR標準曲線:Y=-3.220X+33.162,相關系數為0.996,擴增效率為104.6%,表明建立的TaqMan qPCR方法具有良好的線性關系,見圖2。
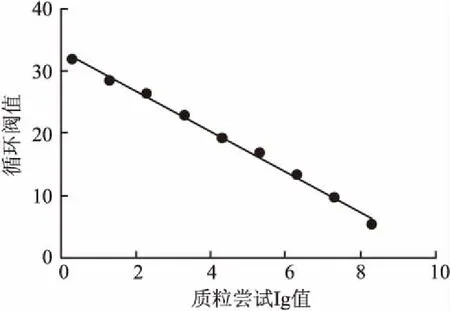
圖2 ompA基因TaqMan qPCR標準曲線
2.3 TaqMan qPCR的特異性分析建立的qPCR方法僅對斑點熱立克次體ompA有陽性擴增信號,其他常見病原體包括普氏立克次體、恙蟲病東方體、無形體、埃里克體、大腸埃希菌和金黃色葡萄球菌均為陰性,表明建立的TaqMan qPCR方法特異性強,見圖3。
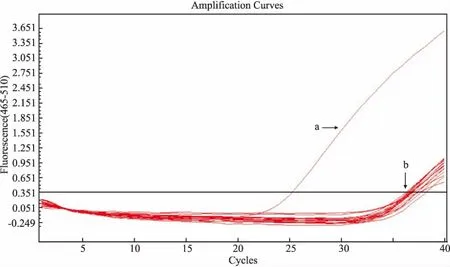
圖3 ompA基因TaqMan qPCR特異性結果
2.4 TaqMan qPCR的靈敏性分析建立的qPCR方法對質粒含量為1.9×103、1.9×102、1.9×101、1.9×100和1.9×10-1拷貝有陽性擴增信號,對1.9×100、1.9×10-1拷貝均未檢測到擴增信號,表明本研究建立的方法的最低檢測限為19拷貝。見圖4。
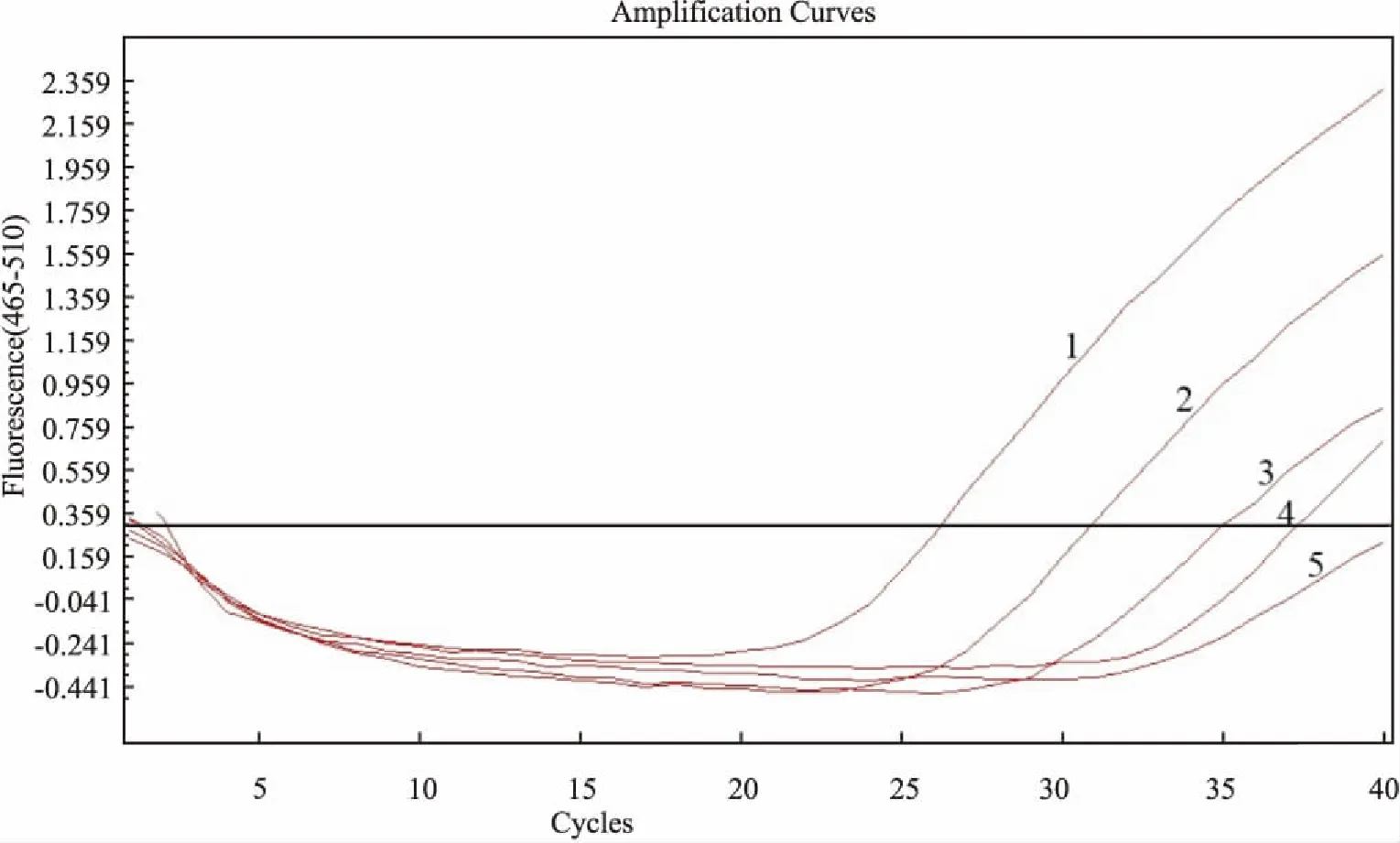
圖4 ompA基因TaqMan qPCR敏感性結果 1~5:標準品質粒濃度為1.9×103、1.9×102、1.9×101、1.9×100和1.9×10-1拷貝
2.5 TaqMan qPCR的重復性分析建立的TaqManqPCR 檢測質粒含量為1.9×106、1.9×105、1.9×104、1.9×103和1.9×102拷貝標準品的組間變異系數為0.56%~1.47%,組間變異系數為1.01%~2.29%,見表2。
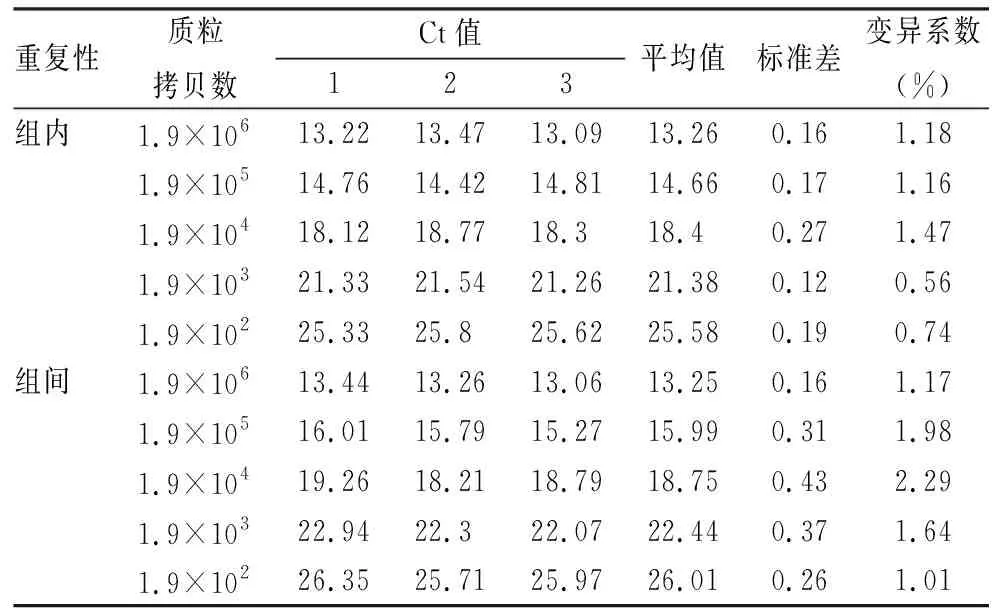
表2 TaqMan 探針qPCR重復性試驗結果
2.6 TaqMan qPCR方法對臨床樣品檢測普通PCR陽性的樣品經TaqMan qPCR的檢測方法檢測均為陽性,兩種檢測方法的一致率為91.25%。2種檢測方法比較差異有統計學意義(χ2=5.14,P<0.05)。
表明對80份臨床病人標本核酸進行檢測TaqManqPCR方法較巢式PCR敏感性更高。見表3。
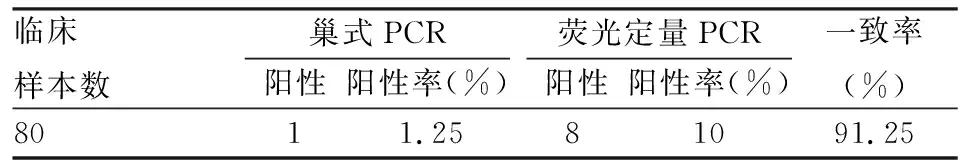
表3 兩種PCR方法對臨床樣品的檢測結果
3 討論
國內的斑點熱立克次體流行病學調查開始于1958年。長期的研究調查顯示斑點熱立克次體分布較廣,至今已有十幾個省市、自治縣證實存在斑點熱立克次體感染,從患者、蜱、蜱蟲卵以及嚙齒動物體內共分離出20余株SFGR,流行病學調查顯示人群對該群病原體普遍易感[7, 13]。目前根據SFGR 17 ku抗原、gltA、geneD、ompA基因,已經建立了多種PCR鑒定方法[14]。其中ompA作為斑點熱立克次體細胞膜表面蛋白,在立克次體的感染與免疫中發揮重要作用,如介導立克次體黏附和入侵宿主細胞、促進立克次體在細胞內生長繁殖以及誘導機體的免疫應答等[15]。
Regnery et al[16]根據立氏立克次體ompA基因設計的一對引物Rr190.70p(5-ATGGCGAAT ATTTCTCCAAAA-3′)和Rr190.602n(5′-AGTGCAG CATTCGCTCCCCCT-3′),其擴增序列結合限制性內切酶片段長度多態性圖譜法(PCR/RFLP)被廣泛應用于斑點熱立克次體新種的鑒定。此方法能區別具有高度遺傳同源性的SFGR,在于這對引物擴增的目的片段既有SFGR的保守序列,又具有SFGR不同種之間特殊酶切位點,可以通過不同的限制性內切酶消化區別SFGR不同的種。本實驗通過巢式PCR(兩對引物ompA-70F和ompA-701R、ompA-180F和ompA-602R)擴增出SFGR的保守序列,再根據這段保守序列設計特異性的引物和探針,建立檢測斑點熱立克次體的TaqMan qPCR方法。
評估建立的qPCR方法的3項重要指標包括:特異性、敏感性和重復性。本實驗在進行特異性分析時,選擇斑疹傷寒立克次體、恙蟲病東方體、無形體,以及大腸埃希菌、金黃色葡萄球菌、螺旋體、支原體這7種病原體DNA與SFGR DNA同時進行TaqMan qPCR檢測。前3種與SFGR屬于立克次體科下的不同種屬,后四種為臨床較為常見的病原體。結果顯示SFGR核酸擴增有陽性信號,而其他7種均為陰性結果,顯示該方法具有較好的種屬特異性。對重組質粒標準品進行10倍梯度稀釋檢測,最低可檢測出19拷貝,表明該方法具有良好的檢測靈敏度。對同一批次標準品進行組內和組間重復性分析時,兩者變異系數均低(最高僅為1.47%和2.29%),結合構建重組質粒作為試驗的標準品可大量獲取以及長期保存的特點,可以有效保障后續開發標準化診斷試劑盒標準品的一致性。將建立的TaqMan qPCR方法與巢式PCR同時對臨床患者樣本進行檢測,巢式PCR檢測有1份陽性,陽性率為1.25%,熒光定量PCR檢測有8份陽性,陽性率為10.00%,巢式PCR檢測陽性標本用熒光定量PCR檢測為陽性,一致率為91.25%。兩種方法比較差異有統計學意義(P<0.05),且熒光定量PCR檢測的靈敏度高于巢式PCR在檢測較低立克次體含量樣本時有一定的應用價值。熒光定量PCR反應時間短,一般45 min~1 h就能完成反應有利于結果的快速輸出。因此本實驗建立的檢測斑點熱立克次體TaqMan qPCR方法可應用于實驗室對疑似斑點熱患者樣本的快速診斷。

