烏頭對寒、熱痹證大鼠痛覺敏感干預作用的藥效學及作用機制研究
宋敬怡 張碩峰 馬丹 程龍 程文豪 李穎慧
烏頭自古是中醫治療痹證的經典用藥,其性熱、味苦、有大毒。《金匱要略》中明確指出烏頭可祛除濕寒、溫經通絡。現代藥理證明,烏頭具有抗炎鎮痛、保護心血管、抗癌等作用,臨床試驗表明烏頭可使患者的疼痛指數降低,功能障礙改善明顯[1-3]。
痹癥的患病主要外因是機體受到風、寒、濕、熱等外邪入侵,痹證常見的臨床癥狀就是疼痛[4]。痹證引起的疼痛屬于病理性疼痛,具體表現為痛覺敏感,其中神經元可塑性改變引起中樞敏化是慢性炎性疼痛產生的重要機制[5]。本實驗在前期研究基礎之上,利用風寒濕和風熱濕兩種致病因素疊加佐劑型關節炎復制寒痹證、熱痹證模型,企圖進一步擴大檢測痛覺敏感的相關指標,發現痹證寒、熱演變規律,同時了解溫熱藥烏頭對寒、熱痹證的作用差異,這將對中醫的證候研究、中藥的藥性理論研究具有廣泛的示范意義。
1 材料與方法
1.1 實驗動物
健康SD大鼠100只,SPF級,周齡:8周左右,雄性,體重200~250 g,(購于北京斯貝福實驗動物技術有限公司,動物合格證號:11401500032878,11401500032657)。
1.2 實驗藥品
布洛芬緩釋膠囊(中美天津史克制藥有限公司),規格0.4 g/片,即0.8 g布洛芬/人/日(按藥典內容計算),按成人體重75 kg計算,即0.01 g布洛芬/kg,大鼠受試劑量為臨床人用量的6倍,即0.06 g/kg,按大鼠體重1 mL/100 g給藥。
川烏頭(生藥材,由北京百諾威生物科技公司提供),臨床用量為每人每天10 g生藥(按藥典內容計算),按成人體重75 kg計算,即0.13 g/kg,大鼠受試劑量分別為臨床用量的12、6倍,即1.6 g/kg、0.8 g /kg。將烏頭水提物稀釋,濃度分別為 0.16 g /mL、0.08 g /mL。按大鼠體重1 mL/100 g給藥。
1.3 實驗儀器
冷熱盤測痛儀(Cat. No:PE34, 美國IITC公司產品)。
1.4 分組與造模
大鼠100只,隨機分為9組,組別如下:對照組,模型組,布洛芬組,熱痹證組,寒痹證組,烏頭熱痹1.6 g、0.8 g/kg組,烏頭寒痹1.6 g、0.8 g /kg組。
操作環境為無菌條件,在大鼠右后足跖部按0.1 mL/只注射完全弗氏佐劑建立大鼠佐劑型炎癥模型。24 h后按寒熱屬性將需要造模的大鼠分別放入相應的恒溫人工氣候箱中,造模時長為4 h/日,造模周期為14天。熱痹造模條件為:溫度30℃,濕度60%,風速1.5 m/s;寒痹造模條件為:溫度10℃,濕度70%,風速1.5 m/s。
1.5 指標檢測
1.5.1 痛反應時間的檢測 檢測時間分別為第0天(基礎值)、第3天、7天、10天、14天,觀察部位為大鼠的右后肢足趾部。具體測量方法見相關文獻[6],每只大鼠的測量次數總共為3次,每次測量距離上次測量的時間以超過10 min為宜, 痛反應時間則是3次測量數據的平均值。
1.5.2 Western Blot法測量相關蛋白 選取每組半數大鼠用于Western Blot法測量,于末次給藥后禁食12 h,腹腔注射1.5 %戊巴比妥鈉,待大鼠深度麻醉后,開胸使其心臟暴露,由主動脈灌入生理鹽水約200 mL左右,直至流出液體變為淡粉色或無色為止,此時肝臟顏色呈現為土黃色。取出L4~6脊髓節段通過蛋白樣品制備后得到蛋白樣品,通過Western Blot法測量FKN、CX3CR1、NMDA受體表達,分析結果保存圖片。
1.5.3 免疫組織化學法測量相關蛋白 選取每組半數大鼠用于免疫組織化學法測量,末次給藥禁食12h后,深度麻醉取出被根神經節制作成石蠟切片,用免疫組織化學法檢測相關因子的表達,觀察圖片結果。選取各組背根神經節標本數量為9張,每張選取3個視野,于顯微鏡400 倍的視野中觀察,測量各組別背根神經節區域中陽性顯色的平均光密度(average optical density,AOD)。
1.6 統計學處理
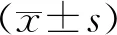
2 結果
2.1 烏頭對寒、熱痹證大鼠痛反應時間的影響
結果表明,模型組大鼠與對照組相比較, 各時間點的痛反應時間均明顯縮短(P<0.05)。布洛芬有鎮痛功效,給藥后,與模型組相比較,布洛芬組大鼠的痛反應時間明顯上調(P<0.05)。風寒濕因素引入后,與模型組相比較,前期可抑制寒痹證組大鼠患足對溫度的敏感性,其中第3、7 天結果最為明顯(P<0.05)。風熱濕因素引入后,與模型組相比較,熱痹證組大鼠的痛反應時間在第3天延長明顯(P<0.05),其余時間點無顯著性差異。
與熱痹證組相比較,寒痹證組大鼠的痛反應時間延長明顯,在第7、10天的結果尤為顯著(P<0.05)。相比熱痹證組,烏頭熱痹證各劑量組給藥后痛反應時間均不同程度縮短,其中第3、7、10天烏頭熱痹證高劑量組作用最為明顯(P<0.05)。相比寒痹證組,烏頭寒痹證各劑量組給藥后,表現為大鼠患足的痛反應時間得到不同程度的延長,其中烏頭寒痹證高劑量組痛反應時間延長作用最明顯(P<0.05),同劑量烏頭寒、熱痹證組相比較,在給藥第7天, 烏頭寒痹證組的痛反應時間顯著性高于同劑量烏頭熱痹證組(P<0.05),見表1。
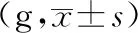
表1 烏頭對寒、熱痹證大鼠痛反應時間的影響
2.2 烏頭對寒、熱痹證大鼠脊髓中FKN、CX3CR1、NMDAR表達的影響
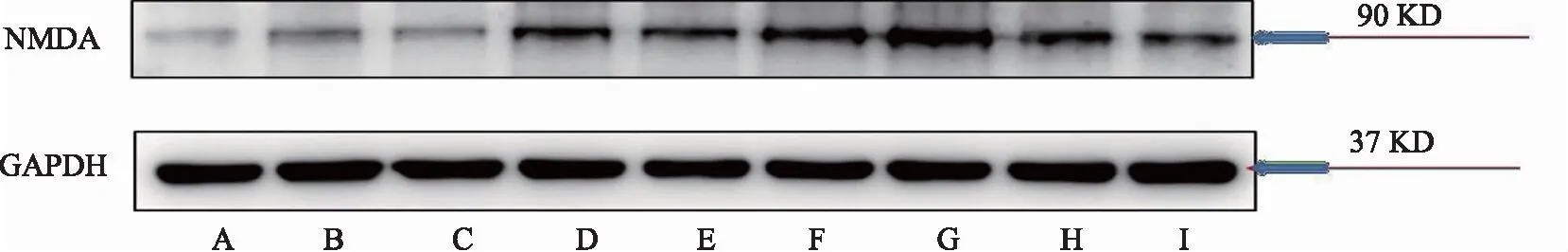
關于FKN結果顯示,造模后,模型組大鼠脊髓中FKN的表達高于對照組,結果具有顯著性差異(P<0.05),布洛芬組FKN的表達顯著性低于模型大組(P<0.05)。與模型組相比較,寒、熱痹證組大鼠脊髓中FKN蛋白表達顯著性增加(P<0.05)。與寒痹證組相比較,烏頭給藥后,寒痹證組有明顯抑制作用,FKN蛋白表達明顯下降,高劑量效果最為明顯(P<0.05)。熱痹證組的結果正好相反,其中烏頭熱痹證高劑量組脊髓的FKN表達最高(P<0.05),同劑量組相比較,顯著性高于同劑量寒痹證組(P<0.05),CX3CR1、NMDAR的結果與FKN的結果基本呈現一致性,見表2、圖1、圖2、圖3。
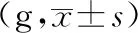
表2 烏頭對寒、熱痹證大鼠脊髓FKN、CX3CR1、NMDAR表達的影響

注:A-對照組,B-模型組,C-布洛芬組,D-熱痹證組,E-寒痹證組,F-烏頭熱痹證0.8 g/kg劑量組,G-烏頭熱痹證1.6 g/kg劑量組,H-烏頭寒痹證0.8 g/kg劑量組,I-烏頭寒痹證1.6 g/kg劑量組。
圖1 烏頭對寒、熱痹模型大鼠脊髓中FKN表達的影響
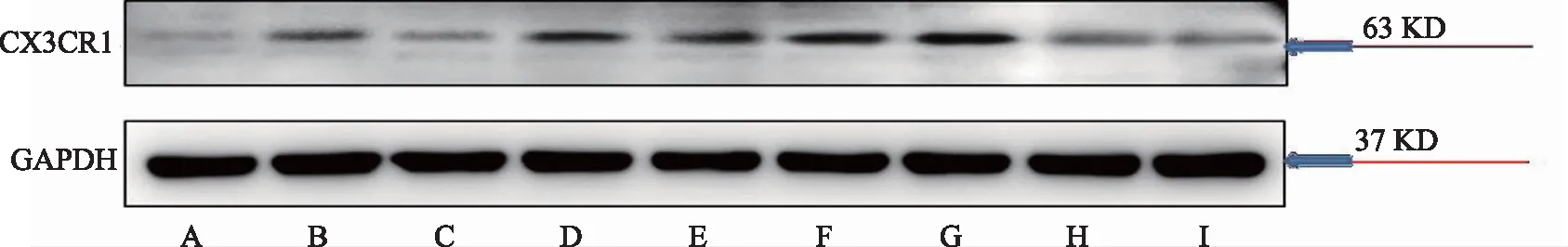
注:A-對照組,B-模型組,C-布洛芬組,D-熱痹證組,E-寒痹證組,F-烏頭熱痹證0.8 g/kg劑量組,G-烏頭熱痹證1.6 g/kg劑量組,H-烏頭寒痹證0.8 g/kg劑量組,I-烏頭寒痹證1.6 g/kg劑量組。
圖2 烏頭對寒、熱痹模型大鼠脊髓中CX3CR1表達的影響
注:A-對照組,B-模型組,C-布洛芬組,D-熱痹證組,E-寒痹證組,F-烏頭熱痹證0.8 g/kg劑量組,G-烏頭熱痹證1.6 g/kg劑量組,H-烏頭寒痹證0.8 g/kg劑量組,I-烏頭寒痹證1.6 g/kg劑量組。
圖3 烏頭對寒、熱痹模型大鼠脊髓中NMDAR表達的影響
2.3 烏頭對寒、熱痹證模型大鼠患側背根神經節中FKN、CX3CR1、CD11b/c、NMDAR表達的影響
結果表明,顯微鏡下,棕黃色顆粒即為FKN、CX3CR1、CD11b/c、NMDAR陽性表達部位,400倍物鏡下拍照,之后用IPP6.0軟件對圖像進行分析。造模后,模型組大鼠背根神經節中FKN的表達上調,顯著性高于對照組(P<0.05)。與模型組比較,布洛芬可明顯抑制大鼠背根神經節中FKN的表達(P<0.05)。風寒濕、風熱濕熱因素的引入后,與模型組相比,寒痹證組、熱痹證組背根神經節中FKN的表達均明顯上升(P<0.05)。與寒痹證組比較,烏頭給藥2周后,發現各劑量可明顯下調寒痹證組FKN的表達(P<0.05)。與熱痹證組比較,烏頭熱痹證各劑量組的結果相反,FKN的表達程明顯上升趨勢,且劑量越大越明顯(P<0.05),且顯著性高于同劑量寒痹證組(P<0.05),CX3CR1、CD11b/c、NMDAR的表達結果與FKN的表達結果呈現出一致性,見表3、圖4、圖5、圖6、圖7。
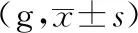
表3 烏頭對寒、熱痹模型大鼠患側背根神經節FKN、CX3CR1表達的影響

注:A-對照組,B-布洛芬組,C-模型組,D-熱痹證組,E-寒痹證組,F-烏頭熱痹證0.8 g/kg劑量組,G-烏頭熱痹證1.6 g/kg劑量組,H-烏頭寒痹證0.8 g/kg劑量組,I-烏頭寒痹證1.6 g/kg劑量組。
圖4 烏頭對寒、熱痹證大鼠背根神經節FKN表達的影響(免疫組化法400×)
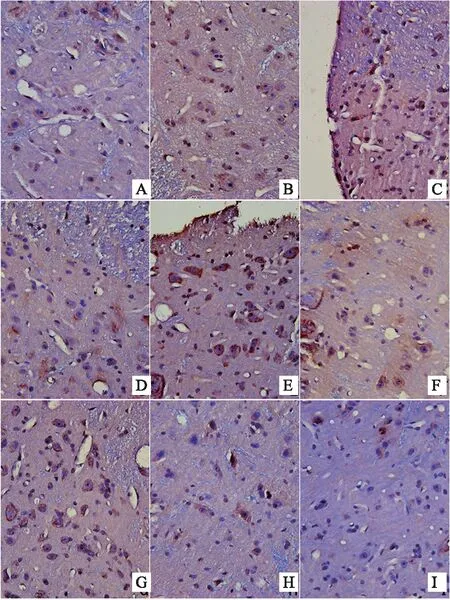
注:A-對照組,B-布洛芬組,C-模型組,D-熱痹證組,E-寒痹證組,F-烏頭熱痹證0.8 g/kg劑量組,G-烏頭熱痹證1.6 g/kg劑量組,H-烏頭寒痹證0.8 g/kg劑量組,I-烏頭寒痹證1.6 g/kg劑量組
圖5 烏頭對寒、熱痹證大鼠背根神經節CX3CR1表達的影響(免疫組化法400×)
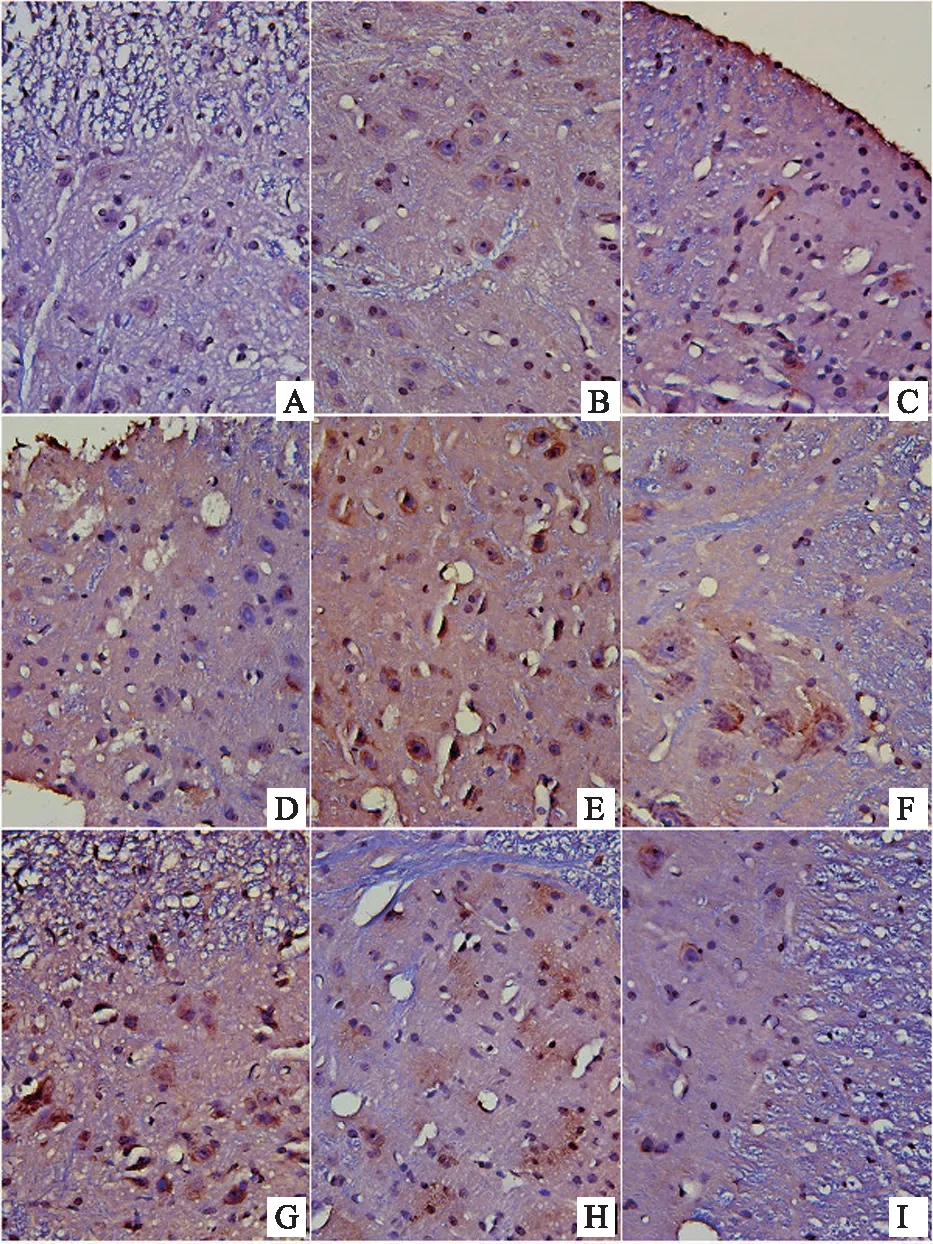
注:A-對照組,B-布洛芬組,C-模型組,D-熱痹證組,E-寒痹證組,F-烏頭熱痹證0.8 g/kg劑量組,G-烏頭熱痹證1.6 g/kg劑量組,H-烏頭寒痹證0.8 g/kg劑量組,I-烏頭寒痹證1.6 g/kg劑量組。
圖6 烏頭對寒、熱痹證大鼠背根神經節CD11b/c表達的影響(免疫組化法400×)
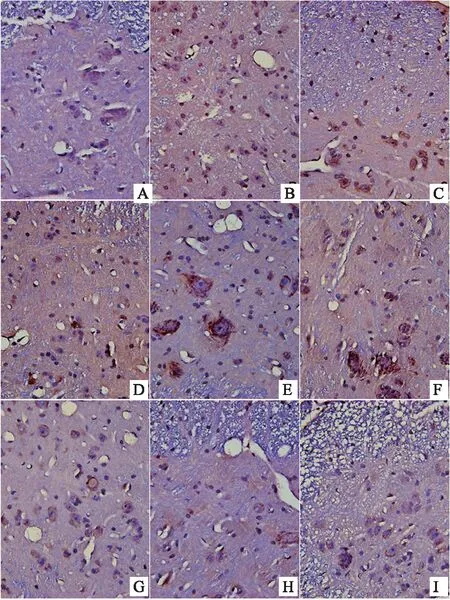
注:A-對照組,B-布洛芬組,C-模型組,D-熱痹證組,E-寒痹證組,F-烏頭熱痹0.8 g/kg劑量組,G-烏頭熱痹證1.6 g/kg劑量組,H-烏頭寒痹證0.8 g/kg劑量組,I-烏頭寒痹證1.6 g/kg劑量組。
圖7 烏頭對寒、熱痹證大鼠背根神經節NMDAR表達的影響(免疫組化法400×)
3 討論
烏頭屬毛茛科植物,其藥用資源十分豐富,主要產地為四川、陜西,據統計可入藥的烏頭種類多達70余種[7-8]。烏頭的功效主要為祛風除濕和溫經散寒,是治療風寒濕痹的代表藥,現在主要用于治療類風濕關節炎、神經性疼痛、中風以及寒涼引起的臟腑之痛等[9]。中國使用烏頭最早的記錄為《金匱要略》中的烏頭湯。現代醫學研究證明,烏頭最主要的抗炎、鎮痛成分為二萜生物堿,是在19世紀80年代從烏頭屬植物中分離得到的,鎮痛的主要部位為脊髓和背根神經節,可改善神經病理性疼痛引起的痛覺過敏[10-14]。
痹證引發的疼痛屬于神經病理性疼痛,其主要發生機制則是中樞敏化。中樞敏化的產生會將疼痛信號放大,使機體對非傷害刺激或正常范圍內的傷害刺激敏感化。大鼠佐劑型關節炎常被用作研究痹證的動物模型,其病理特征與中醫痹證呈現高度的一致性,主要表現為關節腫脹、疼痛敏感。現代研究表明痹證所造成的長期炎癥可造成關節損傷,但其寒熱屬性并不明顯,因此對鎮痛除痹的相關中藥的藥理作用研究存在局限性[15]。故在前期研究的基礎之上,利用佐劑型關節炎大鼠模型,引入風寒濕和風熱濕因素制作寒、熱痹證模型,觀察相關指標的變化。結果顯示正常大鼠的右足跖部在注射完全弗氏佐劑后,第3天后模型組大鼠就表現出痛覺敏感,與對照組相比,痛反應時間明顯縮短,此現象保持到實驗結束(P<0.05)。風寒濕加入后,開始可抑制寒痹證組大鼠患足對溫度刺激的敏感性,隨著時間的推移,風寒濕可加劇寒痹模型組大鼠的痛覺敏感,而風熱濕對熱痹模型組的溫度閾值影響反應小,具體表現為熱痹證組的痛反應時間與模型組相比較,差異無統計學意義。
本研究對寒、熱痹證模型大鼠均給予高、中劑量的烏頭水提物,主要目的是區分熱性中藥對寒、熱痹證大鼠痛覺敏感的干預作用的不同之處。結果顯示,與寒痹證組相比,連續14天給予烏頭水提物,寒痹證組大鼠的痛反應時間得到明顯上調(P<0.05);而熱痹證組給藥后,均加重了熱痹證組大鼠對溫度刺激的敏感性,其中烏頭熱痹1.6 g/kg劑量組最為明顯。由此說明烏頭對寒痹證組大鼠的痛覺敏感有抑制作用,而對熱痹證組大鼠的作用相反。提示:佐劑型關節炎模型大鼠疊加風寒濕、風熱濕制作寒痹證組、熱痹證組與中醫寒、熱痹證的證候特點一致。
前期研究證明,可初級傳入谷氨酸的C纖維以及谷氨酸受體陽性神經元主要分布在脊髓背角淺層,其中在神經病理疼痛形成過程與N-甲基-D-天門冬氨酸受體(N-methyl-D-aspartate receptor,NMDAR)功能變化密不可分。原因是NMDAR可整合并傳遞相關疼痛信息,參與脊髓神經元的可塑性變化。正常情況下,NMDAR處于靜息狀態,Mg2+與內通道相應位點結合阻止Ca2+進入細胞內。當機體受到傷害時,興奮性氨基酸(excitatory amino acids,EAA)在脊髓后角釋放后導致NMDAR被磷酸化,此時NMDAR處于興奮狀態,解除了Mg2+與內通道對應位點的結合,Ca2+大量內流進入背角神經元細胞,誘導持續性放電,并可使興奮不斷循環,疼痛信號持續放大。由此可見神經病理性疼痛的產生與NMDAR的激活以及Ca2+內流關系密切,對脊髓背角神經元的可塑性有重要的意義,是中樞敏化產生的關鍵[16-19]。
大量研究證明神經病理性疼痛的刺激,可將脊髓水平的神經膠質細胞以及小膠質細胞激活,其中神經膠質細胞在痛覺敏感機制調節中發揮著至關重要的作用,可將通過神經元細胞傳入的傷害性信息整合,釋放對應的炎性因子。試驗結果發現寒痹證組、熱痹證組大鼠患側脊髓和背根神經節的不規則趨化因子(Fractalkine,FKN)與CX3CR1受體表達上調。當機體出現痛覺敏感時,FKN在脊髓和背根神經節中的表達均上升, CX3CR1作為FKN的特異性受體,其表達結果與FKN有著高度的一致性,最終可導致細胞間的黏附性增加。炎癥反應會使FKN/CX3CR1系統激活,此時與細胞膜結合的FKN脫離細胞膜,成為游離型FKN,與膠質細胞中的CX3CR1受體結合,此時膠質細胞呈現被激活的狀態[20-21],中樞敏化因此產生。
結果顯示,造模后,相比對照組,炎癥反應導致模型組大鼠脊髓、背根神經節中NMDAR的表達上調(P<0.05)。風寒濕和濕熱因素加入后,與模型組相比,加重了寒、熱痹證組大鼠脊髓中NMDAR的表達(P<0.05),而寒痹證組與熱痹證組相比,熱痹證組更嚴重(P<0.05)。以上結果顯示各模型組大鼠痛覺敏感均已經形成,且風寒濕和風熱濕會加重寒、熱痹證大鼠的痛覺敏感,其中NMDAR在脊髓和背根神經節中的表達上升趨勢與熱痹疼痛的關聯更緊密。與寒痹證組相比,烏頭水提物給藥14天后, NMDAR在寒痹證組當中的表達下調(P<0.05),在熱痹證組表達與之相反(與熱痹證組相比,P<0.05)。綜上所述,NMDAR在烏頭各劑量組大鼠脊髓和背根神經節中表達與其烏頭給藥組大鼠痛反應時間的影響結果一致。
CD11b/c、FKN、CX3CR1的檢測結果與NMDAR檢測結果相似,上述結果顯示,加入風寒濕和風熱濕會加劇寒、熱痹證大鼠痛覺敏感。溫熱藥烏頭對寒、熱痹證的干預作用存在差異,首先烏頭對寒痹證具有明顯的鎮痛作用,但可加重熱痹證的疼痛程度。烏頭的這種干預作用與其調節大鼠脊髓和背根神經節中FKN、CX3CR1、CD11b/c、NMDAR的表達有關。以上結論以期為痹證后續的相關研究提供相關的實驗依據。

