柴胡疏肝散對卒中后抑郁模型大鼠BDNF/TrkB信號通路和炎癥指標的影響
胡 丹 劉元月 盛 蕾
(1.江蘇省第二中醫院,江蘇南京210017;2.南京中醫藥大學,江蘇南京210023)
卒中后抑郁(PSD)是最常見的卒中后神經精神并發癥,可嚴重影響功能恢復并增加死亡風險。國內外研究顯示,PSD發病率大約在30%~40%之間[1],而在新發急性卒中后第一個月時發病達到高峰。如何安全高效地治療PSD越來越引起人們的關注。中藥在PSD治療領域顯示出優勢,其中柴胡疏肝散具有疏肝活血、健脾理氣之效,臨床研究顯示其具有良好的改善PSD抑郁程度的作用[2-3]。本研究我們采用大腦中動脈線栓阻塞法(MCAO)聯合慢性不可預見性溫和應激法(CUMS)建立大鼠PSD模型,進一步觀察柴胡疏肝散的干預作用,并探討可能的機制,現將結果報道如下。
1 實驗材料
1.1 實驗動物 成年健康雄性清潔級SD大鼠,體質量180~210 g,SPF級,購自常州卡文斯實驗動物有限公司,批號:SCXK(蘇)2016-0010。標準混合飼料飼養,保持室溫25 ℃,相對濕度45%,晝夜明暗12 h交替,適應性飼養1周。本實驗通過南京中醫藥大學第二附屬醫院倫理委員會審查。
1.2 實驗藥物 柴胡疏肝散藥物組成為柴胡、白芍、川芎、枳殼、陳皮、甘草、香附,由南京中醫藥大學第二附屬醫院草藥房提供,各味藥物按6∶4.5∶6∶6∶6∶1.5∶4.5的比例取藥,以8倍量水浸泡1 h,加熱回流提取2次,每次1.5 h,合并2次藥液,經3層紗布過濾,在60 ℃下減壓濃縮,得到柴胡疏肝散濃縮液。將濃縮液置于冷凍干燥機中干燥至粉末,保存于-20 ℃冰箱,用時以生理鹽水稀釋。
1.3 儀器與試劑 主要儀器:蛋白電泳及轉膜系統(Bio-Rad);凝膠成像及分析系統(Tannon)。主要試劑:RIPA裂解液(Beyotime,P0013C);蛋白酶抑制 劑Cocktail(Cell Signaling,5872S);蛋 白Marker(Thermo,26625);一抗,均為兔抗大鼠,腦源性神經營養因子(BDNF,SantaCruz,sc-20981),酪氨酸激酶受體B(TrkB,SantaCruz,sc-12);核因子κB(NF-κB,SantaCruz,sc-1190);β-tubulin(Epitomics,1799-1);二抗,羊抗兔(Thermo,A32732);ECL顯色液(Pierce,3206)。血清白介素6(IL-6)、腫瘤壞死因子α(TNF-α)ELISA試劑盒(南京建成生物工程研究所,20170910,20170805)。
2 實驗方法
2.1 分組與造模 大鼠隨機分為假手術組、模型組和柴胡疏肝散高劑量組、低劑量組,每組10只。除假手術組以外,其余各組大鼠以大腦中動脈線栓阻塞法(MCAO)聯合慢性不可預見性溫和應激法(CUMS)誘導抑郁樣行為建立PSD大鼠模型。所有大鼠術前12 h禁食不禁水后采用改良線栓法[4]制備右側MCAO局灶性腦缺血模型。具體手術方法:2%戊巴比妥(50 mg/kg)腹腔注射麻醉,固定,備皮,在大鼠頸部做正中切口,鈍性分離出右側頸總動脈、頸外動脈和頸內動脈,結扎大鼠頸外動脈遠心端,在頸外動脈距離頸總動脈2~3 mm處打一虛結,夾閉頸總動脈和頸內動脈,在頸外動脈結扎處和虛結之間剪一小口,插入栓線,系緊虛結,松開動脈夾,無出血后剪斷頸外動脈,將栓線推入頸內動脈約18 mm,縫合、消毒,90 min后進行再灌注。注意維持大鼠在術中及術后體溫在37 ℃。術后腹腔內注射0.2萬單位青霉素以預防感染,回籠后常規喂養。術后若有大鼠死亡,則補以同批次相似體質量大鼠。造模成功標準:大鼠蘇醒后出現左側前肢彎曲、肩內旋和以對側上肢為重的癱瘓,前進時向手術對側轉圈。選用缺血造模成功的大鼠,手術后第1天開始每天不同時間選取夾尾1 min、禁水24 h、禁食24 h、束縛5 min、晝夜顛倒24 h、電擊1 min、4 ℃冰水游泳5 min等7種刺激方法中的一種[5],交替應激大鼠,避免機體對同種強度的單一應激產生耐受性,共刺激3周。假手術組大鼠無栓線插入,不給予CUMS刺激。
2.2 給藥 造模或手術后按人鼠體表面積換算藥物劑量進行灌胃給藥,共連續給藥21 d。各給藥組劑量分別為:柴胡疏肝散高劑量組生藥量11.8 g/kg,柴胡疏肝散低劑量組生藥量5.9 g/kg。取柴胡疏肝散生藥粉用生理鹽水配成所需濃度的混懸液,給藥體積為1 mL/100 g,假手術組、模型組每天灌胃等體積生理鹽水。
2.3 指標檢測
2.3.1 神經功能缺損評價 分別于造模前、造模后第1天及治療結束第1天進行測試。參照BEDERSON等[6]神經功能評分標準:0級(0分),無神經功能障礙;1級(1分),提大鼠尾,見癱瘓側前肢回收屈曲不能正常伸向地面;2級(2分),除1級體征外,向癱瘓側推時感阻力較對側明顯降低;3級(3分),除以上體征外,大鼠爬行時向癱瘓側旋轉;4級(4分),不能自發行走,意識喪失。
2.3.2 行為學評價 分別于造模前、造模后第1天及治療結束第1天進行測試。糖水偏好試驗:試驗前1 d訓練大鼠適應糖水。禁食24 h后,分別將裝有蒸餾水和1%蔗糖水溶液的水瓶放于鼠籠上,中途交換兩只水瓶的位置。記錄2 h內大鼠攝入蒸餾水及糖水的量,計算糖水偏好率。糖水消耗率(%)=糖水消耗/總液體消耗×100%。強迫游泳試驗:實驗前1 d訓練大鼠適應性游泳15 min。將大鼠放入水深25 cm的玻璃缸內(高26 cm,直徑18 cm),水溫25 ℃。應用DepressionScan觀察6 min內大鼠的運動狀態,記錄入水2 min后大鼠在水中停止掙扎,或呈漂浮狀態,僅有細小的肢體運動以保持頭部浮在水面的持續時間作為強迫游泳不動時間。實驗結束后將大鼠擦干,放回籠中單獨飼養。
2.3.3 血清IL-6、TNF-α水平 治療結束后第1天腹腔注射2%戊巴比妥(50 mg/kg)麻醉大鼠,腹主動脈取血置于抗凝采血管內,以離心半徑10 cm,3 500 r/min離心10 min,分離血清,按照ELISA試劑盒說明書測定血清中IL-6、TNF-α含量。
2.3.4 海馬組織BDNF、TrkB、NF-κB水平 采用4%多聚甲醛固定大鼠后,依據大鼠腦立體定位圖譜取海馬組織,迅速置于液氮中,-80 ℃凍存。用裂解液裂解海馬組織,離心收集蛋白,BCA試劑盒蛋白定量,SDS-PAGE凝膠電泳后轉膜,封閉緩沖液室溫搖床震蕩1 h,加一抗(BDNF、TrkB、NF-κB、Tubulin稀釋度均為1∶1 000),4 ℃孵育過夜。TBST緩沖液洗滌3次,加羊抗兔二抗,孵育1 h。ECL顯色,暗室曝光,采用Quantity One圖像分析軟件對顯色條帶進行分析,采集目的蛋白BDNF、TrkB、NF-κB和Tubulin的灰度比值。
2.4 統計學方法 采用SPSS 19.0統計軟件對相關數據進行統計分析。計量資料用()表示,組內比較采用重復測量資料方差分析,組間比較采用隨機方差分析,不滿足正態分布或方差不齊的數據采用秩和檢驗,以P<0.05為差異有統計學意義。
3 實驗結果
3.1 各組大鼠造模前后與治療后神經功能評分比較 結果見表1。
表1 各組大鼠各時間點神經功能評分比較() 單位:分
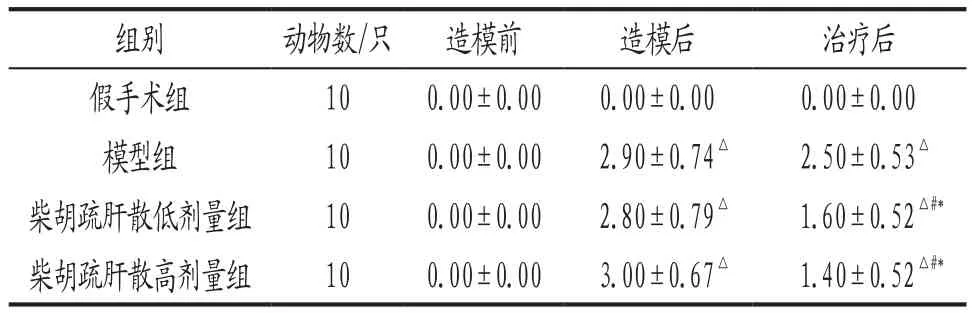
表1 各組大鼠各時間點神經功能評分比較() 單位:分
注: 與同時期假手術組比較,△P<0.05;與同時期模型組比較,#P<0.05;與本組造模后比較,*P<0.05;治療后柴胡疏肝散各劑量組之間比較,差異無統計學意義。
組別 動物數/只 造模前 造模后 治療后假手術組 10 0.00±0.00 0.00±0.00 0.00±0.00模型組 10 0.00±0.00 2.90±0.74△ 2.50±0.53△柴胡疏肝散低劑量組 10 0.00±0.00 2.80±0.79△ 1.60±0.52△#*柴胡疏肝散高劑量組 10 0.00±0.00 3.00±0.67△ 1.40±0.52△#*
3.2 各組大鼠造模前后與治療后糖水消耗率比較 結果見表2。
表2 各組大鼠各時間點糖水消耗率比較() 單位:%
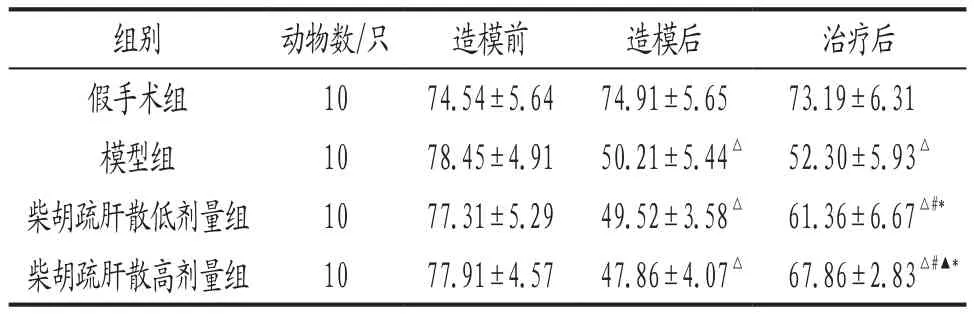
表2 各組大鼠各時間點糖水消耗率比較() 單位:%
注: 與同時期假手術組比較,△P<0.05;與同時期模型組比較,#P<0.05;與同時期柴胡疏肝散低劑量組比較,▲P<0.05;與本組造模后比較,*P<0.05。
組別 動物數/只 造模前 造模后 治療后假手術組 10 74.54±5.64 74.91±5.65 73.19±6.31模型組 10 78.45±4.91 50.21±5.44△ 52.30±5.93△柴胡疏肝散低劑量組 10 77.31±5.29 49.52±3.58△ 61.36±6.67△#*柴胡疏肝散高劑量組 10 77.91±4.57 47.86±4.07△ 67.86±2.83△#▲*
3.3 各組大鼠造模前后與治療后強迫游泳不動時間比較 見表3。
表3 各組大鼠各時間點強迫游泳不動時間比較() 單位:s
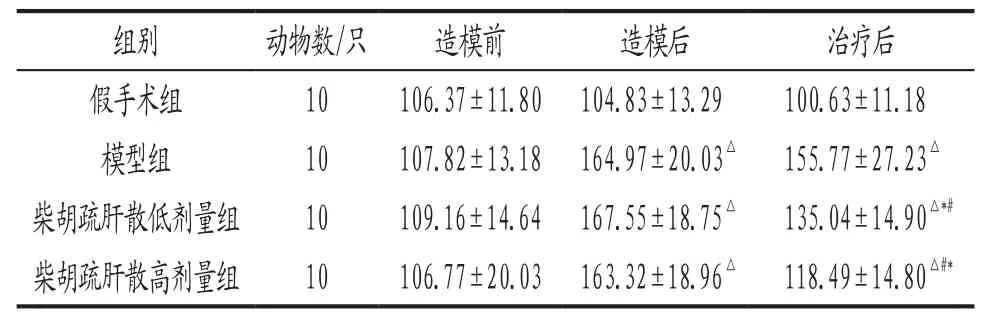
表3 各組大鼠各時間點強迫游泳不動時間比較() 單位:s
注: 與同時期假手術組比較,△P<0.05;與同時期模型組比較,#P<0.05;與本組造模后比較,*P<0.05。
組別 動物數/只 造模前 造模后 治療后假手術組 10 106.37±11.80 104.83±13.29 100.63±11.18模型組 10 107.82±13.18 164.97±20.03△ 155.77±27.23△柴胡疏肝散低劑量組 10 109.16±14.64 167.55±18.75△ 135.04±14.90△*#柴胡疏肝散高劑量組 10 106.77±20.03 163.32±18.96△ 118.49±14.80△#*
3.4 各組大鼠血清IL-6、TNF-α水平及海馬組織BDNF、TrkB、NF-κB表達比較 見表4。
表4 各組大鼠血清IL-6、TNF-α及海馬NF-κB、BDNF、TrkB表達()
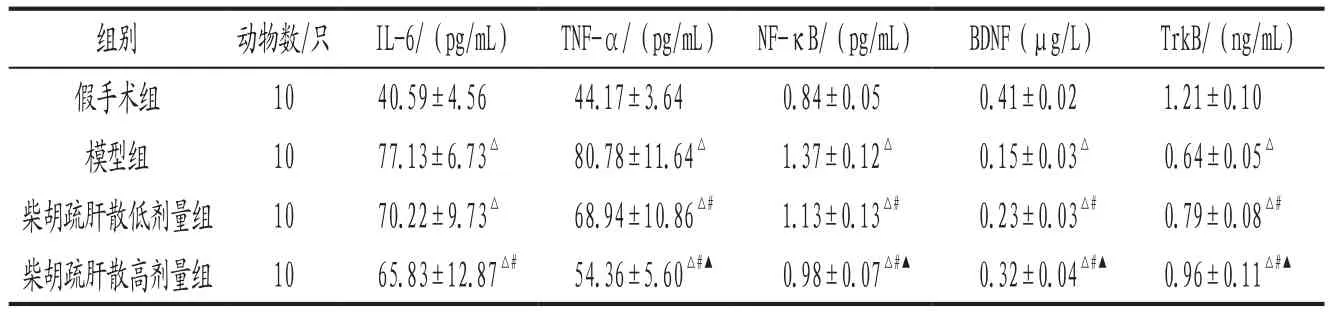
表4 各組大鼠血清IL-6、TNF-α及海馬NF-κB、BDNF、TrkB表達()
注: 與假手術組比較,△P<0.05;與模型組比較,#P<0.05;與柴胡疏肝散低劑量組比較,▲P<0.05。
組別 動物數/只 IL-6/(pg/mL) TNF-α/(pg/mL) NF-κB/(pg/mL) BDNF(μg/L) TrkB/(ng/mL)假手術組 10 40.59±4.56 44.17±3.64 0.84±0.05 0.41±0.02 1.21±0.10模型組 10 77.13±6.73△ 80.78±11.64△ 1.37±0.12△ 0.15±0.03△ 0.64±0.05△柴胡疏肝散低劑量組 10 70.22±9.73△ 68.94±10.86△# 1.13±0.13△# 0.23±0.03△# 0.79±0.08△#柴胡疏肝散高劑量組 10 65.83±12.87△# 54.36±5.60△#▲ 0.98±0.07△#▲ 0.32±0.04△#▲ 0.96±0.11△#▲
4 討論
卒中后抑郁屬中醫學“郁證”與“中風”之共病范疇,與卒中“陰陽失調、氣血逆亂”的基本病機相關,乃因風、痰、火、瘀交熾郁結致氣血郁滯不暢、肝失條達而致,病機特點主要為“肝氣郁滯,脈絡瘀阻”。《素問·六元正紀大論》言“木郁達之”,《證治匯補·郁證》言“郁病雖多,皆因氣不周流,法當順氣為先”,治當疏肝開郁。柴胡疏肝散出自《景岳全書》。方中柴胡辛散苦瀉為疏肝之要藥,功擅疏肝理氣,暢達氣機;川芎活血行氣、通絡止痛,香附疏肝理氣、行氣止痛,共助柴胡疏肝解郁活血;芍藥、甘草酸甘化陰,既養血柔肝,又可防柴胡、香附之辛苦傷陰;陳皮、枳殼升降相因,理氣健脾、燥濕化痰,防肝病傳脾;甘草調和藥性。諸藥相輔相成,使得柴胡疏肝散具有良好的抗抑郁作用。
腦源性神經營養因子(BDNF)作為神經營養因子家族的一員,廣泛存在于中樞與外周,對神經元的增殖、分化和存活至關重要。BDNF與抑郁癥的關系早已被反復證實[7],而近幾年其與PSD的關系也在逐漸被認識[8]。現有研究顯示嚙齒類動物PSD模型中海馬、紋狀體等[9]部位BDNF表達水平下調,五羥色胺在攝取抑制劑(SSRI)治療后水平顯著上調[8]。同時BDNF置換治療也已開始應用于神經變性疾病諸如亨廷頓病、阿爾茲海默病及抑郁癥的動物和臨床試驗中[10]。
我們前期臨床研究發現PSD患者血清BDNF水平顯著下降[2],給予柴胡疏肝散加味后BDNF水平顯著提升。基于BDNF存在外周與中樞平行變化的特點[11],我們建立了大鼠大腦中動脈線栓阻塞法(MCAO)聯合慢性不可預見性溫和應激法(CUMS)復合PSD模型以驗證柴胡疏肝散的中樞作用機制。結果顯示PSD模型大鼠表現出神經功能缺損、糖水消耗量減少、強迫游泳不動時間延長,與相關研究結果一致[8],證實此模型能成功模擬卒中后的功能缺失,并體現了抑郁的核心癥狀——快感缺失和絕望心境。經柴胡疏肝散高低劑量治療21 d后,大鼠神經缺損和抑郁程度較治療前均有明顯減輕;同時柴胡疏肝散高劑量比低劑量更能增加大鼠的糖水消耗率,并縮短強迫游泳不動時間。進一步對模型組大鼠的海馬組織進行分析,可以發現BDNF表達水平顯著下降,而TrkB作為BDNF的特異性功能受體,同樣在海馬區表達降低。眾多研究表明BDNF與其受體TrkB共同作用可增加突觸可塑性,促進軸突及樹突生長,增加突觸末端密度。大量基因學研究證實,抗抑郁藥主要通過激活TrkB信號通路,增加腦內BDNF水平,起到改善抑郁行為的作用。而完整的BDNF/TrkB信號通路不僅是抗抑郁藥促進海馬神經發生,也是其促進前額葉皮質、杏仁核等關鍵部位突觸發生和長時程增強(LTP)的必要基礎[12]。本實驗給予不同劑量的柴胡疏肝散干預,PSD大鼠海馬BDNF和TrkB表達均有顯著上升,而高劑量組表達水平顯著高于低劑量組,初步認為柴胡疏肝散可能通過BDNF/TrkB信號通路發揮抗抑郁作用,并與劑量相關。
以活化的小膠質細胞、星型膠質細胞和表達上調的促炎因子為基礎的神經炎癥也參與了PSD的發病過程[1]。有研究證實臨床患者血清IL-6、TNF-α等炎性因子水平上升與PSD的發生有關[13]。與此報道一致,本研究結果顯示PSD模型大鼠的血清IL-6、TNF-α水平和海馬NF-κB表達顯著升高。NF-κB是炎癥細胞因子基因轉錄的關鍵性調控因子,IL-6、TNF-α等均為其靶基因。NF-κB激活后介導下游眾多炎性反應介質如環氧化酶2(COX-2)、前列腺素E2(PGE2)以及其他眾多炎性因子,直接導致吲哚胺2,3-雙加氧酶(IDO)表達增加,促使色氨酸代謝為犬尿酸,抑制5-羥色胺(5-HT)合成途徑,造成額葉皮質和基底節區等部位5-HT減少,色氨酸有毒產物增加。另一方面促炎因子的增加還會導致HPA軸功能失調,增加卒中后神經功能惡化和死亡幾率,也增加抑郁發生風險[14]。而經柴胡疏肝散治療后血清TNF-α水平和海馬NF-κB表達顯著下降,同時高劑量組上述指標下降更明顯,顯示柴胡疏肝散具有抑制神經炎癥的潛力。
綜上,柴胡疏肝散治療PSD的作用機制可能與調節BDNF/TrkB信號通路,抑制神經炎癥相關。前期網絡藥理學研究也顯示了柴胡疏肝散對PSD的治療作用可能涉及調節炎癥應答、突觸合成等生物學過程[15]。本研究僅初步驗證了柴胡疏肝散對PSD的療效,應進一步明確神經炎癥與突觸功能的關系,深入尋找二者之間的核心介質,有助于進一步揭示柴胡疏肝散治療PSD的科學內涵和PSD發病機制。

