中性粒細胞/淋巴細胞比值及血小板/淋巴細胞比值與乳頭狀甲狀腺癌臨床特征的關系研究
裴曉東,孫占勇,陳世軍
鄭州市第一人民醫(yī)院普外科,鄭州 450000
腫瘤的發(fā)生是復雜的促癌和抑癌分子途徑之間平衡失調的結果[1]。炎癥在癌癥的發(fā)生、發(fā)展和轉移中起著至關重要的作用,腫瘤細胞與炎癥微環(huán)境之間的復雜相互作用可能對患者的預后產生重大影響[2-3]。炎癥細胞對惡性腫瘤的促進與抑制作用取決于腫瘤/宿主相互作用的環(huán)境。炎癥與腫瘤生物學和病程之間的關系仍有待闡明。乳頭狀甲狀腺癌(papillary thyroid carcinoma,PTC)是一種常見的內分泌惡性腫瘤,其發(fā)生與慢性炎癥有密切的關系,但近年來的研究對炎癥和腫瘤行為的研究結果并不一致[4]。甲狀腺炎患者發(fā)生PTC的發(fā)病率提高,慢性淋巴細胞性甲狀腺炎可能最終與PTC患者的預后有關[5]。多項研究顯示炎癥生物標志物[C反應蛋白(C-reactive protein,CRP)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)、中性粒細胞/淋巴細胞比值等]可以可靠地預測各種惡性腫瘤(食管癌、胃癌、胰腺癌、結腸癌、卵巢癌、腎癌、肺癌)的不良預后[6]。中性粒細胞/淋巴細胞比值(neutrophil-to-lymphocyte ratio,NLR)及血小板/淋巴細胞比值(platelet-to-lymphocyte ratio,PLR)作為臨床常用的炎癥標志物,在常規(guī)血液檢測中易于提取。術前較高水平的NLR是一些癌癥的不良預后指標,包括膽管癌、肺癌、胃癌、胰腺癌、結直腸癌和卵巢癌,而術前高水平的PLR與結直腸癌的預后不良有關。但只有少數幾項研究評估了NLR、PLR在甲狀腺癌中的意義,且上述指標在PTC患者術前評估和術后隨訪中的應用仍然是有限和有爭議的[7],不同研究對診斷臨界值的結果差異較大[8]。本研究旨在通過探討術前NLR、PLR與PTC患者臨床特征的關系,為NLR、PLR在PTC患者的臨床診斷及預后預測方面提供理論依據,現報道如下。
1 資料與方法
1.1 一般資料
收集2017年1月至2019年1月在鄭州市第一人民醫(yī)院接受治療的PTC患者的病歷資料。納入標準:①均經病理學檢查證實為PTC;②神志清晰,可與醫(yī)護人員正常交流。排除標準:①合并其他類型甲狀腺癌或其他惡性腫瘤;②合并自身免疫疾病;③患影響白細胞計數的慢性疾病;④術前6個月內發(fā)生急性心肌梗死或冠狀動脈再血管化及術前3個月內大劑量使用過糖皮質激素。根據納入、排除標準,共納入124例PTC患者。
1.2 研究方法
①血液相關指標的收集:在術前全血細胞計數的基礎上,將中性粒細胞、血小板與淋巴細胞的絕對計數除以絕對淋巴細胞數,計算NLR、PLR。根據術前評估方案,在手術前1天上午8:00-10:00采集空腹基線血樣,包括紅細胞壓積、血紅蛋白、血小板、總白細胞和自動區(qū)分計數(中性粒細胞、淋巴細胞、單核細胞、嗜堿性粒細胞和嗜酸性粒細胞)。這一標準化協(xié)議有助于調整已知的循環(huán)激素(晝夜節(jié)律)對白細胞亞型數量和分布的影響。②病理學分析:由兩位病理學家根據手術標本收集甲狀腺標本重量、腫瘤大小、TNM分期、PTC組織學亞型(經典和濾泡變異)及是否有淋巴結轉移、甲狀腺外浸潤、甲狀腺炎等資料。其他變異(彌漫性硬化、高細胞、柱狀細胞、腫瘤細胞、實性、透明細胞、篩狀、鉤甲和去分化)很少見,因此無法進行任何有意義的比較。根據術后病理組織學報告,以病變的最大直徑確定腫瘤大小;多灶性腫瘤是指手術標本中PTC為2個或2個以上病灶;雙側腫瘤定義為影響兩個甲狀腺葉的PTC病變,而單側腫瘤則是單側病變;通過淋巴細胞浸潤和淋巴濾泡的形成確定是否有甲狀腺炎,包括橋本甲狀腺炎和非特異性淋巴細胞性甲狀腺炎。③按所有患者的NLR、PLR中位數將患者分為低NLR組和高NLR組、低PLR組和高PLR組。比較各組的上述臨床特征。
1.3 統(tǒng)計學方法
采用SPSS 18.0統(tǒng)計學軟件進行數據分析,計數資料以例數及率(%)表示,組間比較采用χ2檢驗,計量資料以均數±標準差(±s)表示,兩組比較采用t檢驗,多組比較采用方差分析,以P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 一般情況
本次研究的124例患者中,男46例,女78例;年齡41~67歲,平均(51.43±5.18)歲;腫瘤大小0.8~3.3 cm,平均(2.23±0.61)cm;促甲狀腺激素(thyroid stimulating hormone,TSH)0.29~3.11 mU/L,平均(1.72±0.41)mU/L;白細胞計數4200~10 000/ml,平均(7519±1903)/ml;中性粒細胞 1900~9100/ml,平均(4752±1302)/ml;淋巴細胞900~5200/ml,平均(2058±615)/ml;NLR 0.85~5.94,平均(2.46±0.83),中位數為 2.17;PLR 92.08~164.29,平均(128.15±18.27),中位數為125.96。根據NLR、PLR中位數將患者分為高表達組與低表達組。
2.2 術前PLR、NLR與PTC 臨床特征的關系
不同年齡、腫瘤大小及多灶性腫瘤患者PLR水平比較,差異均有統(tǒng)計學意義(t=3.159、-2.062、-2.041,P<0.05);有無淋巴結轉移PTC患者的NLR水平比較,差異有統(tǒng)計學意義(t=2.195,P<0.05)。(表1)
2.3 不同NLR 亞組患者臨床特征的比較
低NLR組和高NLR組患者年齡、性別、腫瘤大小、甲狀腺外浸潤、多灶性、雙側性、甲狀腺炎、PTC變異型、T分期比較,差異均無統(tǒng)計學意義(P>0.05);低NLR組患者腫瘤標本重量輕于高NLR組,淋巴結轉移發(fā)生率低于高NLR組,差異均有統(tǒng)計學意義(P<0.05)。(表2)
2.4 不同PLR 亞組患者臨床特征的比較
低PLR組和高PLR組患者性別、腫瘤大小、甲狀腺外浸潤、多灶性、雙側性、甲狀腺炎、PTC變異型、T分期比較,差異均無統(tǒng)計學意義(P>0.05);低PLR組患者年齡小于高PLR組,腫瘤標本重量輕于高PLR組,淋巴結轉移發(fā)生率低于高PLR組,差異均有統(tǒng)計學意義(P<0.05)。(表3)
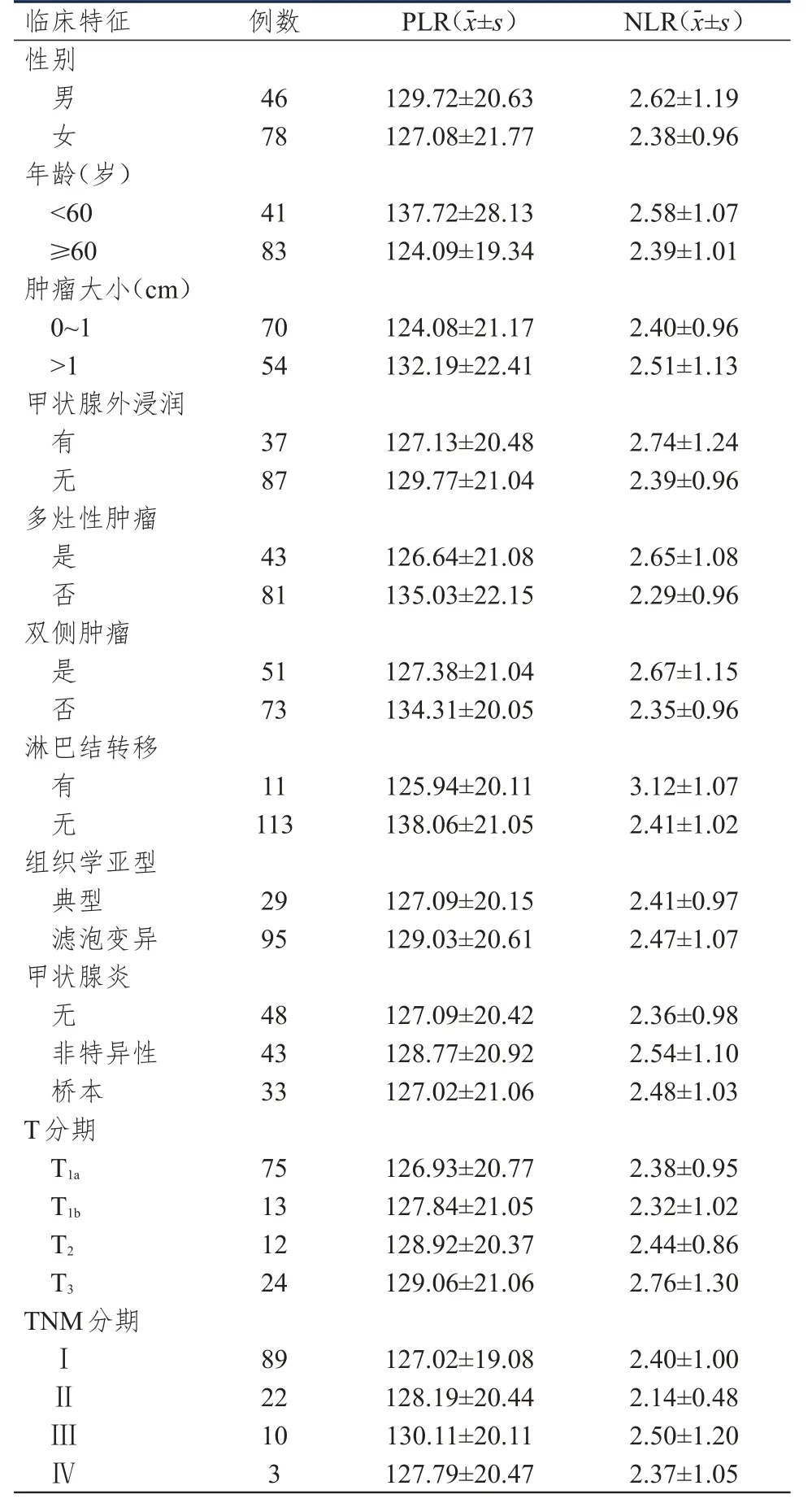
表1 不同臨床特征PTC患者的PLR、NLR水平(n=124)
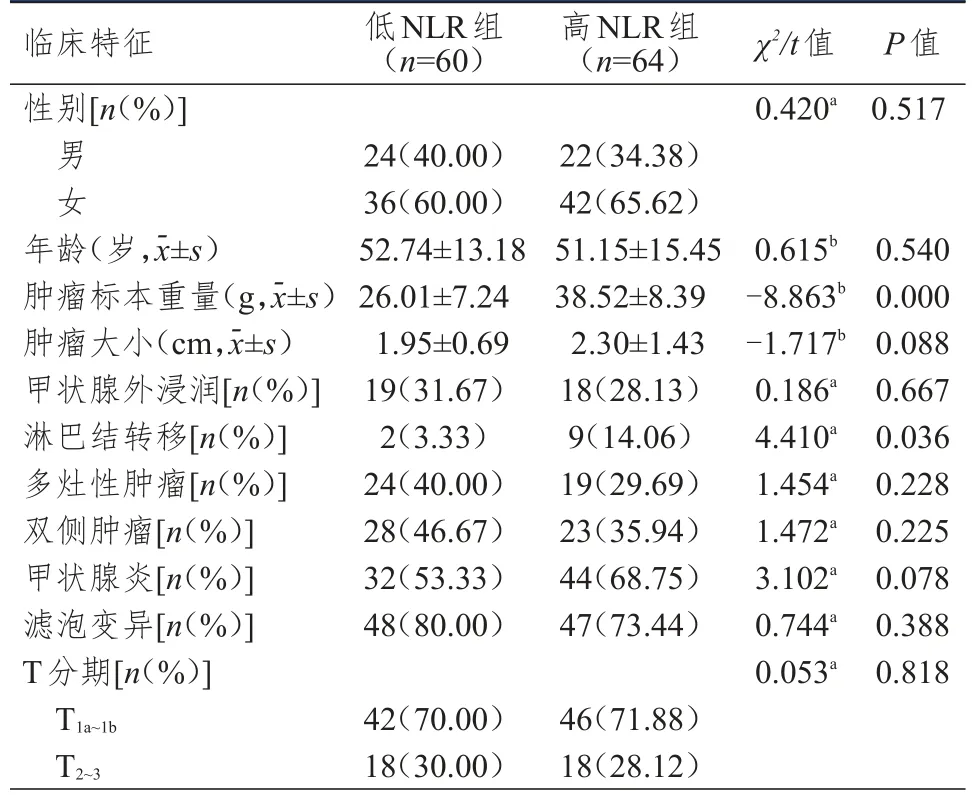
表2 低NLR組和高NLR組患者臨床特征的比較(n=124)
3 討論
對于慢性炎癥與癌癥之間的潛在聯系,大量學者在過去幾十年中對其潛在機制進行了廣泛研究,消化系統(tǒng)惡性腫瘤就是很好的例子(慢性幽門螺桿菌性胃炎與胃癌,慢性乙型肝炎和丙型肝炎與肝細胞肝癌,特發(fā)性炎癥性腸病與結直腸癌)[9]。在甲狀腺研究領域,Dailey于1955年首次提出慢性淋巴細胞性甲狀腺炎與PTC的關系[10]。大量研究顯示部分腫瘤被巨噬細胞和淋巴細胞(非特異性免疫系統(tǒng)和特異性免疫系統(tǒng)的細胞)密集地浸潤于原發(fā)腫瘤內部及周圍[11-15]。特異性免疫系統(tǒng)的淋巴細胞已經進化成一種更多功能的防御系統(tǒng)細胞,并在被同一病原體再次感染后提供更多的保護[16]。特別是在惡性腫瘤的病例中,腫瘤相關的中性粒細胞減少和(或)淋巴細胞減少被認為是一種副腫瘤表現,或者是由于局部組織破壞和細胞因子釋放而引起的癌癥相關炎癥的非特異性反應。
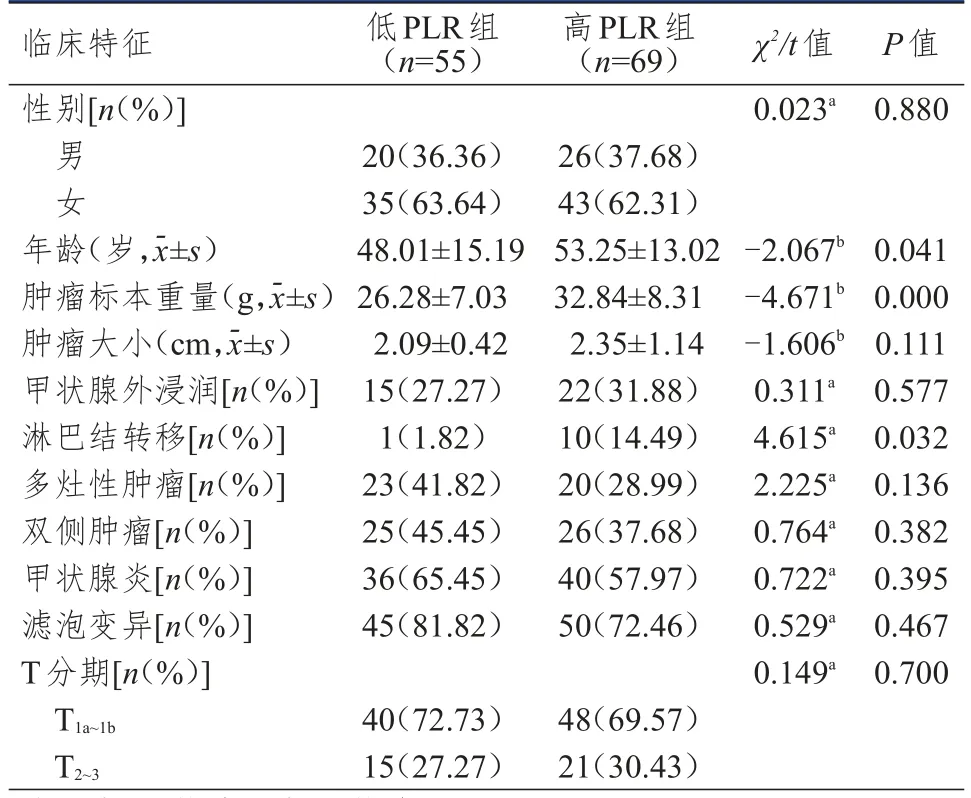
表3 低PLR組和高PLR組患者臨床特征的比較(n=124)
一般來說,較高的NLR、PLR與較大的腫瘤有關,并與多灶性、淋巴結轉移和更高的TNM分期有關,顯示出更積極的腫瘤行為和更高級的疾病分期。本研究證實了NLR與腫瘤分布不良的關系,即NLR與淋巴結轉移有關,不同PLR亞組患者年齡、腫瘤標本重量及淋巴結轉移情況比較,差異均有統(tǒng)計學意義。與其他實體腫瘤相比,PTC的NLR、PLR相對較低,這一點也在本研究中得到證實。對多種腫瘤NLR與患者預后的關系進行綜合Meta分析,發(fā)現NLR、PLR與患者預后的相關性較高[17]。在分子水平上,RET原癌基因(RET protooncogene,RET)/RAS/鼠類肉瘤濾過性毒菌致癌同源體B(v-raf murine sarcoma viral oncogene homolog B,BRAF)/胞外調節(jié)蛋白激酶(extracellular regulated protein kinase,ERK)/絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的上調是慢性甲狀腺炎與癌變的可能機制之一。最近的研究進一步表明,PTC根據與甲狀腺炎的關系不同而具有不同的遺傳背景(BRAF的表達)[18]。也有證據證明,RET/PTC癌基因可以激活正常甲狀腺細胞的轉錄前炎癥程序。這種腫瘤與宿主的相互作用,以全身炎性反應的形式出現,在大多數現代預后系統(tǒng)中通常不被考慮。但炎性生物標志物(CRP、細胞因子和白細胞計數)可作為多種腫瘤(食管癌、胃癌、胰腺癌、大腸癌、間皮瘤、卵巢癌、腎癌、膀胱癌)的獨立預后因素[19]。近年來,NLR、PLR已成為衡量全身炎性反應的簡單有效的綜合指標。雖然其檢測廉價,容易計算,容易獲得,但它應用于術前評估和術后隨訪的PTC患者仍然是一個爭議的問題。迄今為止,在高分化甲狀腺癌中檢測NLR的研究在樣本量上是不均勻的,樣本差異很大(41~3364例PTC病例),并得出了不一致的結果[20]。這一現象歸因于炎癥在甲狀腺癌變過程中可能不那么重要,以及分化型甲狀腺癌相對遲鈍的性質,后者導致全身炎性反應不那么強烈。無論如何,NLR、PLR在很大程度上仍然是全身炎癥的非特異性生物標志物,在常規(guī)血液測試中是普遍可用的,并不會增加術前診斷工作的成本。
綜上所述,PTC患者NLR水平不同,腫瘤標本重量及淋巴結轉移情況具有顯著差異,患者PLR水平不同,年齡、腫瘤標本重量及淋巴結轉移具有顯著差異,提示上述指標可作為PTC轉移的預測指標。

