作用于配體門控氯離子通道3-羥基異噁(噻)唑衍生物的研究進展
肖 勝,王 倩,鐘慧勉,巨修練,劉根炎
武漢工程大學化工與制藥學院,湖北 武漢430205
3-羥基異噁唑和3-羥基異噻唑屬于五元芳香雜環化合物,它們存在兩種互變異構體(圖1),3-羥基異噁(噻)唑(烯醇式)和異噁(噻)唑啉-3-酮(酮式)。在非極性溶液中它們主要以烯醇式結構存在,隨著溶液極性增加,酮式結構逐漸成為主要存在形式[1-3]。3-羥基異噁(噻)唑芳環上的羥基有相對較高的酸性,這一性質使得它們在藥物設計中可以作為羧基的生物電子等排體。3-羥基異噁唑和3-羥基異噻唑的pKa值分別為5.85和7.54,酸性的差異被認為是兩種化合物及其類似物表現出不同藥理或生理作用的主要因素之一[3-4]。
19世紀60年代中期,科學家們發現了兩種天然的3-羥基異噁唑衍生物(圖2):蠅蕈醇(muscimol)和鵝膏氨酸(ibotenic acid,IBA)。它們對γ-氨基丁酸(γ-aminobutyric acid,GABA)受體和谷氨酸(L-glutamic acid,glutamate)受體獨特的生理活性引發了研究者的極大關注;藥物化學家進一步修飾了其結構,合成了一系列具有藥理活性的3-羥基異噁(噻)唑衍生物。GABA和glutamate(圖2)分別是動物中樞神經系統重要的抑制性和興奮性神經遞質[5-6],它們與各自受體相互作用而廣泛參與神經系統的各種功能[7-9]。
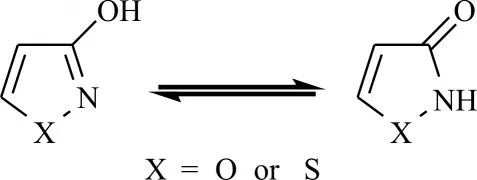
圖1 3-羥基異噁(噻)唑的酮式和烯醇式的互變異構Fig.1 Keto and enol tautomerization of 3-hydroxyisoxazole and 3-hydroxyisothiazole
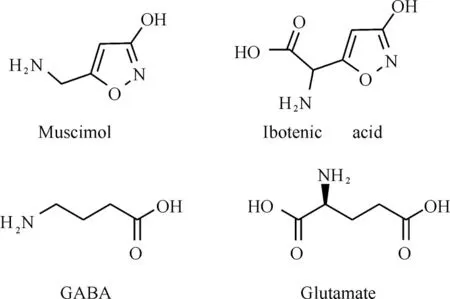
圖2蠅蕈醇、鵝膏氨酸、γ-氨基丁酸和谷氨酸的化學結構Fig.2 Chemical structures of muscimol,ibotenic acid,GABA and glutamate
1 GABA和Glutamate門控氯離子通道
20世紀50年代,科學家首次從哺乳動物的腦萃取液中提取了GABA,并鑒定了其分子結構[10]。對一些哺乳動物和無脊椎動物體內GABA的含量測試結果表明,GABA在抑制性神經元中的含量遠遠高于其在興奮性神經元中的含量。隨后大量的研究表明GABA是動物神經系統中主要的抑制性神經遞質[11-13],其作用靶標為GABA受體。Glutamate是動物中樞神經系統中主要的興奮性神經遞質,它與離子型谷氨酸受體(ionotropic glutamate receptors,iGluRs)和代謝型谷氨酸受體(metabotropic glutamate receptors,mGluRs)結合而發揮相應的生理作用[14]。
GABA受體廣泛存在于動物的中樞和外周神經系統中,可分為離子型(A型和C型)和代謝型(B型)。A型和C型GABA受體屬于半胱氨酸環配體門控離子通道家族[13],因此也被稱為GABA門控氯離子通道。GABA通過動作電位觸發的去極化從突觸前神經元釋放到突觸間隙中,釋放的GABA與位于突觸后膜中的離子型GABA受體結合,引起突觸后神經元的細胞膜的電位變化。GABA還可激活代謝型的GABA受體以引發細胞內的信號轉導[13,15-16]。
離子型GABA受體(圖3)由5個相同或不同的亞基構成,因此存在多個不同的亞型[17-19]。目前報道的哺乳動物離子型GABA受體的亞基有19個(α1-6、β1-3、γ1-3、δ、ε、π、θ和ρ1-3),它們可以形成同源或異源的五聚體[17]。存在于哺乳動物大腦中的主要的GABA受體(A型)亞型是由兩個α1亞基、兩個β2(或β3)亞基和一個γ2亞基構成[20]。含有ρ亞基的離子型GABA受體被歸類為C型GABA受體,這種類型的受體往往被認為是一組特殊的A型GABA受體,它和A型GABA受體具有不同的藥理特性。A型GABA受體每個亞基由約500個氨基酸殘基組成,具有相同的構成部分:較長的N-末端細胞外結構,內含半胱氨酸二硫鍵環,由200多個氨基酸殘基構成;4個跨膜序列(TM1-4);連接TM3和TM4區段的長而可變的細胞內環狀結構。每個亞基的TM2結構構成氯離子通道內壁(圖3)。GABA結合位點位于兩個相鄰亞基的N-端細胞外結構之間的正構位點。
B型GABA受體屬于G蛋白偶聯受體。這種類型的受體通過激活特異性偶聯于效應蛋白的G蛋白轉導信號,也被稱為代謝型GABA受體[21]。B型GABA受體廣泛分布在整個神經系統中,并且在一些細胞中與A型GABA受體協同發揮作用。B型GABA受體存在于突觸前膜和突觸后膜上。在突觸前膜,B型GABA受體誘導鉀電導并降低鈣電導,從而抑制GABA在突觸前膜中釋放。在突觸后膜上,B型GABA受體誘導鉀電導,導致鉀離子內流,進而引起緩慢的超極化。與其他G蛋白偶聯受體相比,B型GABA受體與mGluRs具有高度相似的氨基酸序列[22-23]。
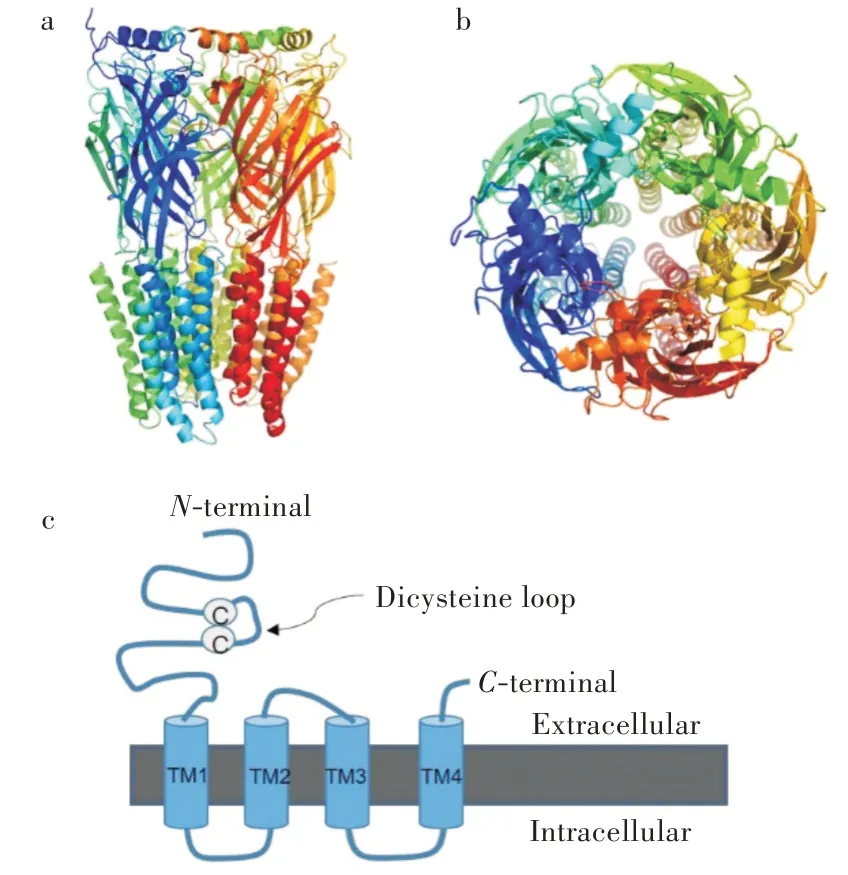
圖3 A型GABA受體及其亞基圖示:(a)A型GABA受體側視圖,(b)A型GABA受體俯視圖,(c)A型GABA受體亞基示意圖Fig.3 Schematic presentation of GABAA receptors and its subunit:(a)side view of GABAA receptor,(b)top view of GABAA receptor,(c)subunit of GABAA receptors
iGluRs屬于配體門控離子通道家族,根據激動劑的不同的選擇性可分為三類,N-甲基-D-天門冬氨酸受體(N-methyl-aspartatereceptor,NMDA受體),α-氨基-3-羥基5-甲基-4-異惡唑丙酸受體(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionicacid receptor,AMPA受體),紅藻氨酸受體(kainic acid receptor,KA受體)[24-25]。目前,NMDA受體有(NR1,NR2A-D,NR3A-B)7種亞單位被鑒定,AMPA受體有(GluR1-4)4種亞單位被鑒定,KA受體有(GluR5-7,KA1-2)5種亞單位被鑒定[24-26]。mGluRs是一個與G蛋白偶聯的7次跨膜結構。目前,已經發現了8個mGluRs(mGluR1-8)亞基,根據它們氨基酸序列的相似性和信號轉導路徑可將其 分 為3類[27-28]。第I類mGluRs包 括mGluR1s和mGluR5s;第II類mGluRs包 括mGluR2s和mGluR3s;第III類mGluRs包括mGluR4s、mGluR6s、mGluR7s和mGluR8s。第II類和第III類mGluRs有相似的藥理學性質,在突觸前膜和后膜均有表達[27-28]。
2 Muscimol及其衍生物
Muscimol是一種天然化合物,最早是在毒蠅鵝膏菌(Amanita muscaria)中發現的[29]。從化學結構上看,muscimol是GABA的3-羥基異噁唑生物電子等排物,其對A型GABA受體表現出較強的激動活性[9,30-31]。此外,muscimol抑制神經元和神經膠質的GABA攝取,同時它也是GABA代謝酶和GABA轉氨酶的底物。Thio-muscimol(圖4)是人工合成的muscimol含硫類似物,表現出了與muscimol相類似的藥理學特性[32-35]。
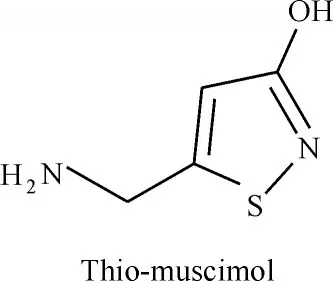
圖4 Thio-muscimol的化學結構Fig.4 Chemical structure of thio-muscimol
研究表明muscimol是昆蟲GABA受體的激動劑,其效價一般優于GABA。Liu等[9]對muscimol進行了結構修飾,將5位的氨基替換為酰胺基,合成了5-氨基甲酰基-3-羥基異噁唑(5-carbamoyl-3-isoxazolol,5-CIOL)。這一微小的結構變化使得化合物5-CIOL對家蠅(Musca domestica)GABA受體顯示出拮抗而非激動活性。他們還進一步在5-CIOL異噁唑環的4位引入雙環芳香基團,得到一系列4-芳基-5-氨基甲酰基-3-羥基異噁唑衍生物(圖5),并測定了該系列衍生物對家蠅GABA受體4種剪接變異體(ac,ad,bc和bd)的活性。結果表明這一系列衍生物反而表現出明顯的競爭拮抗作用,對4種剪接變異體的IC50值在微摩爾水平,其中5-甲酰氨基-4-(3-聯苯基)-3-羥基異噁唑(化合物1,圖5)活性最好,IC50值在30~107μmol/L間。其研究結果表明5-CIOL類衍生物屬于昆蟲GABA受體的競爭性拮抗劑,可作為先導化合物,用來進一步設計和開發作用于昆蟲GABA受體的競爭性拮抗劑類殺蟲劑。

圖5 5-CIOL及其衍生物的化學結構Fig.5 Chemical structures of 5-CIOL and its analogs
Muscimol和Thio-muscimol的單環衍生物對GABA受體各種亞型均具有激動或拮抗作用,研究表明將它們修飾為雙環衍生物可以得到許多特異性A型GABA受體激動劑或拮抗劑,這些化合物對A型GABA各種亞型的親和力有較大的區別[36]。4,5-二氫蠅蕈醇(4,5-dihydromuscimol,DHM)的S構型(S)-DMH(圖6)是構造muscimol的雙環衍生物的關鍵中間體,是一種具有選擇性、高效的A型GABA受體激動劑,而(R)-DMH則是活性很低的GABA受體拮抗劑。4,5,6,7-四氫異噁唑[5,4-c]吡 啶-3-醇(4,5,6,7-tetrahydro-isoxazolo[5,4-c]pyridin-3-ol,THIP)和4,5,6,7-四氫異噁唑[4,5-c]吡啶-3-醇(4,5,6,7-tetrahydroisoxazolo[4,5-c]pyridin-3-ol,THPO)是兩個典型的muscimol雙環衍生物,其中THIP是一種特異且高效的A型GABA受體激動劑[37],而THPO是一種GABA受體拮抗劑,且對神經膠質運輸系統具有一定選擇性。Thio-THIP對脊髓中包含δ亞基的A型GABA受體激動作用較弱,但對大腦中包含δ亞基的A型GABA受體有明顯拮抗作用。此外,研究表明THIP的 七元環狀 類似物THIA對A型GABA受體沒有明顯的親和力[38-41]。
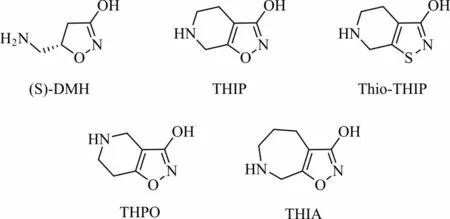
圖6(S)-DMH、THIP、Thio-THIP、THPO和THIA的化學結構Fig.6 Chemical structures of(S)-DMH,THIP,Thio-THIP,THPO and THIA
3 4-PIOL及其衍生物
5-(4-哌 啶 基)-3-羥 基 異 噁唑[5-(4-piperidyl)-3-isoxazolol,4-PIOL]和5-(4-哌啶基)-3-羥基異噻唑[5-(4-piperidyl)-3-isothiazolol,Thio-4-PIOL]是兩個典型的A型GABA受體部分激動劑[42],它們具有相似的藥理學活性。Fr?lund等[42]發現4-PIOL衍生物對哺乳動物A型GABA受體有較好的競爭拮抗作用。在此研究基礎上,Liu等[43]通過對Thio-4-PIOL的結構進一步修飾,探究了其對昆蟲GABA受體的活性,發現在異噻唑環的4位引入芳香基團時,Thio-4-PIOL衍生物轉化為了昆蟲GABA受體的競爭性拮抗劑,且大的芳香基團更有利于提高其競爭拮抗活性。兩個典型的Thio-4-PIOL衍生物4-(3-聯苯基)-5-(4-哌啶基)-3-羥基異噻唑(化合物2,圖7)和4-(2-萘基)-5-(4-哌啶基)-3-羥基異噻唑(化合物3,圖7)對昆蟲GABA受體表現出較高的競爭性拮抗效應,其對家蠅GABA受體IC50值分別為20.4和29.6μmol/L。部分Thio-4-PIOL衍生物在哺乳動物A型GABA受體中顯示出納摩爾級的競爭拮抗活性[42-43],與此相比,在昆蟲GABA受體中該類化合物的活性仍然較低,因此針對這類化合物進行結構優化,有望開發出更有效和選擇性的昆蟲GABA受體競爭性拮抗劑。

圖7 4-PIOL和Thio-4-PIOL及其衍生物的化學結構Fig.7 Chemical structures of 4-PIOL,Thio-4-PIOL and Thio-4-PIOL analogs
4 IBA和Thio-IBA及其衍生物
IBA是一種天然存在的興奮毒素,最初從毒蠅鵝膏菌中分離出來。由于其對iGluRs的激動作用,它已被廣泛用作藥理學以及神經毒理學工具[44-45]。IBA是glutamate的3-羥基異噁唑的類似物,它可以與KA受體(親和力較低)、NMDA受體、第I類mGluRs及第II類mGluRs結 合,發揮 相應的作用。Thio-ibotenic acid(Thio-IBA)是IBA的含硫類似物,最初由Bunch等人合成得到。Thio-IBA表現出了與IBA顯著的藥理學差異,Thio-IBA和IBA作為激動劑均可以以相似的效率激活第I類mGluRs和 第II類mGluRs,有 趣 的 是 對 于 第III類mGluRs前者的激動效率是后者的500倍[45-47]。基于Thio-IBA的獨特藥理學活性,J?rgensen等[14]合成了一系列Thio-IBA類似物(圖8),探究了它們對mGluRs的結合活性,結果表明,在異噻唑環4位引入小體積取代基(如氯、溴、甲基或乙基)的Thio-IBA的類似物保留了對第II類mGluRs的活性,但對第I類mGluRs和第III類mGluRs的結合活性喪失了。據此可進一步探究其構效關系,有望開發出新型特異性glutamate受體激動劑以及拮抗劑。

圖8 IBA及其衍生物的化學結構Fig.8 Chemical structures of IBA and its analogs
5 結論
3-羥基異噁(噻)唑衍生物具有獨特且豐富的藥理和生理活性,它們對GABA和glutamate受體表現出一定的特異性和選擇性。因此,選取典型的3-羥基異噁(噻)唑衍生物作為先導化合物,進行分子結構修飾,有望得到作用于GABA受體或glutamate受體的新型拮抗劑或激動劑,也可以對它們的生理藥理活性進行更深入的研究。

