新型冠狀病毒肺炎患者心臟損傷機制及表現研究進展
賈碩,程功
由嚴重急性呼吸綜合征冠狀病毒2(SARS-CoV-2)引起的新型冠狀病毒肺炎(corona virus disease 2019,COVID-19)現已成為世界流行性疾病。SARS-CoV-2是一種正鏈RNA病毒,是已被臨床證實的感染人類的第7種冠狀病毒。據美國約翰斯·霍普金斯大學實時統計,截至2020-06-02,全球COVID-19累計確診病例超630萬例,累計死亡病例超37萬例[1]。
心臟損傷是COVID-19繼發性損傷的主要表現,其可能會使COVID-19患者死亡風險增加3~5倍[2]。武漢的一項研究顯示,416例COVID-19住院患者中有82例并發心肌損傷,在排除年齡及其他合并癥影響后,該患者病死率仍然較高[3]。一項薈萃分析結果表明,COVID-19病情越嚴重,則患者急性心臟損傷發生風險越高,而該并發癥與患者病死率密切相關[4]。COVID-19常見心臟并發癥包括心律失常(包括心房顫動、室性心動過速和心室顫動)、急性心肌炎、心肌梗死和心力衰竭。研究表明,與肌鈣蛋白I(TnI)或肌鈣蛋白T(TnT)水平正常的COVID-19患者相比,出現心臟并發癥者的年齡較大,其高血壓、冠心病、心力衰竭和糖尿病發病率較高[5]。本文就COVID-19對心臟損傷的作用機制及表現進行綜述。
1 SARS-CoV-2及COVID-19命名
冠狀病毒是冠狀病毒科家族的一部分,其命名來自于該病毒在電子顯微鏡下的冠狀外觀,其外觀是由裝飾病毒的表面糖蛋白引起的。冠狀病毒科包括冠狀病毒亞科和Leto亞科。冠狀病毒亞科包括α冠狀病毒屬、β冠狀病毒屬、γ冠狀病毒屬和δ冠狀病毒屬,其中α冠狀病毒屬和β冠狀病毒屬通常僅感染哺乳動物,而γ冠狀病毒屬和δ冠狀病毒屬通常感染禽類,有時也感染哺乳動物。目前已知的Leto亞科是一種可感染小雨蛙的病毒,如姬蛙甲型勒托病毒1型(MLeV)。冠狀病毒是人類常見的病原體,兩種α冠狀病毒(229E、NL63)和兩種β冠狀病毒(OC43、HKU1)感染可導致人類發生上呼吸道感染,而對人類更具致病性的冠狀病毒是嚴重急性呼吸綜合征冠狀病毒1(SARS-CoV-1)、中東呼吸綜合征冠狀病毒(MERS-CoV)及目前流行的SARSCoV-2,均屬于β冠狀病毒屬。2020-02-11,國際病毒分類學委員會的冠狀病毒科研究小組(CSG)正式將新型冠狀病毒命名為SARS-CoV-2,世界衛生組織(WHO)也正式將由SARS-CoV-2引發的肺炎正式命名為COVID-19[6]。
2 COVID-19影響心臟的可能機制
2.1 血管緊張素轉換酶2(ACE2)功能喪失 周細胞是一種血管周圍壁細胞。與位于冠狀動脈或小動脈的平滑肌細胞不同,周細胞分布于毛細血管內皮細胞及部分小靜脈,可能在心肌微循環中具有重要作用。人類心臟單細胞圖譜顯示,周細胞是SARS-CoV-2在人類心臟中潛在的靶向宿主細胞,而心臟中的周細胞又可表達ACE2,可見心臟對SARS-CoV-2具有本身的易感性[7]。
SARS-CoV-2基因組與MERS-CoV基因組的同源性高達75%~80%,二者使用相同的ACE2受體,但相較于MERSCoV,SARS-CoV-2與人ACE2受體更具親和力[8],這可能是SARS-CoV-2致病性較MERS-CoV更強的原因,細胞表面ACE2受體耗盡也是COVID-19的重要病理結果。ACE2及其受體可能在COVID-19合并心血管疾病(CVD)患者中具有重要意義,一方面,ACE2可對抗高血壓、心肌纖維化、心肌肥大、心律不齊、動脈粥樣硬化及水鈉潴留[9];另外,ACE2受體是SARS-CoV-2感染的“大門”,隨著SARS-CoV-2病毒顆粒的內吞,導致了ACE2介導的心血管保護作用喪失。GHEBLAWI等[8]研究發現,ACE2/血管緊張素 1-7(Ang1-7)驅動的通路激活可使血管緊張素Ⅱ(Ang Ⅱ)水平升高,進而導致心肌纖維化、心肌肥厚、活性氧(ROS)含量增加、血管收縮和腸道菌群失調;同時,腎素-血管緊張素系統(RAS)過度激活可引起去整合素-金屬蛋白酶17(ADAM17)介導的ACE2蛋白水解和胞外結構域脫落,進而導致心力衰竭、心房顫動、冠狀動脈疾病發生。
2.2 細胞因子風暴 細胞因子風暴綜合征是一種嚴重威脅人類生命的疾病,主要臨床癥狀包括全身性炎癥、高鐵血紅蛋白血癥、血流動力學不穩定和多器官功能衰竭[10]。細胞因子風暴綜合征的特點是免疫反應失控,涉及淋巴細胞和巨噬細胞的持續激活和增殖。一項針對心臟損傷與病死率關系的研究表明,心臟損傷患者炎性反應標志物如C反應蛋白、降鈣素原和白細胞計數明顯升高[3]。SARS-CoV-2感染呼吸道尤其是2型肺細胞,可表現為全身炎癥和免疫細胞過度激活、T輔助分子1和T輔助分子2反應不平衡,從而導致“細胞因子風暴”[11],進而導致白介素(IL)-6、IL-7、IL-22和干擾素誘導蛋白10(CXCL10)等細胞因子水平升高。隨后,活化的T細胞和巨噬細胞可能滲入感染的心肌,導致急性心肌炎和嚴重心臟損傷[12]。
2.3 內皮細胞感染與內皮炎 COVID-19可導致心內膜炎,進而造成COVID-19患者心臟微循環功能受損。一項針對COVID-19患者的病理結果表明,內皮細胞內存在病毒成分和炎性細胞的積聚[13]。因此,無論通過直接感染心臟內皮細胞還是免疫介導均可能導致與細胞凋亡相關的心臟內皮功能障礙。
2.4 低氧血癥 嚴重COVID-19可導致肺透明膜形成,引起肺通氣和換氣功能障礙,從而導致低氧血癥,而心肌細胞對缺氧較敏感。低氧導致外周血管收縮,同時增加了心臟前后負荷,改變了心室復極,并增加了左心室心內膜鈣離子通道表達,導致細胞凋亡在內的一系列細胞損傷[14]。同時,低氧狀態還可刺激機體產生過多的氧自由基,使內皮生長因子增加,并能誘導炎性反應,如炎性細胞浸潤和細胞因子釋放等,導致血管內皮功能障礙和心肌缺血,也可進一步發展為心肌梗死[15]。
2.5 應激反應 COVID-19患者均存在一定程度的焦慮,尤其是重癥患者,焦慮、恐懼情緒及應激反應較明顯。應激途徑是由焦慮和睡眠剝奪/分裂所致,在應激狀態下,下丘腦-垂體-腎上腺皮質軸(HPA)及交感神經系統的神經元激活,進而刺激機體產生并釋放大量的兒茶酚胺[16],通過直接心臟毒性和間接微循環障礙而損傷心肌,而這些精神情緒的應激反應又會進一步損傷人體免疫功能,加重心肺損傷。
2.6 藥物心臟毒性
2.6.1 氯喹和羥氯喹 氯喹和羥氯喹被廣泛用于COVID-19患者的抗病毒治療。最新發表于《柳葉刀》的一項9 600多例COVID-19住院患者治療結果的研究發現,氯喹和羥氯喹治療COVID-19患者無效,反而會增加患者室性心律失常和院內死亡風險[17],分析原因為:氯喹和羥氯喹可積聚在溶酶體中,直接抑制磷脂酶活性,誘導胞質包涵體的形成,增加溶酶體pH值,并導致蛋白質失活。氯喹和羥氯喹主要心臟毒副作用是引起心肌傳導障礙,還可抑制竇房結功能,降低心率,導致心動過緩,嚴重時可引發阿-斯綜合征甚至死亡;其他非特異性心臟事件包括心肌肥厚、心力衰竭、瓣膜功能障礙等。但值得注意的是,停藥后部分患者心臟功能能夠恢復正常[18]。
2.6.2 阿奇霉素 阿奇霉素被認為可與氯喹、羥氯喹聯合治療COVID-19[19]。阿奇霉素是一種半合成的大環內酯類抗生素,也是美國最常見的處方抗生素,其治療革蘭陽性菌、革蘭陰性菌及非典型病原菌感染有效。既往研究表明,阿奇霉素無心臟毒性作用,但可能導致QT間期延長、室性心動過速及增加心房顫動和心臟驟停風險[20]。
3 COVID-19患者心臟損傷表現
3.1 心律失常 心動過速是COVID-19患者最常見的心律失常類型,因低血流灌注、發熱、缺氧、焦慮等多種原因導致,但通常具有自限性[21]。另外,COVID-19可引發低氧血癥,進而誘發心房顫動,可持續到肺部病灶改善前。此外,全身炎性反應會使心房顫動的抗凝治療變復雜[22]。
3.2 急性心肌炎 與其他冠狀病毒一樣,SARS-CoV-2可誘導機體釋放多種細胞因子和趨化因子,不僅可導致血管炎癥和斑塊不穩定,還會導致心肌炎[23]。在CVD患者中,COVID-19相關心肌損傷可能以急性心肌炎的形式表現出來[24]。心肌炎會導致局灶性或整體性心肌炎癥、壞死,最終導致心室功能障礙[25]。
首次對1例COVID-19死亡患者的尸檢樣本進行病理學檢查顯示,患者心肌間質中有單核細胞炎性浸潤,但并未對心臟組織造成實質性損傷[26],表明COVID-19可能引起心肌炎。一項分析危重癥COVID-19患者心肌損傷臨床特點的研究發現,患者心肌肌鈣蛋白I(cTnI)、肌酸激酶(CK)、α羥丁酸脫氫酶(α-HBDB)和乳酸脫氫酶(LDH)均有不同程度升高[27]。兒童COVID-19也存在心肌損傷[28]。《兒童新型冠狀病毒感染診斷、治療和預防專家共識(第二版)》[29]指出,心肌酶、LDH水平進行性升高提示COVID-19患兒病情加重或惡化,部分患兒可見肌鈣蛋白水平升高。INCIARDI等[30]報道了1例53歲的意大利女性COVID-19患者發生急性心肌炎,但患者無呼吸道體征及感染癥狀,實驗室檢查指標及心臟磁共振成像檢查均提示嚴重左心室功能障礙和急性心肌炎。可見COVID-19無癥狀患者也可能發生心臟損傷。
3.3 心肌梗死 心臟血管壁中的周細胞在SARS-CoV-2感染期間發生局部微血管炎癥[7],引起嚴重微血管功能障礙,導致非梗阻性冠狀動脈心肌梗死,這就解釋了近期關于COVID-19患者發生心肌梗死的臨床報道[31]。此外,細胞因子風暴可促進內皮功能障礙[32]。研究表明,SARS-CoV-2可能通過全身炎性反應、細胞因子風暴及免疫細胞極化向更不穩定表型發生特定變化,從而導致心肌損傷、內皮功能障礙、微血管功能障礙、斑塊不穩定和心肌梗死[5]。首次COVID-19相關的心肌受累的報告是武漢對41例COVID-19確診患者的研究,其中5例(12%)高敏肌鈣蛋白I>28 ng/L,且7%~17%的輕癥COVID-19患者和22%~31%的重癥COVID-19患者可能會出現肌鈣蛋白水平升高[11]。意大利一項針對28例因急性ST段抬高型心肌梗死(STEMI)行急診冠狀動脈造影術的COVID-19患者研究表明,STEMI可能是COVID-19的首發癥狀,同時也指出1型心肌梗死可通過冠狀動脈造影術識別罪犯血管,而約40%的合并STEMI的COVID-19患者考慮為2型心肌梗死或心肌炎所致,這種情況下不應完全采用溶栓治療,因為此類患者尚無需再灌注治療[33]。
3.4 心力衰竭 呼吸困難、乏力是心力衰竭尤其是重癥COVID-19患者的常見癥狀[11]。研究表明,23%的COVID-19患者在首次發病時出現急性心力衰竭[34],而并發心力衰竭可能會增加患者死亡風險[35]。在心力衰竭患者中,約50%無已知的高血壓病史或CVD病史,因此目前尚不清楚心力衰竭是由新發的心肌病所致,還是由于未診斷出的心力衰竭進一步惡化所致[36]。值得注意的是,在合并急性呼吸窘迫綜合征(ARDS)和急性肺損傷的COVID-19患者中,右心衰竭也可能發生[37]。通過分析檢索的COVID-19心臟并發癥的 13 篇[3,11,21,27,34-35,38-44]文獻結果表明,合并 CVD 的COVID-19患者心臟受累發生率更高,院內病死率也較高,詳見表1。
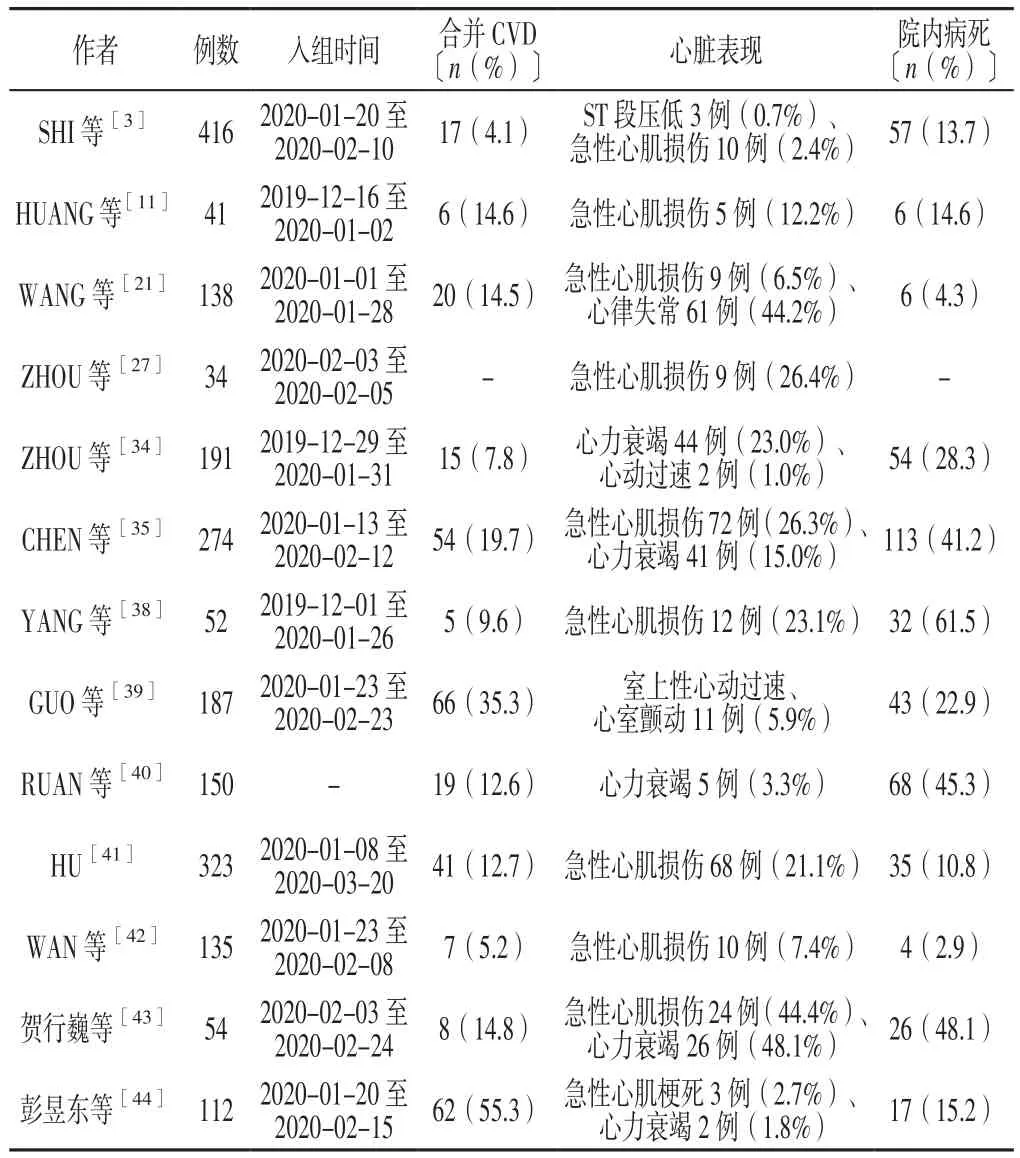
表1 COVID-19對心臟影響的不同研究對比Table 1 Comparison of different studies of impact on the heart in COVID-19
4 小結與展望
COVID-19患者心臟損傷的主要癥狀包括胸痛、心悸、氣促和乏力,與單純COVID-19呼吸道表現相似。已有研究表明,SARS-CoV-2可引起心臟免疫激活和心功能障礙,導致靶組織纖維化和微血管病變,從而對心血管系統造成慢性損傷[45]。因此,建議最初有心臟損傷的COVID-19患者每1~3個月隨訪1次,并詳細記錄患者病史及體格檢查結果,通過12導聯心電圖和多普勒超聲心動圖評估心臟情況。期待今后更多的研究從機制、治療等各方面進行更深入的探索,為COVID-19患者治療提供參考。
作者貢獻:賈碩進行資料/文獻的收集整理,撰寫論文;程功進行審校,并對文章整體負責、監督管理。
本文無利益沖突。
文獻檢索策略:
計算機檢索 PubMed、The Cochrane Library及中國期刊全文數據庫、萬方數據知識服務平臺有關新型冠狀病毒肺炎(COVID-19)患者心臟損傷機制及其表現的相關文獻,檢索時間均為建庫起至2020年5月。中文數據庫以“新型冠狀病毒”“新冠肺炎”“心血管”“心肌”等為主題詞,英文數據 庫以“coronavirus”“SARS-CoV-2”“COVID-19”“cardiovascular”“cardiac”為主題詞,主題詞和自由詞相結合的方式進行檢索。

