放射性藥品質量標準淺析
劉勝蘭,鄧啟民
(成都云克藥業有限責任公司,成都 610041)
對藥品進行質量檢驗是保證臨床用藥安全性和有效性的關鍵環節,放射性藥品因含有放射性核素,其質量檢驗除需按照普通藥品的要求進行常規的化學檢定和生物學檢定之外,還需要根據放射性藥品的特點進行核素鑒別、放射性核純度、放化純度和放射性活度等放射性檢定[1]。為保證放射性藥品的質量,各個國家都制定了相關的質量標準和技術規定,而各國藥典收載的放射性藥品檢定方法以及藥品質量標準中檢定項目的限度要求也不盡相同。隨著我國藥品國際貿易的增加和知識產權保護制度的完善,借鑒國外藥典中的藥品質量標準和質量控制方法已成為必需,具有代表性的發達國家和地區的藥典尤其值得了解和學習。本文對《中國藥典》(ChP2015)、《美國藥典》(USP42-NF37)和《歐洲藥典》(EP9.0)中有關放射性藥品質量控制的相關內容進行了對比分析[2-4],總結了各國藥典中放射性藥品檢定項目、分析方法,以及質量標準的差異,并針對ChP2015中存在的問題提出了相應的修訂意見。
1 放射性藥品質量控制指導原則
藥品研究的指導原則是對藥品研究過程的技術指導和規定,關于放射性藥品的質量控制,表1總結了ChP2015、USP42-NF37和EP9.0中收載的有關放射性藥品的指導原則及其適用的藥品類型。從收載的情況看,ChP2015、USP42-NF37和EP9.0中均對正電子類放射性藥品或锝[99mTc]放射性藥品這類即時制備放射性藥物(EPRs)的質量控制進行了規范,由于99mTc和正電子發射斷層顯像(positron emission tomography, PET)藥物核素的半衰期很短,該類藥品需在制備后數十分鐘至數小時內使用,且藥品批量很小,在臨床使用前無法對每一批藥品進行全項檢驗。另一方面,這類制劑多由醫療機構于臨床使用前制備,相對于生產企業來說,醫療機構沒有完善的藥品生產和質量控制體系,因此這類指導原則對于保證即時標記類藥物的臨床使用安全起到重要作用。
EP9.0還收載了一般放射性藥物制劑及其化學前體的質量控制指導原則,所涵蓋的放射性藥物的種類更豐富,我國藥典沒有引入化學前體的概念,將放射性藥品的原料藥作為化學類藥品進行質量控制。從圖1可以看出,除锝[99mTc]標記藥品和PET藥物之外,各國藥典中收載的其他放射性藥品的質量標準也占有一定的比例。另外,治療用放射性藥物日益受到重視,近年來國外陸續有131I、90Y和177Lu等核素標記的藥物獲批上市,國內關于放射性治療藥物的研究也越來越多,所以針對一般放射性藥品制定相應的質量控制指導原則也非常必要。
從指導原則內容看,由于我國正電子類藥品為商品化,采取了注冊制,而美國對于正電子類放射性藥品采用了臨床科研與試驗和商品化同等對待,因此兩部藥典中的質控內容存在較大差異。EP9.0中要求說明放射性藥品的生產途徑,并規定了生產制備過程中的質量控制措施、制劑成品的質量檢驗項目以及包裝、儲存條件等,而放射性藥品生產工藝的確證對于藥品質量控制十分重要,所以EP9.0中關于各類放射性藥物質量控制內容的規定更加明確、具體,值得我們學習和借鑒。
2 放射性藥品檢定方法
關于放射性藥品的檢定,表2對比了ChP2015、USP42-NF37和EP9.0收載的放射性檢定方法。

表1 ChP2015、USP42-NF37和EP9.0中收載的放射性藥品質量控制指導原則Table 1 Guidelines for quality control of radiopharmaceutical preparations contained in ChP2015, USP42-NF37 and EP9.0
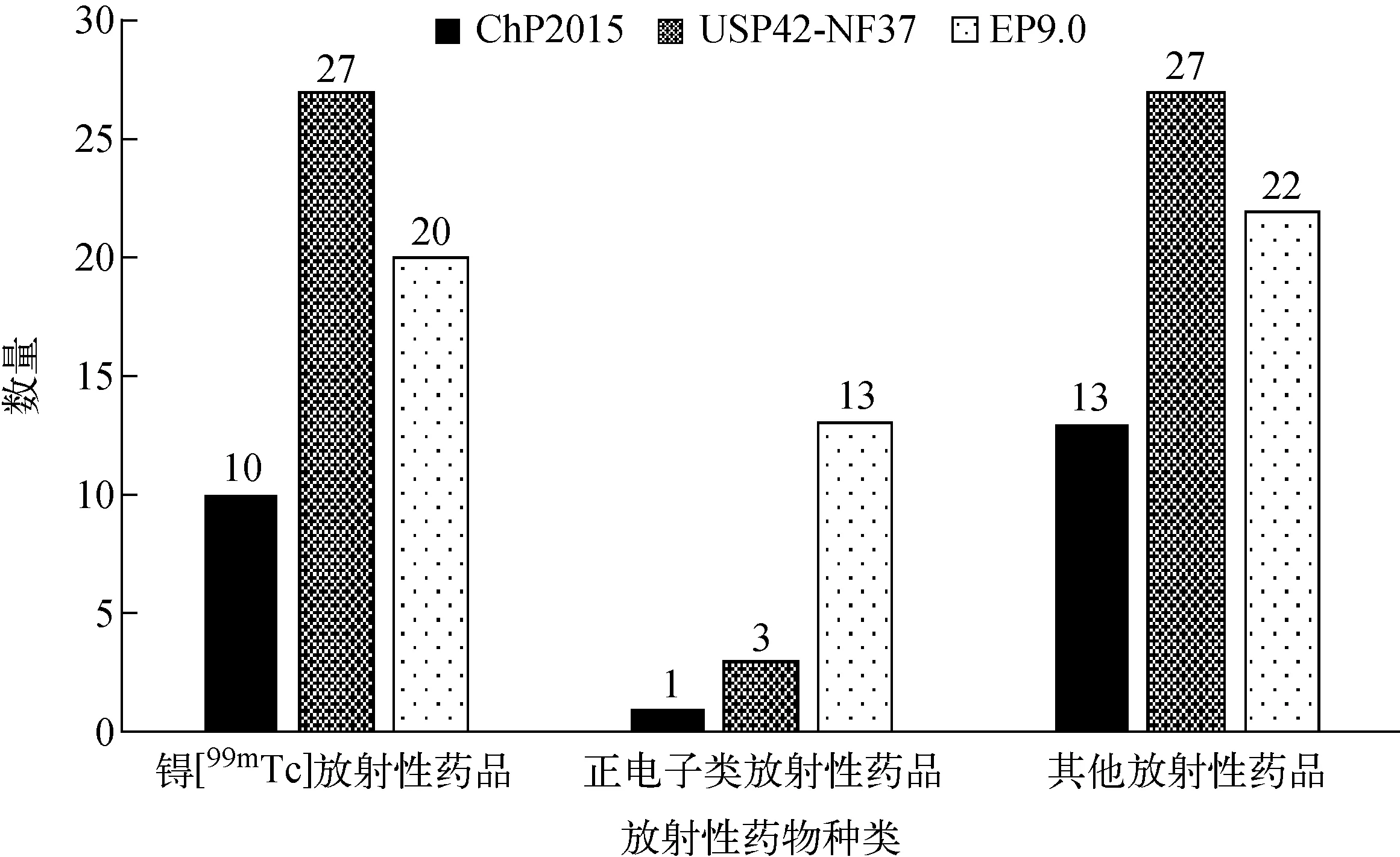
圖1 ChP2015、USP42-NF37和EP9.0中收載的放射性藥品質量標準分布Fig.1 Distribution of quality standards of radiopharmaceuticals contained in ChP2015, USP42-NF37 and EP9.0
對于放射性核素鑒別,ChP2015、USP42-NF37和EP9.0中均推薦使用γ譜儀法和半衰期測定法來鑒別γ放射性核素及其他短半衰期放射性核素。對于具有較長半衰期的純β放射性核素的鑒別,ChP2015建議采用質量吸收系數法,通過實驗計算質量吸收系數與純的同種核素在相同條件下測得的質量吸收系數相比較來進行鑒別,而USP42-NF37和EP9.0中均推薦使用更加簡便、準確的β能譜法,根據放射性核素發射的β粒子的最大能量進行鑒別。

表2 ChP2015、USP42-NF37和EP9.0相關通則中的放射性檢定方法比較Table 2 Comparison of radioassay methods in the general monograph of ChP2015, USP42-NF37 and EP9.0
對于放射性核純度測定,ChP2015中采用鍺半導體多道γ譜儀進行測定,利用核素的特征γ射線譜來測定放射性核純度。由于PET藥物核素均會發射能量為511 keV的γ射線,例如13N藥物中存在雜質核素18F,僅采用γ譜儀則無法區分PET藥物核素發射的γ射線。而USP42-NF37和EP9.0中除γ譜儀法外,還建議使用半衰期測定法來測定PET藥物核素及其他半衰期較短的核素的放射性核純度。
放化純度的測定分為兩個階段,首先通過分離技術將不同的化學物質分離,再使用合適的放射性測量儀器測量每種化學物質的放射性活度。ChP2015采用的分離技術有紙色譜法、薄層色譜法和電泳法;而USP42-NF37和EP9.0中除這些傳統方法之外,還推薦使用與分析儀器(如液相色譜儀)中的其他檢測器串聯安裝的探測器進行在線測量,這種方法分離效能高,分析速度快,用于測量半衰期極短的核素的放化純度時較其他方法有明顯的優勢。
關于放射性活度(濃度)測量,三部藥典均介紹了以電離室為探測器的活度計測量放射性活度,電離室是測量由入射粒子在腔室內產生的總電離電流,因此它無法區分不同放射性核素發射的射線,可測量的活度水平也受放大器范圍和腔室設計的限制。USP42-NF37和EP9.0中采用的活度測量方法更加多樣,還介紹了基于半導體探測器和閃爍體探測器的活度計,當藥品中存在某種放射性核素雜質與指定核素發射的射線能量相近時,可采用能量分辨率較高的半導體探測器,對于低能射線或弱放射性樣品可以使用靈敏度較高的閃爍體計數器進行測量。
通過以上對比分析發現,ChP2015收載的《放射性藥品檢定法》存在一些不足。對于放射性活度(濃度)測量,采用以電離室為探測器的活度計無法排除放射性核素雜質的干擾,使藥品的放射性活度測量值比實際高,造成各器官和組織的輻射吸收劑量達不到預期,影響治療效果。USP42-NF37和EP9.0中使用的高能量分辨率的半導體探測器和高靈敏度的閃爍計數器則可以彌補這些不足,使藥品的放射性活度測量值更加準確。對于放化純度測定,采用傳統的分離技術可能無法將潛在的放化雜質與藥品主成分完全分離,導致放化純度的測定結果不準確,放化雜質無法有效檢出。放化雜質的存在可能會影響核素的生物分布,對于診斷用放射性藥物,會干擾影像判讀;對于治療用放射性藥物,核素的生物分布改變會導致靶組織輻照不足或其他組織過度輻照,造成治療效果不佳和不必要的輻射損傷。USP42-NF37和EP9.0中采用的高效液相色譜法(HPLC)分離效能很高,可以更好地將放化雜質與有效成分分離,準確測定藥品的放化純度,從而保證臨床用藥安全、有效。
3 放射性藥品質量標準
3.1 質量標準收載情況
ChP2015、USP42-NF37和EP9.0及其增補本中放射性藥品質量標準的收載情況總結于表3中。USP-NF每年修訂一版;EP每三年修訂一版,并每年出版3期增補本,其中增補本EP9.2與EP9.7分別新增了放射性核素前體Lutetium(177Lu) Solution for Radiolabelling和Yttrium(90Y) Chloride Solution for Radiolabelling的質量標準;而ChP每五年修訂一次,其增補本沒有固定的出版周期,自ChP2015頒布后的四年間,僅在2018年出版發行了一次增補本,該增補本中僅對兩種放射性藥品的質量標準進行了修訂,一是增訂了鄰碘[131I]馬尿酸鈉注射液的放射性核純度測定項,二是修訂了锝[99mTc]噴替酸鹽注射液質量標準中細菌內毒素檢查項的限度要求,并未新增放射性藥品品種。與USP42-NF37和EP9.0比較,ChP2015收載的放射性藥物品種較少,涉及的放射性核素種類也很少。

表3 ChP2015、USP42-NF37和EP9.0中放射性藥品的質量標準收載情況Table 3 Quality standard collection of radiopharmaceutical preparations in ChP2015, USP42-NF37 and EP9.0
ChP2015收載的放射性藥品種類較少,一方面是因為ChP的修訂周期過長,一些近幾年發展成熟的品種未能及時收錄,比如用于診斷幽門螺旋桿菌感染的尿素[14C]呼氣試驗藥盒,其在臨床上使用廣泛但缺乏統一的國家標準;另一方面由于我國放射性藥物的研究進展緩慢,國外藥典中收錄的一些品種還未在國內上市,比如Fluorodopa18F(18F-FDOPA)和111In Pentetate (111In-DTPA)等。除此之外,許多近幾年在國外獲批上市的新品種還未在國內出現或仍處于研究階段,比如用于阿爾茨海默病診斷的Vizamyl(18F-Flutemetamol)和Neuraceq (18F-Florbetaben)、靶向前列腺癌的Axumin(18F- Fluciclovine)、用于去勢性前列腺癌治療的Xofigo(223RaCl2注射液)以及用于神經內分泌瘤診斷和治療的Netspot(68Ga-DOTATATE)和Lutathera(177Lu-DOTATATE)等。
3.2 質量標準中的放射性檢定項目
ChP2015、USP42-NF37和EP9.0共同收載的放射性藥品的質量標準有17個,其放射性檢定項目的限度要求總結如表4。其中關于氟[18F]脫氧葡糖注射液的放化純度,EP9.0要求氟[18F]脫氧葡糖(18F-FDG)和氟[18F]脫氧甘露糖(18F-FDM)的放化純度之和不低于95%,并且18F-FDM的放射性活度在18F-FDG和18F-FDM的總放射性活度中占的比例應不超過10%,氟[18F]化物、18F-FDG和18F-FDM的衍生物的總放射性活度應不超過18F總放射性活度的5%;而ChP2015和USP42-NF37中僅要求控制18F-FDG的放化純度不低于90%,對18F-FDM及其他放射性雜質的含量未作規定。
由堆照锝[99mTc]發生器和裂變锝[99mTc]發生器兩種不同生產方式獲得的高锝[99mTc]酸鈉注射液,三部藥典對其中放射性核素雜質含量的限度要求也不同,具體要求如表5和表6所示。由于在高锝[99mTc]酸鈉注射液中已控制放射性核素雜質的含量在限度要求內,對于由高锝[99mTc]酸鈉注射液和注射用配套藥盒制備得到的放射性藥品,則無需再進行放射性核純度檢查。EP9.0中對锝[99mTc]標記放射性藥品的放化純度的限度要求均高于ChP2015和USP42-NF37,其收載的質量標準中對膠體形式的99mTc和高锝[99mTc]酸根離子等放射性雜質的含量有明確的限度要求,而ChP2015和USP42-NF37中并未作相關規定。
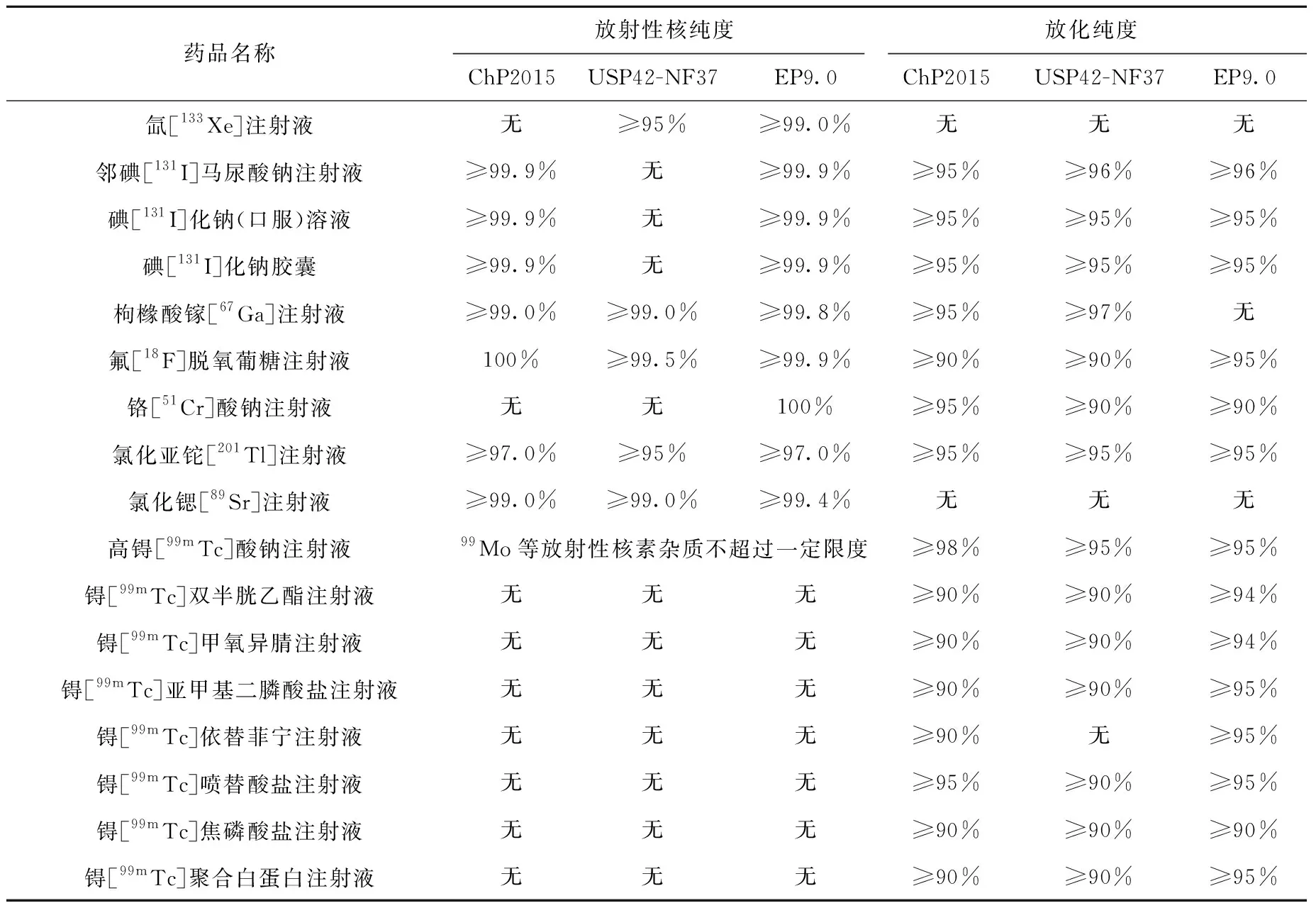
表4 部分放射性藥品的放射性核純度及放化純度限度要求Table 4 Radionuclide purity and radiochemical purity limits for some radiopharmaceutical preparations

表5 堆照锝[99mTc]發生器制得的高锝[99mTc]酸鈉注射液中放射性核素雜質的限度要求Table 5 Limit of radionuclide impurities in sodium pertechnetate [99mTc] injection obtained from 99Mo produced by neutron irradiation of molybdenum
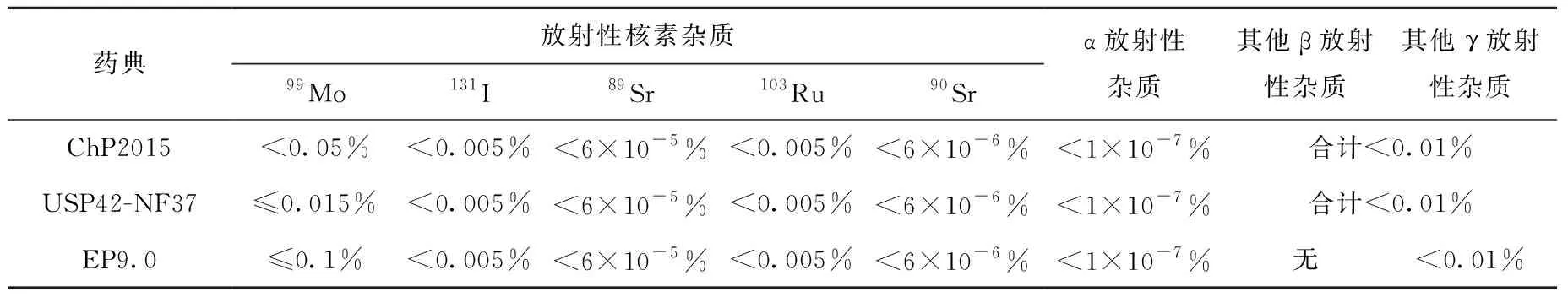
表6 裂變锝[99mTc]發生器制得的高锝[99mTc]酸鈉注射液中放射性核素雜質的限度要求Table 6 Limit of radionuclide impurities in sodium pertechnetate [99mTc] injection obtained from 99Mo fission
對于同種放射性藥品,三部藥典質量標準采用的檢定方法不同,對各放射性項目的限度要求也存在差異,質量標準一定程度上會受到方法局限性的影響,總體趨勢是EP9.0的質量標準較嚴格,不僅放射性核純度和放化純度的限度要求高,對放射性雜質的控制也更加全面。對比質量標準中放射性核純度和放化純度檢定項的具體內容發現,ChP2015收錄的質量標準中僅建議照通則1401《放射性藥品檢定法》進行測定,方法沒有針對性,而且該通則收載的放射性檢定方法不夠完善,可能會導致潛在放射性雜質無法檢出。USP42-NF37和EP9.0均針對每種藥品詳細敘述了檢定方法和參考實驗條件,比如對于放射性核純度的測定,介紹了藥品指定核素和雜質核素的特征射線能量以及可采用的檢測方法;對于放化純度的測定,描述了參考色譜條件和具體的分析過程,EP9.0中還對每種放化雜質的結構和分析方法進行描述。所以,EP9.0的質量標準不僅對放射性檢定項目的要求更加嚴格,檢定方法的針對性也更強,能夠全面控制放射性雜質,確保藥品的安全性和有效性。
放射性活度(濃度)是對于所有放射性藥物制劑及放射性核素前體都必須進行的檢測項目,三部藥典所收載的質量標準均要求按其標簽上記載的時間,含指定核素的放射性活度(濃度)應為標示量的90.0%~110.0%。放射性藥物制劑的規格不具有實際意義,需根據臨床實際需求來計算所需的生產規格,ChP2015收載的部分品種的質量標準中列出了規格項,并且規定了最低放射性濃度[5],而USP42-NF37和EP9.0中未列規格項。
4 小結
國內放射性藥品質量研究的參考依據主要來自ChP,本文對ChP2015與國外藥典中的放射性藥品質量控制相關內容進行對比發現,EP9.0與USP42-NF37中收載的指導原則涵蓋的放射性藥品種類全面,而且內容明確具體;放射性檢定方法多樣,靈敏度和準確度高;收載的放射性藥品種類多,質量標準的限度要求嚴格,檢定方法針對性強。ChP2015收載的相關指導原則和質量標準與國外藥典相比還有一定的差距,指導原則和檢定方法的局限性太大,無法適應當前放射性藥品質量研究的需要。隨著科學技術的發展,放射性藥物檢驗技術越來越現代化,HPLC與放射性測量的聯用技術不斷涌現[6-7],同時,監管部門對藥品質量的要求也更加嚴格,ChP2015收載的一些質量標準及分析方法的科學性和合理性或許已不能滿足現行藥品質量控制要求。因此,ChP應與時俱進,通過縮短修訂周期或增加每個修訂周期之間出版增補本的次數,及時收載一些新上市的療效確切、應用廣泛且質量標準成熟的放射性藥品;在保證規范性的前提下采用較先進的檢驗技術,完善放射性藥品檢定方法;并嚴格控制各檢定項目和放射性雜質的限度要求,從而提高放射性藥品質量標準的技術水平,使質量標準起到保證藥品安全性和有效性的作用。
5 展望
近年來生物醫藥發展迅速,放射性核素標記的多肽和單克隆抗體等藥物在醫學診斷和治療中的應用也越來越多[8]。放射性藥物的研究朝著診療一體化的方向發展,采用診斷用放射性核素標記對疾病的靶點具有高特異性和靶向性的分子對疾病進行篩查診斷,再使用治療用放射性核素標記的靶向藥物進行精準治療,可使疾病的診治更有針對性和準確性[9],例如靶向神經內分泌瘤的診療一體化藥物68Ga-DOTATATE和177Lu-DOTATATE。國內對于該類藥物的研究相對滯緩,目前還沒有相關的品種獲批。ChP可借鑒國外的研究經驗,針對放射性核素標記的生化藥品和生物制品制定質量研究指導原則,或制定相關的技術指導文件,以期為此類新藥的開發和質量研究提供支持,從而促進國內診療一體化新藥的研究進展。
另外,我國放射性藥品相關的政策法規比較滯后,目前缺乏科學、系統的放射性藥品管理法規體系和研究指南,對行業的發展有一定的影響。美國建立了關于放射性藥品研究的技術指導原則,歐盟也出臺了《放射性藥物研究指南》和《放射性藥物非臨床評價指導原則概念文件》等相關指南,國際上完善的放射性藥品法規管理體系和修訂機制值得我國學習[10]。研究指南和政策法規的缺乏一定程度上會阻礙放射性藥品的發展,我國亟需制定放射性藥物研究的指導文件,完善相關法規體系,為放射性藥物的研究、注冊和生產等提供導向,助推我國放射性藥物的發展。

