柳杉優良無性系組培快繁體系研究
王 晨,張俊紅,張 苗,許雯婷,樓雄珍,童再康
(浙江農林大學 省部共建亞熱帶森林培育國家重點實驗室,浙江 杭州 311300)
柳杉Cryptomeria fortunei為杉科Taxodiaceae柳杉屬Cryptomeria常綠高大喬木,是中國特有的用材與綠化樹種。天然種群集中分布于東南部的武夷山和天目山山脈,長江以南省區多有栽培[1]。柳杉生長快,生長期持久,樹干通直,材質優良,可廣泛應用于建筑、橋梁、家具等,且樹姿雄偉,樹形優美,是優良的園林綠化樹種。同時,柳杉葉片對空氣顆粒物有著較強吸附能力,是重要環保樹種[2]。目前柳杉研究主要集中在育苗[3?6]、良種選育[7]、病蟲害[8?9]與生理生態[10?11]等方面。此外,學者進行了簡單重復序列(simple sequence repeat,SSR)分子標記引物篩選[12]與材性相關基因的篩選[13]等分子生物學方面的初步探索。此前柳杉種苗繁育仍采用播種[3?4]、扦插[5]與嫁接[6]等常規擴繁方法,但即便是良種選育,也存在優良材料繁殖系數低、繁育周期長等問題,有性繁育子代分離難以保持優良性狀。植物組織培養是目前植物快速繁殖的重要手段,具有繁殖系數高、生產速度快、受外界環境影響小、可實現工廠化育苗、全年生產等優點,在良種繁育上已具有諸多成功案例[14]。如張翠萍等[15]以柳杉種胚為實驗材料,通過柳杉試管苗繁殖技術研究,建立了種子試管苗組培快繁體系;但該體系僅能應用于分離世代的種子材料,受種胚采集時間和環境限制,繁殖效率偏低。祝晨辰等[16]以柳杉優良無性系的莖段為外植體,建立了柳杉優良無性系繁育技術體系,但不定芽增殖效率較低(1.23~5.00)。為提高柳杉的不定芽增殖效率,本研究以柳杉優良無性系的莖段為外植體,以高效分段培養的方式進行組織快繁,以期建立高效無性繁殖技術體系,為柳杉良種生產性規模化快繁提供參考。
1 材料與方法
1.1 材料
以浙江省文成縣石垟林場20年生柳杉無性系測定林中3個植株健壯、性狀優良的無性系作為外植體,取當年生幼嫩枝條,用洗滌劑浸泡30 min后輕刷枝條表面,并將其剪成獨立的帶頂芽莖段,流水沖洗2 h。無菌條件下用質量濃度75.0%的乙醇浸泡20 s,再用質量濃度0.1%的升汞消毒8 min,無菌蒸餾水沖洗4~5次,每次1~2 min。
1.2 培養基及培養條件
1.2.1 不定芽的誘導與增殖 為探索基本培養基、水解酪蛋白(CH)對不定芽誘導與增殖的影響,采用MS、DCR和WPM等3個基本培養基 , 分別 添加 蔗 糖 30 g·L?1, 瓊 脂粉 7 g·L?1,pH值調至 5.8;設置 6-芐氨基腺嘌呤 (6-BA,0.10、0.50 和 1.00 mg·L?1)、吲哚丁酸 (IBA,0、0.10 和 0.30 mg·L?1)、水解酪蛋白 (CH,0、0.50和1.00 g·L?1)各3個水平,使用L9(34)正交實驗(表1)。每瓶接種2~3個莖段,每個處理10瓶,重復3次,40 d后統計數據,計算不定芽誘導率與增殖系數。
1.2.2 不定芽的伸長 前期實驗發現,組織培養過程中<1 cm的不定芽操作效率偏低,微扦插生根效果不佳。本實驗將芽長≥1 cm的不定芽定義為有效芽。為解決上一步實驗中不定芽萌發多但有效芽少的問題,調整培養基植物生長調節劑質量濃度,設計 B1(WPM+1.00 mg·L?16-BA+0.10 mg·L?1IBA)、B2(WPM+0.20 mg·L?16-BA+0.02 mg·L?1IBA)和 B3(不添加植物生長調節劑的WPM培養基)等3個培養基組合,每瓶接種3~5個莖段,每個處理10瓶,重復3次。40 d后觀察芽伸長情況,統計數據。
1.2.3 生根培養 剪取不定芽長≥1 cm的有效芽進行生根培養。在DCR和WPM培養基中添加0.10 mg·L?1IBA和不同質量濃度(0、0.01、0.10 mg·L?1)萘乙酸(NAA),每瓶接種3個有效芽,每個處理10瓶,重復3次。30 d后觀察并統計數據。
1.2.4 煉苗移栽 生根培養約40 d后,將株高≥5 cm且根系發達的柳杉無菌苗移至V(泥炭)∶V(蛭石)=1∶1的混合基質常規管理。30 d后調查移栽存活率。
1.3 培養條件
以上培養條件均為光照時間16 h·d?1,光強2 000 lx,培養溫度(23±2) ℃。
1.4 數據處理與統計分析
根據實驗獲得數據,分別計算以下指標。
芽誘導率=出芽外植體數/總接外植體數×100%。芽增殖系數=誘導出的不定芽總數/外植體總數。有效枝條增長率=誘導出的有效枝條總數/原有效枝條總數×100%。不定根的誘導率=生根的枝條數/接種枝條總數×100%。平均不定根數=生根的總數/誘導出不定根的枝條數。平均根長=不定根的總長度/誘導出不定根的枝條數。移栽存活率=移栽存活的苗數/移栽的總苗數×100%。繁殖潛能(株·株?1·a?1)=繁殖系數3.75×生根率×移栽存活率。
采用SPSS 17.0和Excel先對百分率數據進行反正弦轉換,再進行方差分析和LSD多重比較。
2 結果與分析
2.1 不同培養基對柳杉芽誘導與增殖的影響
由表1知:各無性系在所有培養基中均能形成不定芽,但不同處理間芽的誘導率與增殖系數存在差異。綜合來看,A8處理優于其他組合,不定芽誘導率和增殖系數達到最高,分別為100%和9.13。外植體在培養基中7 d左右開始萌動,針葉基部的芽點膨大,隨后逐漸伸長,萌發出芽(圖1A)。從芽的生長狀況來看,A8芽萌發較多,葉色翠綠,生長健壯(圖1B);A1芽萌發少,葉色較黃,芽苗瘦弱,生長狀況較差(圖1C)。
根據正交實驗結果進行極差分析,結果見表2。從誘導率來看,6-BA對柳杉莖段不定芽誘導率的影響占主導地位,極差(R)達40.63,其次是IBA(15.07)和基本培養基(12.82),最后是CH(5.91)。其中最佳水平6-BA為1.00 mg·L?1,IBA 為 0.10 mg·L?1,CH 為 0.50 g·L?1,最佳基本培養基為DCR。因此,柳杉芽誘導與增殖的最佳基本培養方案為WPM+1.00 mg·L?16-BA+0.10 mg·L?1IBA。

表2 不定芽誘導與增殖實驗結果極差分析Table 2 Range analysis on the induction and proliferation of adventitious buds
方差分析發現(表3):6-BA對柳杉莖段不定芽的誘導率及增殖系數均有極顯著影響(P<0.01),基本培養基與IBA質量濃度對柳杉莖段不定芽的增殖系數有顯著影響(P<0.05)。
2.2 不同質量濃度植物生長調節劑對柳杉不定芽伸長的影響
在繼代培養過程中,將幼芽接入最佳誘導增殖培養基后,各無性系不定芽增殖系數顯著提升。培養40 d后,接入不定芽伸長培養基。結果表明(表4):相較于添加高質量濃度植物生長調節劑的培養基,低質量濃度或不添加植物生長調節劑的培養基對柳杉不定芽的伸長有顯著促進作用。其中B3處理下柳杉芽伸長效果最好,有效枝條多,長勢良好,有效枝條增長率達到456.87%;B1處理下柳杉芽基本沒有伸長,短芽多,植株發黃,甚至死亡。由圖1D(培養1 d)、圖1E(培養7 d)、圖1F(培養40 d)可知:B3處理下柳杉芽伸長良好。
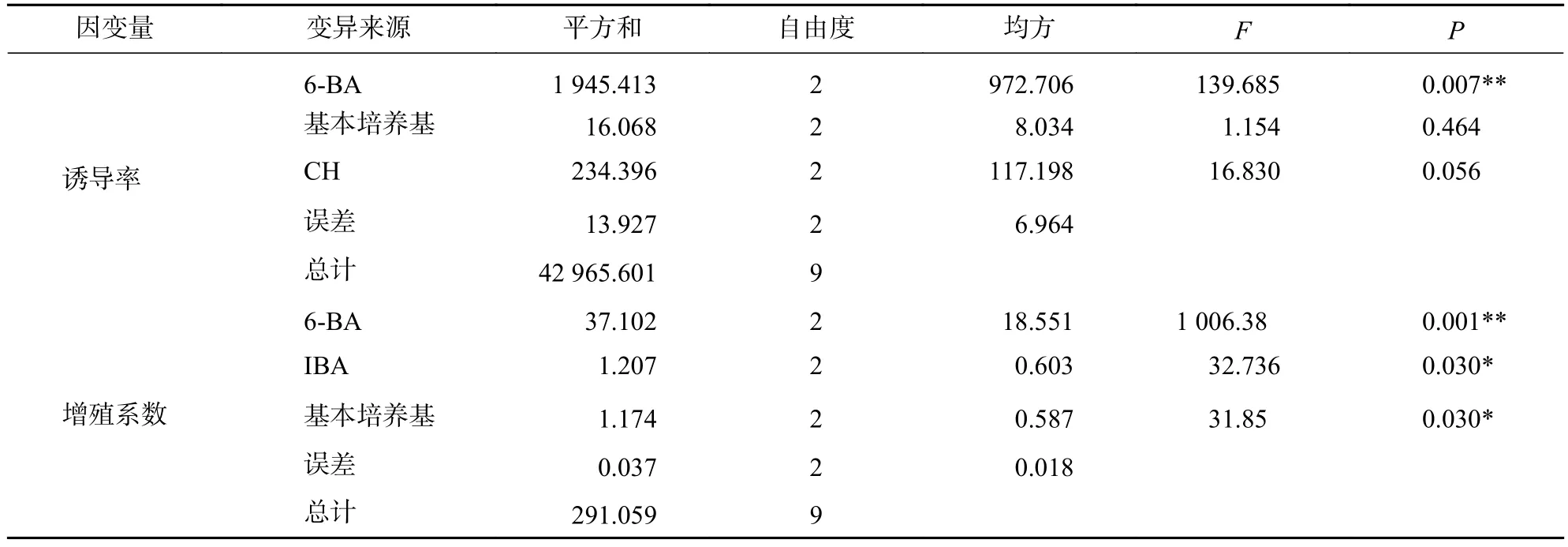
表3 不同因素對莖段不定芽誘導與增殖影響的方差分析Table 3 Variance analysis on the induction and proliferation of adventitious buds
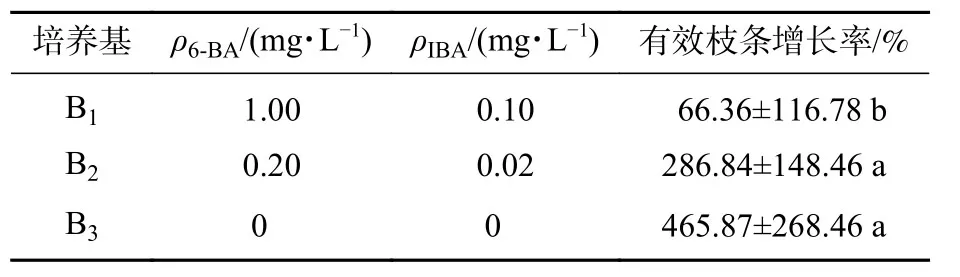
表4 不同質量濃度植物生長調節劑對不定芽伸長的影響Table 4 Effects of different concentrations of plant growth regulators on elongation of adventitious buds
2.3 不同培養基對柳杉不定根發生的影響
待枝條生長到2~3 cm時剪下,插入生根培養基進行生根培養。結果表明(表5):幼苗在2種基本培養基中生根情況無顯著差異。當培養基中添加0.10 mg·L?1IBA時,枝條的生根率達到100%,生根速度較快,根多且健壯。平均生根數隨著NAA質量濃度的升高而增加,但平均根長減小(圖1G )。當培養基中添加少量NAA時,幼苗基部先分化出少量愈傷組織,隨后從愈傷組織中分化出根,根條細弱,根數較多,根長度較短。隨著NAA質量濃度升高,生根率逐漸降低,愈傷組織增多;至0.10 mg·L?1時,幼苗基部分化出大量愈傷組織,生根受到抑制,莖段發黃,最終整株死亡。C1處理下柳杉幼苗生根率較高,根長度大,與其他處理差異顯著。因此,DCR+0.10 mg·L?1IBA為生根的最適培養基。幼苗在最佳不定根誘導培養基中生長,7 d左右長出白色的根尖,之后根迅速伸長,30 d后形成良好根系。由圖1G可知:無性系在C1培養基中生根情況最好。

圖1 柳杉莖段的不定芽誘導和植株再生Figure 1 Adventitious buds induction and plant regeneration of C. fortunei sterile seedlings
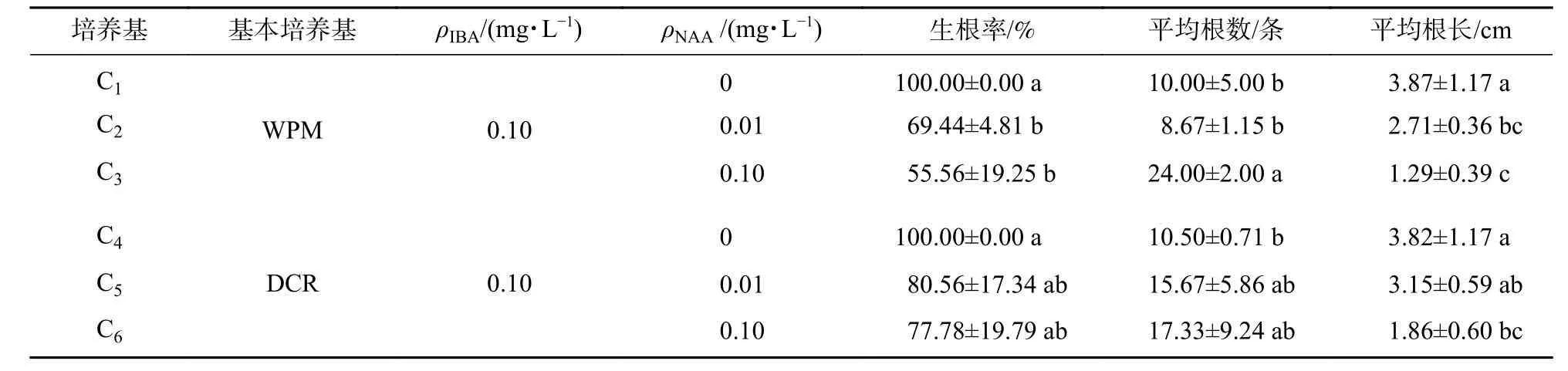
表5 不同培養基對生根的影響Table 5 Effects of different mediums on the percentage of rooting
2.4 煉苗與移栽
組培苗經煉苗移栽,約15 d后發出新芽。檢查根部有新根長出即移栽成活,移栽成活率達96.70%,成活植株長勢較好且一致。圖1H可知:無菌苗移栽1、15和40 d后生長良好。
2.5 分段培養效果
將誘導與繼代增殖的不定芽進行分段培養。首先,將經消毒的外植體接入誘導與增殖培養基進行不定芽的誘導與增殖;接著,將誘導與增殖的不定芽接入伸長培養基進行伸長培養;然后,將經過伸長培養的枝條剪下,一部分接入生根或增殖不定芽,進行分段循環培養;最后,將生根完成的無菌苗移栽煉苗,投入常規容器苗培育。經分段培養的組培苗,各無性系不定芽得到有效利用,有效枝條比例顯著提升,單個外殖體的繁殖潛能高達 3 865 株·株?1·a?1。
3 討論與結論
3.1 討論
植物組織培養中,基本培養基的區別主要在于無機鹽的種類和含量的不同[17]。MS培養基中無機鹽和離子濃度較高,具有較穩定的離子平衡,養分的數量和比例合適,因而適用范圍比較廣,是多數植物組織培養快速繁殖的基本培養基。相較于MS培養基,DCR與WPM培養基均是低鹽培養基。本實驗結果表明:DCR與WPM培養基的誘導效果均優于常用的MS基本培養基;不定芽誘導中DCR培養基效果最佳,不定芽增殖中WPM效果最佳。這與低鹽培養基更適合于外植體生長和增殖的報道相符[18]。
植物生長調節劑尤其生長素和細胞分裂素在調控離體器官發生中起關鍵作用[19]。本研究中選用6-BA和IBA作為植物生長調節劑,選用CH作為營養物質,研究不同組合在柳杉芽誘導過程中的作用。結果表明:6-BA最佳質量濃度為1.00 mg·L?1,同時添加少量的IBA(0.10 mg·L?1)誘導率可達100%,增殖系數達到9.0以上。有研究[20]表明:CH對獼猴桃Actinidia chinensis芽苗的生長有一定促進作用;本研究中,添加CH的處理組合其誘導與增殖效果均無明顯差異,可見CH不適用于柳杉不定芽的誘導與增殖。
有研究認為:繁殖系數過高,不定芽過度增殖會引起組培苗弱化,生長勢變差[21]。崔佩榮[22]在對紫萼Hosta ventricosa繼代增殖培養時發現:有效芽增殖系數隨著植物生長調節劑質量濃度增加呈先上升后再下降規律,影響有效芽增殖。本研究采用高質量濃度植物生長調節劑培養基與低質量濃度植物生長調節劑培養基交替繼代,對柳杉組培苗進行分段培養,可有效解決上述問題,顯著加快柳杉組織培養進程,為工廠化育苗提供了有效途徑。
大量研究[23]表明:培養基的無機鹽質量濃度降至一半,可有效提高大多數植物的生根能力;WPM和DCR培養基是低鹽培養基,因此常和不同質量濃度植物生長調節劑配合誘導組培苗生根。本實驗利用WPM和DCR培養基配合低質量濃度的IBA誘導生根,柳杉幼苗生根率高達100%,同時生根較快,根系健壯。生根的無菌苗移栽至V(泥炭)∶V(蛭石)=1∶1的基質中,澆透水,保持相對濕度90%~100%,30 d后存活率達96.70%。
3.2 結論
本研究建立的柳杉外植體分段培養再生體系,主要包括叢生芽誘導、伸長、生根及移栽等。不定芽誘導與增殖階段,無性系在WPM+1.00 mg·L?16-BA+0.10 mg·L?1IBA中培養,不定芽誘導率(100%)和增殖系數(9.13)顯著高于其它處理;不定芽伸長階段采用高-低質量濃度植物生長調節劑培養基交替分段培養,柳杉無性系繼代增殖效果良好,有效枝條增長率可達到456.87%;生根培養階段,無性系離體生根的最適宜培養基為DCR+0.10 mg·L?1IBA,且3個無性系生根率最高可達100%;煉苗移栽階段,生根的無菌苗移栽至V(泥炭)∶V(蛭石)=1∶1的混合基質,經過15~20 d煉苗,成活率高達96.70%。從不定芽的誘導到生根僅需4~5個月,繁殖潛能高達3 865株·株?1·a?1。綜上所述,柳杉分段培養的組培模式可有效解決柳杉外植體叢芽分化能力強而芽伸長不足的問題。

