胰腺內副脾與G1級神經內分泌腫瘤的MRI鑒別診斷
盧明智 王鐵功 邵成偉 詹茜
1海軍軍醫大學第一附屬醫院放療科,上海 200433;2海軍軍醫大學第一附屬醫院影像醫學科,上海 200433
副脾是指發生在正常脾臟之外的脾組織,較常發生于脾門及胰尾部[1]。胰腺內副脾(intrapancreatic accessory spleen, IPAS)與胰腺富血供腫瘤容易混淆,其中G1級胰腺神經內分泌腫瘤(pancreatic neuroendocrine neoplasms, PNENs)因臨床表現不典型、與IPAS影像學表現特征重疊較多,成為臨床鑒別診斷的難點,容易互相誤診。臨床上IPAS不需要特別處理,而G1級PNENs則多需手術切除[2],所以在影像學上對兩者進行鑒別診斷意義較大。本研究通過對兩組病例圖像分析,以期發現IPAS和G1級PNENs的MRI特征及鑒別點,提高診斷準確率。
資料與方法
一、一般資料
回顧性分析2013年1月至2019年12月間海軍軍醫大學第一附屬醫院收治的IPAS及PNENs患者資料。IPAS納入標準:(1)經手術病理或99mTc熱變性(Tc-99m-heat-denatured red blood cell, HDRBC)紅細胞顯像證實為胰尾副脾患者;(2)術前行MRI平掃加增強檢查。排除標準:圖像質量不佳,不能用于分析者。PNENs納入標準:(1)經手術病理證實的G1級PNENs患者;(2)病灶位于胰尾部;(3)術前行MRI平掃加增強檢查。排除標準:(1)有遠處臟器和(或)淋巴結轉移的患者;(2)圖像質量不佳,不能用于分析者。
二、MRI檢查方法
采用美國GE3.0T超導型MR儀和體線圈。受檢者于MR檢查前8 h禁食禁水,檢查前訓練呼吸。采用胰腺軸位和冠狀位T2WI、2D-MRCP掃描,再進行橫斷面T1WI平掃和3期增強掃描。具體參數:(1)軸位脂肪抑制T2WI序列,重復時間(repetition time, TR)6316.0 ms,回波時間(echo time, TE)87.0 ms,層厚5 mm,層間距1 mm,視野(field of view, FOV)360 mm×420 mm,矩陣192×320。(2)冠狀位屏氣單次激發快速自旋回波(single-shot fast spin echo,SSFSE)序列,TR 2438.0 ms,TE 120 ms,層厚6~10 mm,無層間距,反轉角90°,FOV 420 mm×420 mm,矩陣224×288。(3)2D-MRCP序列,TR 7000.0 ms,TE 1230.0~1270.0 ms,層厚64 mm,無層間距,反轉角90°,FOV 420 mm×420 mm,矩陣288×288。(4)肝臟容積加速采集(liver acquisition with volume acceleration,LAVA)T1WI序列,TR 2.58 ms,TE 1.18 ms,層厚5 mm,無層間距,FOV 440 mm×440 mm,矩陣224×270。增強掃描使用高壓注射器注射對比劑,注射速率為3.0 ml/s,分別于注射后20~25 s、60~70 s、110~130 s掃描獲取動脈期、靜脈期和平衡期圖像。掃描范圍包括胰腺及鄰近器官。
三、圖像分析
由2名影像科主治醫師盲法分別閱片,最終達成一致意見,主要觀察內容:(1)病灶一般情況,如形態、大小、是否突出于胰腺輪廓之外、是否囊變等;(2)病灶實性部分、病灶平掃T2WI及DWI信號,以脾臟信號為參考,信號程度與脾臟信號相近為等信號,高于脾臟信號為高信號;(3)多期強化方式,包括病灶強化前后一致或病灶強化前后不一(動脈期和平衡期強化范圍不同,通常動脈期強化范圍較小,平衡期強化范圍較大);(4)增強后病灶邊緣假包膜;(5)胰管是否擴張。
四、統計學處理
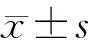
結 果
一、一般情況
IPAS組共11例,其中男性8例,女性3例,年齡34~65歲。病灶最大徑0.8~2.7cm;9例病灶形態規整,2例邊緣呈淺分葉狀;3例病灶突出于胰腺輪廓之外,8例無突出;3例病灶內囊變,8例無囊變;11例病灶均未見假包膜。G1級PNENs組共9例,其中男性7例,女性2例,年齡48~68歲。病灶最大徑1.5~4.8 cm;4例病灶形態規整,5例邊緣呈淺分葉狀;9例病灶均突出于胰腺輪廓之外;7例病灶內囊變,2例無囊變;9例病灶均可見假包膜。兩組性別、年齡、病灶最大徑差異均無統計學意義,而病灶形態、病灶突出胰腺輪廓、病灶囊變及假包膜的差異均有統計學意義。IPAS組病灶較PNENs組病灶更規整,更易局限于胰腺輪廓之內,病灶內較少出現囊變,病灶邊緣基本無假包膜(表1)。

表1 胰腺內副脾組與神經內分泌腫瘤組患者一般情況比較
二、病灶T2WI和DWI信號特征及多期強化方式
IPAS組信號與同層面脾臟信號基本一致,11例病灶T2WI及DWI均表現為等信號。PNENs組中3例T2WI等信號,6例高信號;5例DWI等信號,4例高信號。兩組T2WI、DWI信號特征的差異均有統計學意義。IPAS組以前后不一的強化方式為主,其中10例呈前后不一,1例表現為前后一致;動脈期表現為花斑樣不均勻強化,平衡期強化均勻。PNENs組的強化方式多變,但基本呈前后一致的表現,即動脈期強化部分與平衡期強化部分重疊,強化程度可變;3例強化前后不一,實性部分呈現出逐漸向內填充式強化,6例強化前后一致。兩組強化方式差異有統計學意義(表2,圖1、2、3)。

圖1 患者女性,58歲。腹部墜脹感2年,加重2月,病灶T2WI(1A)、DWI(1B)及T1WI(1C)均與同層面脾臟信號相近,增強動脈期(1D)病灶整體呈花斑樣強化,節選層面強化較明顯,平衡期(1E)強化均勻,病理檢查提示脾小梁結構存在,細胞無異型(1F,HE染色 ×40)
三、胰管受累情況
IPAS組無胰管受累,均無胰管擴張。PNENs組2例胰管擴張,其中1例合并慢性胰腺炎。兩組胰管受累情況差異無統計學意義(表2)。

表2 胰腺內副脾組與神經內分泌腫瘤組患者影像學特征及胰管受累情況比較(例)
討 論
IPAS與脾臟成分一致,成像基礎同脾臟。占脾臟體積90%的紅髓內含大量的靜脈性血竇[3],水分含量較多,直接表現為脾臟組織T1WI信號偏低。胰腺腺體內富含水溶性蛋白和糖原,這兩種物質均可縮短T1,致胰腺組織T1WI信號偏高[4]。因此,胰腺和胰腺內副脾的T1信號對比較明顯,在T1WI平掃上常可檢出病灶。另外,脾臟紅髓靜脈性血竇之間由致密的網狀內皮系統構成,起到過濾血液的作用,細胞通過緩慢,分子彌漫稍受限,導致脾臟組織在DWI上信號偏高。同理由于網狀內皮系統結構致密、血流緩慢,增強動脈期脾臟呈花斑樣強化,平衡期強化均勻,強化方式呈現出前后不一的表現。
相對于G1級PNENs,G2~G3級腫瘤更易出現體積大、邊界欠清、低強化、胰管擴張、遠處轉移等偏惡性征象[5-6],所以本研究選擇與IPAS有更多共同影像特征的G1級PNENs進行分析。兩者均為男性好發,IPAS發病年齡略低于PNENs,與Ishigami等[7]研究結果類似,但是兩者年齡差異無統計學意義,這可能與樣本量較少有關。兩者在MR上均可表現為小病灶、強強化,所以兩者在影像學診斷中容易誤診。
本研究結果顯示,IPAS常局限于胰腺輪廓之內,可能與IPAS的發生機制相關。胚胎期融合失敗的胃背系膜脾芽種植于胰尾,隨后與胰腺組織共同生長,所以基本不會破壞胰腺本身形態。本組11例IPAS中3例突出于胰腺輪廓之外;而9例PNENs均突出于胰腺輪廓之外,因此這一影像學特征可以作為兩者的鑒別征象。IPAS與PNENs病灶內均可發生囊變,11例IPAS中3例病灶內發生囊變,9例PNENs中7例病灶內發生囊變,可見PNENs更易發生囊變,但兩者差異無統計學意義,考慮與樣本量過少有關。另外,IPAS組11例均無胰管擴張,PNENs組9例僅2例胰管擴張,其中1例并發慢性胰腺炎,所以胰管是否擴張不能用于兩者鑒別診斷。

圖3 患者男性,52歲。體檢發現胰尾部占位,病灶突出于胰腺輪廓之外,T2WI(3A)呈明顯高信號,DWI(3B)呈環形高信號,T1WI(3C)呈低信號,增強動脈期(3D)病灶環形強化,平衡期(3E)強化范圍較動脈期增寬,免疫組織化學顯示嗜鉻素A陽性(3F ×100)
由于特殊的組織成分,IPAS的T1WI信號偏低,與胰腺信號對比明顯,但PNENs的腫瘤細胞成分及囊變成分也表現為T1WI低信號,所以兩者T1WI信號差異較小。然而PNENs實性部分在T2WI上以高信號多見、在DWI上約一半病灶表現為高信號,而IPAS在T2WI及DWI上均表現為等信號,兩組差異均有統計學意義,與Kang等[8]研究結果一致,提示T2WI和DWI信號可以作為兩者鑒別的參考因素。
增強動脈期IPAS常表現為花斑樣強化,平衡期強化均勻,呈現出前后不一的表現。本組11例IPAS中10例表現為典型的前后不一強化方式,1例動脈期均勻強化,該例病灶最長徑約1.0 cm,且脾臟動脈期也為均勻強化,考慮為病灶較小、動脈期掃描時間偏遲所致。PNENs較常發生囊變,囊變部分不強化,實性部分強化,動脈期及平衡期強化范圍基本一致,差異主要表現在強化程度上。本組9例PNENs中3例表現為前后不一,均為逐漸擴散式強化,與IPAS前后不一的強化方式不完全一樣。另外,增強掃描后PNENs病灶周圍均可見假包膜,表現為病灶邊緣環形強化,而IPAS組均無此現象,可以作為兩者的鑒別征象。
綜上所述,除了共有表現以外,IPAS和PNENs分別具有各自的影像學特征。IPAS病灶常局限于胰腺輪廓之內,病灶信號與同層面脾臟信號相近,內部信號均勻,囊變少見,多期增強顯示為前后不一的強化方式,無假包膜;PNENs病灶基本均突出于胰腺輪廓之外,病灶T2WI及DWI信號均可高于脾臟信號,內部信號欠均,囊變多見,多期增強顯示為前后一致的強化方式,病灶邊緣可見假包膜。典型的IPAS通過以上影像學特點,基本可以將其與PNENs鑒別開來。
IPAS與PNENs鑒別的難點在于囊變的IPAS,囊變破壞了IPAS本身的形態特點,導致病灶更易突出于胰腺輪廓之外,本組3例囊變病灶有2例突出于胰腺輪廓之外,另外囊變的病灶實性部分減少,不利于信號及強化方式的觀察,也給鑒別診斷帶來了難度。所以,當遇到胰尾部囊變病灶時,需要更加仔細地觀察殘余實性成分的信號特點、強化方式及假包膜等因素進行診斷。
目前臨床上通過HDRBC對IPAS進行確診。本研究IPAS組中3例行HDRBC檢查,其中1例未見明顯放射性濃聚,漏診后行手術治療,病理提示為IPAS,回顧分析該病例,考慮為病灶過小(最長徑約1.0cm)、距離脾臟過近,導致病灶被脾臟的放射性濃聚所掩蓋可能。
因本研究為回顧性研究,不能對多b值DWI信號進行對比分析;且樣本量較少,導致部分研究結果可能存在偏差。
利益沖突所有作者均聲明不存在利益沖突

