成人胰母細胞瘤伴肝轉移一例并文獻復習
蔡宇夢 韓序 朱娜 樓文暉 紀元
1復旦大學附屬中山醫院病理科,上海 200030;2復旦大學附屬中山醫院胰腺外科,上海 200030
【提要】 發生在成人的胰母細胞瘤十分罕見。本文報告1例成人胰母細胞瘤的臨床病理學特征,并進行文獻復習。結果顯示胰母細胞瘤無典型的首發癥狀,影像學表現多為單發的類圓形或分葉狀腫塊。病理學顯著特征為腫瘤可向腺泡細胞、神經內分泌等多種方向分化,均可見鱗狀小體結構。胰母細胞瘤需與胰腺腺泡細胞癌、胰腺神經內分泌腫瘤、胰腺實性假乳頭狀腫瘤相鑒別,其長期預后及治療策略需進一步研究。
胰母細胞瘤(pancreatoblastoma)是一種罕見的惡性上皮性腫瘤,占胰腺外分泌腫瘤的0.5%[1]。1957年Becker[2]首次將其描述為嬰兒型胰腺癌。1977年Horie等[3]發現其結構類似于胚胎第8周的胰腺,將其命名為胰母細胞瘤。該腫瘤好發于兒童,成人罕見。自Palosaari等[4]于1986年報道第1例成人胰母細胞瘤以來,至今英文文獻報道僅44例,現結合相關文獻回顧性分析成人胰母細胞瘤的臨床特征。
一、資料與方法
1.病例資料:患者男性,56歲,因體檢發現胰尾及肝左葉占位就診。腫瘤標志物檢測:AFP 5.2 μg/L(正常值<20 μg/L)、CEA 2.4 μg/L(正常值<5 μg/L),CA19-9 18.1 U/ml(正常值<37 U/ml)。CT示胰腺體尾部片狀稍低密度灶,3.2 cm×3.0 cm,邊界欠清,增強后輕度不均勻強化,遠端胰腺尾部結構萎縮;肝左外葉見類圓形低密度灶,5.1 cm×4.6 cm,增強后可見不均勻強化。MRI檢查示胰尾局部結節狀異常信號,3.8 cm×3.1 cm,呈T1WI低、T2WI高信號影,DWI稍高信號,增強后不均勻輕度強化,遠端胰腺尾部結構萎縮;左肝Ⅱ段可見一類圓形異常信號,直徑約50 mm,呈T1WI低、T2WI高信號影,DWI稍高信號,境界清楚,部分突出輪廓外,增強后呈不均勻輕中度強化。診斷:胰尾部腫瘤伴肝左外葉轉移灶機會大。入院后剖腹探查,術中見胰尾部腫瘤,約2 cm,質地硬,不易推動;左肝觸及一結節狀腫物,5.0 cm×4.5 cm×4.5 cm,質稍硬。行胰體癌擴大根治術并后腹膜淋巴結清掃加肝段切除術。大體病理見胰尾部一灰白結節,2.7 cm×2.0 cm×1.5 cm,切面灰白,質中,界欠清,周圍胰腺組織質稍硬;切除的肝臟大小9.0 cm×6.0 cm×5.5 cm,切面緊鄰被膜,距離肝切緣1.1 cm見一結節狀腫物,5.0 cm×4.5 cm×4.5 cm,切面灰白色,結節狀,質稍硬,界清。鏡下見胰腺腫瘤包膜完整,細胞呈多角形,大小一致,胞質稍淡染、核膜清晰,可見小核仁,核分裂象少見(圖1),腫瘤細胞排列成“器官樣”結構(圖2)、腺泡樣結構(圖3),并可見散在巢狀腫瘤細胞構成的鱗狀小體(圖4)。免疫組織化學染色示胰腺腫瘤神經內分泌分化區域Syn+、CD56+,Ki-67陽性指數約30%,鱗狀小體區域腫瘤細胞核β-catenin+(圖5)。肝臟腫瘤與周圍肝組織界限清楚,纖維間隔將腫瘤細胞分隔成境界清楚的細胞島(圖6),腫瘤細胞大小一致,胞質稍淡染,可見鱗狀小體結構。免疫組織化學染色示肝臟腫瘤部分細胞Syn+、CgA+、CD56+、CK19+(圖7),鱗狀小體區域腫瘤細胞核β-catenin+、CK7-。病理診斷:(胰腺)胰母細胞瘤;(肝臟)轉移性胰母細胞瘤。第二代測序結果顯示原發灶與轉移灶均有Wnt信號通路關鍵因子CTNNB1基因(可編碼β-catenin蛋白)的突變及11q13染色上MEN1基因缺失,并激發下游YAP1基因突變。術后未行放、化療。隨訪12個月,影像學檢查未見復發。
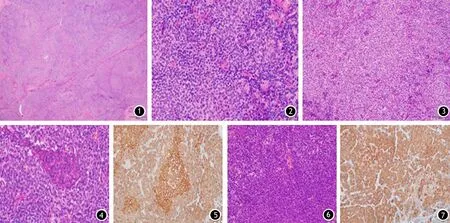
圖1 腫瘤纖維間隔間豐富的細胞島(HE染色 ×40) 圖2 腫瘤細胞排列成類似神經內分泌分化的“假菊形團樣”形態( HE染色 ×400) 圖3 腫瘤細胞排列成腺泡樣形態(HE染色 ×200) 圖4 腫瘤內散在的“鱗狀小體”結構(HE染色 ×400) 圖5 鱗狀小體區域β-catenin核陽性(EnViSion染色染色 ×400) 圖6 肝臟轉移灶細胞豐富,可見纖維分隔(HE染色 ×200) 圖7 腺泡分化區域CK19染色陽性(EnViSion染色 ×200)
2.文獻檢索:以“pancreatoblastoma”、“pancreatic tumour”、“pancreatic neoplasm”作為檢索詞在“PubMed”中進行檢索,檢索到有關文獻35篇共44例[4-34]。
二、結果
1.臨床表現:文獻報道44例加上本例共45例成人患者,其中男性24例,女性21例,男女比例1.1∶1,年齡18~78歲。主要癥狀:腹痛20例次、體重減輕14例次、黃疸10例次、腹部包塊7例次、腹瀉3例次、無明顯癥狀3例次,1例體檢發現,7例未具體報道。發病部位:胰頭22例、胰尾11例、胰體8例、Vater壺腹1例,3例未報道。腫物長徑:2~20 cm。
2.影像學表現:超聲主要表現為胰腺內實質性腫塊,內部回聲不均勻,并可見血流信號;CT主要表現為單發的類圓形或分葉狀腫塊,邊界清晰,呈實性或囊實性;MRI主要表現為T1WI呈低至中等信號,T2WI呈稍高或高信號。45例中13例(28.9%)就診時已發現轉移灶,其中肝轉移10例次,合并肝肺轉移者1例次,淋巴結轉移5例次。
3.病理組織學改變:肉眼觀察腫物均為結節狀,最大徑2~20 cm。鏡下見腫瘤細胞呈多角形,大小一致,胞質稍淡染、核膜清晰,核仁明顯,被纖維間隔分成邊界清楚的上皮細胞島,呈腺泡樣、菊形團樣、導管樣結構。可見特征性的鱗狀小體結構,由大的上皮樣細胞島和梭形細胞構成的漩渦狀細胞巢構成,伴有明顯的角化,細胞核大,核仁不明顯。
4. 治療及隨訪:33例行腫瘤根治性切除,其中12例術后行化療;1例行不完全切除,術后行化療;2例姑息性放療+化療;2例姑息性化療;7例未知。隨訪時間1~108個月,17例死亡,生存時間4~51個月;14例無病生存,已生存時間5~108個月;4例遠處轉移,其中肝轉移3例[4,20],肺轉移1例[17];10例無隨訪記錄。1、3、5年生存率分別為47%(21/45)、24%(11/45)、4%(2/45)。
討論胰母細胞瘤為少見的惡性上皮性腫瘤,為最常見的胰腺兒童腫瘤,偶見于成人,發病無性別差異。其發病癥狀多不典型,常以腹痛為首發癥狀。30%~50%的兒童病例可見血清腫瘤標志物(如CEA、AFP)水平升高,而成人胰母細胞瘤的腫瘤標志物水平通常在正常范圍內[33]。
成人與兒童胰母細胞瘤的影像學表現無明顯區別,主要表現為單發的類圓形或分葉狀腫塊,邊界清晰,呈實性或囊實性;MRI的T1WI呈低至中等信號,T2WI呈稍高或高信號。胰母細胞瘤在影像學上需與以下疾病進行鑒別:(1)胰腺腺泡細胞癌: 多見于中老年,腫瘤一般較大,邊界清楚,均勻增強,T1WI呈低信號,T2WI呈混雜高信號。常可見旋渦狀、裂隙狀的特征性壞死,鈣化罕見。(2)胰腺實性假乳頭狀腫瘤:多見于青年女性,腫瘤呈囊實性為主的類圓形低密度腫塊,增強CT顯示實性區多漸進性強化,邊界清楚。當發生出血性囊變時難與胰母細胞瘤鑒別,鈣化主要分布在病灶周圍。胰腺實性假乳頭狀腫瘤通常為良性,偶見惡性,少發生轉移。
明確診斷依賴于切除標本的病理學檢查。胰母細胞瘤大部分為境界清楚的孤立結節,長徑2~20 cm,切面呈灰黃、灰褐色,質軟,囊性者少見,且通常伴有Beckwith-Wiedemann綜合征[14,25]。 鏡下見腫瘤由上皮和間葉兩種成分構成,上皮成分細胞豐富,可被纖維間隔分隔成境界清楚的細胞島。由于腫瘤具有向多種方向分化的特點,需與以下疾病鑒別:(1)胰腺腺泡細胞癌:腫瘤細胞豐富,被纖細的纖維間隔帶分隔成結節狀,可見壞死,可排列成腺泡和實性兩種結構。免疫組織化學染色顯示胰蛋白酶、糜蛋白酶、脂肪酶等陽性。而胰母細胞瘤分葉狀結構更明顯,纖維間質中細胞更豐富,且具有特征性的鱗狀小體。(2)胰腺神經內分泌腫瘤:一般為單個結節,邊界不清,有“器官樣”特征,但無胰母細胞瘤特有的鱗狀小體,免疫組織化學染色顯示神經內分泌瘤Syn、CgA、CD56彌漫強陽性,而胰母細胞瘤僅部分腫瘤細胞呈陽性。(3)胰腺實性假乳頭狀腫瘤:腫瘤通常巨大、圓形、切面實性,出血、壞死囊性變常見,質地通常較軟。鏡下腫瘤由形態一致的黏附性差的腫瘤細胞構成,腫瘤細胞圍繞纖細的血管軸心呈放射狀排列成類似“室管膜樣”的菊形團,無真正的腺管形成,免疫組織化學染色vimtenin、CD10、β-catenin等均陽性。
胰母細胞瘤具有侵襲性及惡性的生物學行為,可伴有局部浸潤、復發及遠處轉移。腫瘤可侵犯鄰近的組織結構如脾臟、結腸、十二指腸、門靜脈、胰腺周圍軟組織及膽總管。肝臟是最常見的遠處轉移部位。手術切除是目前最有效的治療手段,根治性切除與患者長期生存有關。腫瘤未切除患者的中位生存時間僅5個月,而腫瘤切除患者的中位生存時間為15個月,術后輔以放化療可將中位生存時間增加至20.5個月[1]。Ohike等[26]報道的1例患者手術切除后隨訪108個月無腫瘤復發。Salman等[1]報道的1例伴肝轉移的胰母細胞瘤患者,術后輔以化療,隨訪41個月無腫瘤復發。與兒童相比,成人胰母細胞瘤患者的預后較差,3年生存率<40%[11,18,23]。腫瘤無法切除、轉移和術后復發為預后不良因素。由于目前病例數有限,其長期預后及最佳治療策略仍有待研究。
迄今為止,胰母細胞瘤的病因和分子發病機制尚不清楚。有報道稱胰母細胞瘤與家族性腺瘤性息肉病綜合征[14]和Beckwith-Weidemann綜合征[25]有關,因胰母細胞瘤中會出現Beckwith-Weidemann綜合征常見的遺傳學改變,包括11p染色體等位基因雜合性缺失以及APC/β-catenin通路的體細胞突變。與胰腺導管腺癌不同,未發現胰母細胞瘤存在p53和K-ras基因突變[14,25]。本例腫瘤突變事件發生的時間順序依次為上游MEN1基因缺失、上游CTNNB1基因突變、下游YAP1基因突變,這一結果目前尚未見文獻報道。是否下游YAP1基因的突變促使了腫瘤轉移尚不清楚。MEN1基因突變在胰母細胞瘤中的意義有待進一步探索。
利益沖突所有作者均聲明不存在利益沖突

