急性大面積腦梗死腦電圖δ/α功率比值與中線結構移位的相關性研究
張哲,劉大成,劉婧伊,田佳,2,濮月華,劉麗萍
急性大面積腦梗死是由一側頸內動脈或大腦中動脈閉塞引起,梗死體積占大腦中動脈流域的2/3或以上的神經危重疾病。大面積腦梗死后梗死區可能形成占位效應的腦水腫,引起中線結構移位、患者意識水平下降,最終導致腦疝甚至死亡[1]。在發病早期密切監測患者意識水平和神經體征變化,通過神經影像學手段觀察中線結構移位,是該病診治的關鍵。
定量腦電圖(quantitative electroencephalography,qEEG)是通過計算腦電圖(electroencephalography,EEG)的頻帶功率及其衍生參數,可用于評估神經危重癥患者的意識水平。Claassen等[2]發現,EEG后頭部α功率反映更清楚的意識水平。在多種qEEG參數中,δ/α功率比值(δ/α power ratio,DAR)最為常用[3-7]。對于大面積腦梗死患者,qEEG能否用于反映引起意識水平改變的大腦中線結構移位,是否比常規臨床量表更敏感,尚缺少研究。本研究目的為評估急性大面積腦梗死DAR和中線結構移位之間的相關性,并探索反映中線結構移位變化的最敏感的DAR變化區域。
1 研究對象和方法
1.1 研究對象 本研究為回顧性研究,選擇2017年9月-2019年5月在首都醫科大學附屬北京天壇醫院神經重癥監護病房接受治療、完成常規或長程EEG監測的大面積腦梗死患者。入組標準:①年齡≥18歲;②頭顱CT或MRI顯示腦梗死體積累及大腦中動脈流域2/3或以上;③EEG在發病后7 d內完成,EEG檢查前后4 h內有頭顱CT或MRI檢查及NIHSS評分和GCS評分的臨床記錄。排除標準:①大面積梗死病灶對側大腦半球有新發或陳舊梗死病灶;②腦死亡;③在EEG開始前或結束后4 h內,未完善頭顱CT或MRI檢查;④使用鎮靜或抗癲癇藥物;⑤已接受去骨瓣手術;⑥既往癲癇病史。本研究由首都醫科大學附屬北京天壇醫院倫理委員會批準(倫理審查編號:KYSQ 2020-100-01)。
1.2 臨床資料收集與中線結構移位測量 回顧性收集入組患者的人口學資料及臨床、影像信息,包括性別、年齡、發病時間、主要治療方式、CT或MRI所示梗死側別、CTA或MRA所示血管閉塞部位、高血壓、糖尿病、脂代謝紊亂、心房顫動病史,吸煙史,以及EEG記錄期間NIHSS評分和GCS評分。
根據Pullicino等[8]的方法,1名獨立于EEG分析的神經內科醫師測量中線結構的水平移位。選取基底節-內囊水平的非對比增強CT或MRI 的T1WI序列軸位圖像,沿冠狀方向繪制1條通過透明隔、兩端止于顱骨內板的直線,透明隔將此直線分為2段,中線結構移位=2段直線長度(mm)差值/2。對于接受常規EEG監測的患者,選擇EEG監測4 h內的CT或MRI測量;對于接受長程EEG監測的患者,將EEG開始前4 h內和結束后4 h內的CT或MRI資料一并納入分析。
1.3 定量腦電圖數據獲取和分析 使用美國Nicolet腦電監測系統(美國Natus醫學公司)完成常規(時長<8 h,通常1 h)或長程EEG監測(時長≥8 h)。按照國際10/20系統安放Ag/AgCl電極。采集參數設置為采樣率250 Hz,高通濾波0.5 Hz、低通濾波70 Hz、陷波濾波50 Hz。在EEG記錄期間,患者會被醫護人員間斷刺激(至少1次/時),給予的刺激包括聽覺和(或)傷害性刺激、神經科查體、被動活動、喂食、吸痰操作等。在EEG監測同時,記錄NIHSS評分和GCS評分。通過EEG原始圖像和同期視頻記錄識別并剔除EEG偽差。選擇距CT或MRI掃描最近、無偽差、長度為30 min的一段EEG做定量分析;常規EEG只選取一段EEG納入分析,長程EEG在前后半程分別選取一段EEG納入分析。
使用快速傅里葉變換,分別計算δ頻帶(0.5~4 Hz)、α頻帶(8~13 Hz)功率,根據DAR=δ頻帶功率/α頻帶功率,計算DAR。首先將各導取平均導聯,分別計算梗死側與健側半球的DAR平均值。再取雙極縱聯(double banana),以F3/4-C3/4、T3/4-P3/4和P3/4-O1/2導聯分別代表前、中、后頭部區域,計算各自的DAR。
1.4 分組和比較 根據中線結構移位≥5 mm和<5 mm,≥10 mm和<10 mm分組,比較組間不同EEG區域和半球的DAR,以及NIHSS評分、GCS評分是否存在組間差異。
1.5 統計學方法 使用StataMP 16軟件(美國Stata公司)完成。計量資料符合正態分布,用表示,使用Spearman秩相關系數評價各變量與中線結構移位的相關性,使用Wilcoxon秩和檢驗統計各變量的組間差異。選擇在中線結構移位≥5 mm、≥10 mm時差異均有統計學意義的qEEG變量,與NIHSS評分、GCS評分一起進行ROC曲線分析,計算判斷中線結構移位≥5 mm、≥10 mm的界值及其敏感度、特異度。由于共有10項變量納入分析,需應用Bonferroni校正以降低Ⅱ類錯誤,以P<0.005為差異有統計學意義。
2 結果
2.1 一般資料 研究共納入29例患者,其中9例患者進行了長程EEG檢測,20例患者進行了常規EEG檢測,共計38段EEG及其對應的頭顱影像、NIHSS評分和GCS評分納入分析,頭顱影像所示中線結構移位距離0~20 mm,平均6.34±5.16 mm。入組患者年齡范圍43~86歲,男性∶女性為20∶9。患者的人口學、臨床和影像信息見表1。
2.2 腦電圖特點 EEG監測平均在卒中發病后2.55±1.69 d啟動,檢測時長1~36 h,平均監測時長10.36±9.92 h。EEG監測與神經影像掃描間隔20 min至4 h,平均間隔2.44±1.13 h。所有EEG均未見非驚厥性癲癇發作圖形,2例(6.90%)患者觀察到偏側性節律性δ活動。對于中線移位>5 mm的患者,可觀察到健側慢波活動增加(圖1)。

表1 患者基本信息和臨床資料
2.3 相關性分析和分組比較 梗死側半球DAR、梗死側前頭部DAR、健側半球DAR、健側前頭部DAR、健側中間部DAR、健側后頭部DAR與中線結構位移均呈正相關,GCS評分與中線結構位移呈負相關(表2)。
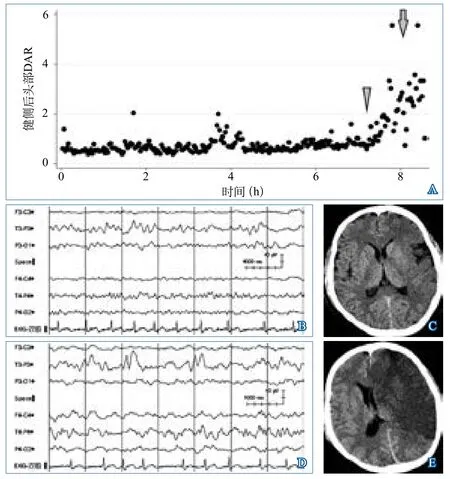
圖1 大面積腦梗死qEEG與中線結構移位關系的典型病例
根據中線結構移位是否≥5 mm將數據分為2組,僅健側后頭部DAR的差異有統計學意義(6.48±5.70vs2.09±1.47,P=0.0043)。根據中線移位是否≥10mm的分組差異比較中,健側半球、前、中、后頭部DAR以及患側半球、前頭部DAR、GCS評分差異均有統計學意義(表3)。
2.4 ROC曲線分析 由于僅健側后頭部DAR同時在中線結構移位是否≥5 mm和≥10 mm分組比較中差異有統計學意義,所以將健側后頭部DAR和NIHSS評分、GCS評分進行ROC曲線分析,繪制ROC曲線(圖2)。健側后頭部DAR界值分別取≥2.326、≥2.569時,判斷中線結構移位≥5 mm、≥10 mm的曲線下面積(area under the curve,AUC)分別為0.7699和0.8848,均高于NIHSS評分和GCS評分(表4)。
3 討論
本研究通過不同部位的EEG定量參數、常用的臨床功能量表(NIHSS、GCS)評分與大面積腦梗死中線結構移位的相關性分析、組間比較和ROC分析,明確僅有健側后頭部DAR是反映中線結構移位的良好指標。研究結果表明,qEEG參數比臨床評估更加敏感,適用于輔助大面積腦梗死的臨床決策。
在本研究中,健側后頭部DAR在中線結構移位≥5 mm組和≥10 mm組中均顯著升高,健側半球、前、中、后頭部以及患側半球、前頭部DAR僅在移位≥10 mm組中顯著升高。說明隨中線結構移位加重,腦電慢活動的范圍逐漸擴展,但只有健側后頭部DAR能夠在中線結構移位早期出現變化,此時GCS評分、NIHSS評分均尚未出現差別。通過ROC分析,進一步證實健側后頭部DAR是提示中線結構移位最敏感的指標。DAR能反映腦中線結構移位的可能的機制為:后頭部α節律作為背景節律,本身可以隨著意識水平下降,逐漸演變為慢波活動[2];隨著腦組織受壓、腦血流量下降,正常的神經元代謝受到阻礙,依次出現β頻帶活動消失、背景頻率減慢至θ~δ頻帶,最終可演變為電靜息[9];梗死側由于大腦組織嚴重受損,EEG表現為慢波活動甚至電壓衰減,無法反映中線結構移位、意識水平下降、神經元代謝異常等變化,而健側后頭部腦電節律的演變反映了這一變化趨勢。同時,本研究還發現健側后頭部DAR提示中線結構移位的敏感度高于常用的GCS評分和NIHSS評分。這得益于EEG具有可連續監測、時間分辨率高的特點,能夠及時發現神經電活動的異常,從而反映腦組織的病理生理變化。在臨床實踐中,臨床評估不可能連續、密集進行,客觀上存在病情惡化發現可能不及時的問題,因此對幕上大面積腦梗死的患者進行EEG監測,有助于及時發現病情變化。
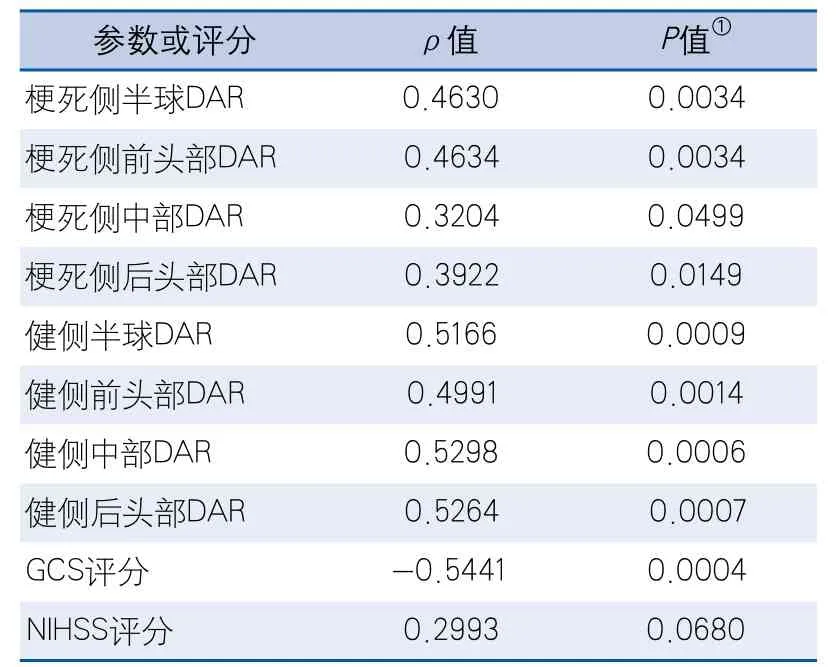
表2 不同部位DAR和臨床評分與中線結構移位的相關性
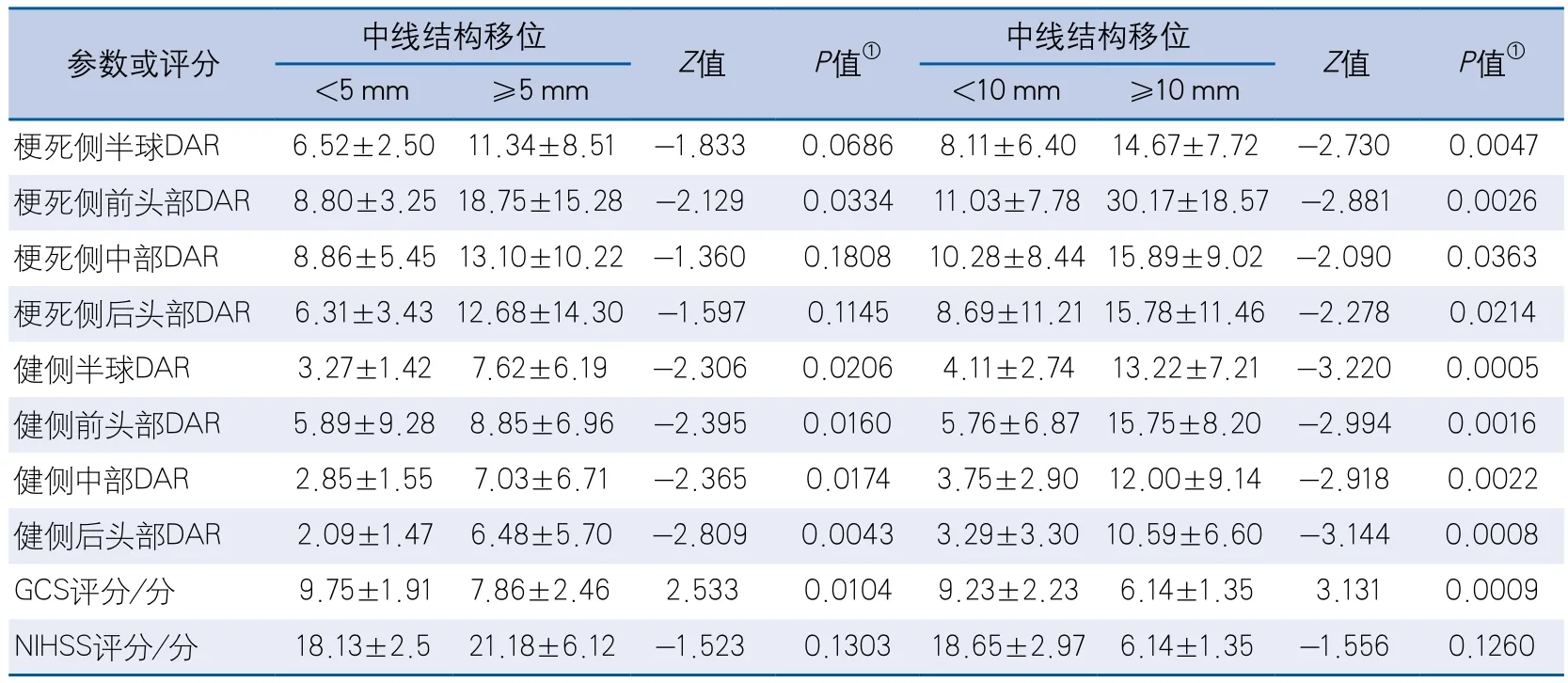
表3 不同部位DAR和臨床評分的分組差異比較

表4 健側后頭部DAR和臨床評分預測中線結構移位的ROC曲線分析
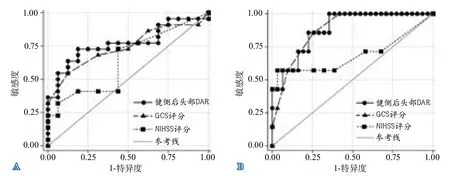
圖2 健側后頭部DAR和臨床評分判斷中線結構移位的ROC曲線
大面積腦梗死是一類具有高致死率的神經危重疾病,也稱惡性大腦中動脈梗死,經常發生高顱壓甚至腦疝,去骨瓣減壓手術可以降低病死率,但是手術時機存在爭議。美國神經重癥學會推薦在發病后24~48 h、腦疝發生前進行[10]。Akins等[11]的研究表明,通過密切的神經功能檢查和神經影像學評估,可以減少60%的去骨瓣手術,而不增加死亡率。徐鋒等[12]推薦的手術指征為中線結構位移≥5 mm。在臨床實踐中,EEG具有可在床旁連續監測的優勢。根據本研究的結果,臨床醫師可重點關注大面積腦梗死患者健側后頭部DAR的演變趨勢,判斷中線結構變化,決定去骨瓣減壓術的時機。
本研究關注EEG定量參數與大面積腦梗死中線結構移位之間的相關性,在國內外其他研究中較少出現。國內外既往研究主要通過EEG視覺判讀,利用EEG的不同頻帶的分布特征,在大面積腦梗死發病早期預測惡性病程。Burghaus等[13]分析25例大面積腦梗死患者的EEG,發現病灶區域δ活動消失,出現θ和快β活動提示良好預后,梗死側半球出現全面性慢波活動提示惡性病程。楊慶林等[14]的研究表明,EEG發現無δ波的區域性衰減可在病程早期特異性地提示大面積腦梗死,并且與腦疝等不良預后相關。Shreve等[15]使用256導高密度電極陣列EEG,發現在發病數小時內,梗死體積與兩側大腦半球的α/δ功率比值顯著負相關,作者據此認為EEG有助于在發病早期識別大面積腦梗死。Jiang等[16]通過前瞻性納入50例大面積腦梗死患者,發現健側θ功率能夠預測出院時和6個月死亡,值得注意的是,該研究同樣證實qEEG參數較GCS評分的預測準確性更高。
本研究為回顧性橫斷面研究,存在一些難以避免的缺陷:①入排標準較為嚴格,最終納入分析的病例數量偏少,減弱了統計效力;②神經影像掃描距EEG檢查存在時間間隔,在此期間,EEG理論上仍可能發生變化;③多數患者僅完成常規EEG檢查,因此無法研究同一患者EEG隨中線結構移位增加的變化趨勢;④考慮到過多的變量數影響統計效力,僅選擇qEEG分析最為常用的DAR,未研究除DAR以外的參數。
綜上所述,健側后頭部DAR與大面積腦梗死中線結構移位相關。在估測中線結構移位方面,健側后頭部DAR比GCS評分、NIHSS評分更加敏感。臨床醫師可利用EEG監測大面積腦梗死患者的神經功能,并且應重點關注健側后頭部腦電的演變,以輔助臨床決策。未來應建立前瞻性隊列,通過長程EEG監測,探索大面積腦梗死的EEG變化趨勢與中線結構移位之間的關系。
【點睛】通過對急性大面積腦梗死患者EEG的回顧性分析發現健側后頭部qEEG指標DAR可以反映患者中線結構移位,該指標優于NIHSS評分和GCS評分。

