逆轉座子LINE-1在腦膠質瘤中異常活化的臨床意義
王春輝,孟繁凱,費邵陽,陳 莫,鄭林杰
(吉林省人民醫院 神經外科,吉林 長春130021)
腦膠質瘤的發病成因復雜、發病機制仍未闡明,臨床上既缺乏有效的治療藥物也缺少用于預測中遠期預后的標志物[1]。因此尋找腦膠質瘤相關的信號分子一直是研究者關注的熱點,長散在重復序列LINE-1(LINE-1)是已知今人體內存在的唯一具有自主轉座活性的轉座子,約占基因組總量的17%[3],LINE-1可以兩個編碼蛋白:ORF1p具有高親和性的核酸分子伴侶活性,可以保護RNA免于被降解介導核酸蛋白復合物進入細胞核;ORF2p 則同時具有逆轉錄酶和核酸內切酶活性,參與cDNA的合成[4,5]。早在1988年研究者在乳腺導管癌患者的組織中檢測到了由LINE-1的轉座而引起的MYC癌基因的重排[6]。近年來,隨著二代測序技術的普及和多種LINE-1檢測方法的建立及優化,在多種腫瘤和癌變組織中發現了大量LINE-1轉座的證據,如結腸癌、肺癌、前列腺癌、卵巢癌和肝癌等[7-10]。這種LINE-1的異常活化通常預示著較差的預后和較深的癌變程度,這提示LINE-1異常激活可能是細胞癌變的誘因之一。由于技術原因導致ORF2的表達水平較低難以檢測、目前人們常以ORF1的表達水平,代表細胞中LINE-1的活化狀態,由于正常的體細胞中幾乎無法檢測到LINE-1的mRNA及其所編碼的蛋白,LINE-1的ORF-1有潛力成為檢測腫瘤惡性程度的特異性分子標志物[11]。本文探討LINE-1 ORF-1在腦膠質瘤組織中的表達水平及臨床意義,報道如下。
1 材料和方法
1.1 試劑與儀器
Trazol購自美國Qiagen公司,反轉錄、qPCR試劑盒均購自Roche公司,引物由庫美公司合成,相關引物序列見表1。
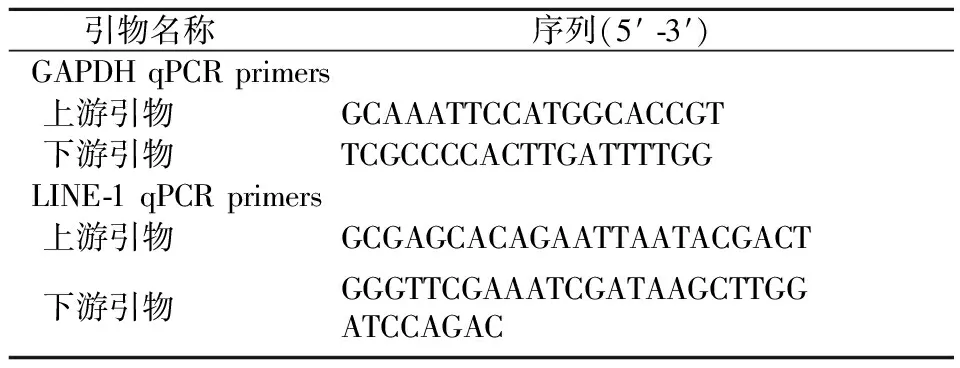
表1 引物序列信息
1.2 臨床樣本來源
腫瘤樣本的收集自2013年1月到2015年1月間,就診于吉林省人民醫院神經外科確診的腦膠質瘤者,共30例,患者術前未接受放療、化療等治療,并全部簽署了知情同意書。收集的腦膠質瘤組織和癌旁組織,經液氮速凍后,儲存于-80冰箱,以備后續實驗使用。相關操作獲得了我院倫理委員會批準。
1.3 實驗方法
將樣本在液氮中研磨粉碎,加入Trizol完全裂解后,提取總RNA;利用Roche公司Transcriptor First Strand cDNA Synthesis Kit將RNA反轉錄為cDNA;Real-time PCR檢測LINE-1 ORF1和內參GAPDH基因的mRNA表達情況;以GAPDH為內參基因,數據采用2-ΔΔCT法進行分析:ΔCT=CT(target gene)-CT(internal control);ΔΔCT=ΔCT(test gene)-ΔCT(reference gene);Ratio(fold)= 2-ΔΔCT。
1.4 預后情況隨訪
預后隨訪方式為門診復查、電話隨訪等,隨訪時間為患者術后1-60月,無進展生存期為術后至影像學證據證明復發,總生存時間為術后至患者死亡或超過60月。
1.5 統計學分析
采用SPSS錄入并比較數據,兩組數據間的比較采用t檢驗,Kaplan-Meier生存曲線比較患者生存率,Log-Rank檢驗兩組間的統計學差異,以P<0.05為具有統計學差異。
2 結果
2.1 腦膠質瘤癌組織和癌旁組織中LINE-1表達水平的差異
qPCR檢測逆轉座子LINE-1 ORF1在30例腦膠質瘤和癌旁組織中的表達情況,結果表明(圖1),LINE-1 ORF1在腫瘤組織中的表達量為0.0430±0.0287,顯著高于癌旁組織中的0.0240±0.0207(P<0.05)。
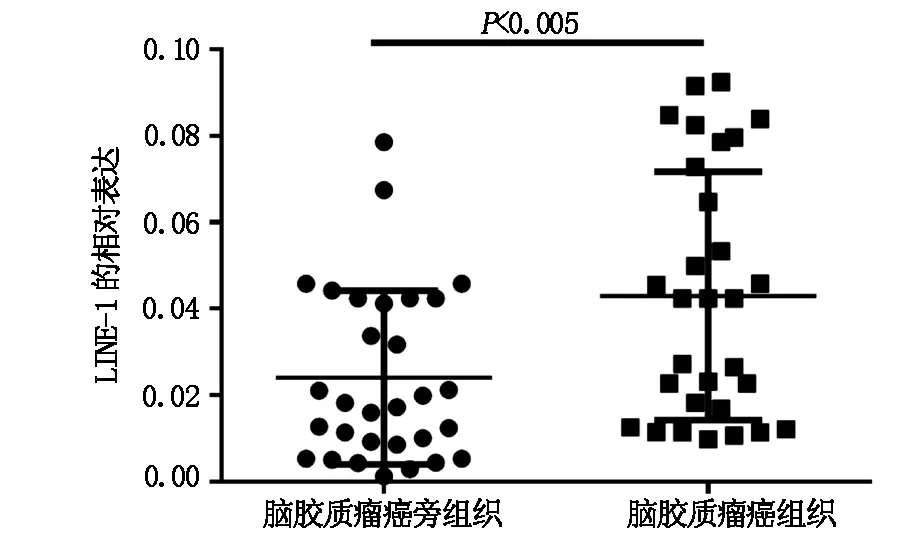
圖1 LINE-1在膠質瘤組織中的表達水平
2.2 腦膠質瘤癌組織中LINE-1表達情況與病理特征的關系
結果(表2)表明,腫瘤的大小、位置與LINE-1 ORF1的表達水平無關(P>0.05),而在高WHO分級(Ⅲ-Ⅳ級)的膠質瘤中LINE-1 OFR1的表達明顯高于低級膠質瘤(Ⅰ-Ⅱ級),同時在ki-67高表達的膠質瘤組織中,LINE-1的表達水平更高,差異具有統計學意義(P<0.05)

表2 不同病理特征腦膠質瘤中LINE-1表達情況
2.3 不同LINE-1表達情況的腦膠質瘤患者預后情況的比較
將受試患者按照,膠質瘤組織中LINE-1表達水平的中位數分為LINE-1高表達組和LINE-1低表達組,繪制生存曲線,結果表明(圖2),與LINE-1低表達組相比,LINE-1高表達組的生存率顯著降低,差異具有統計學意義。
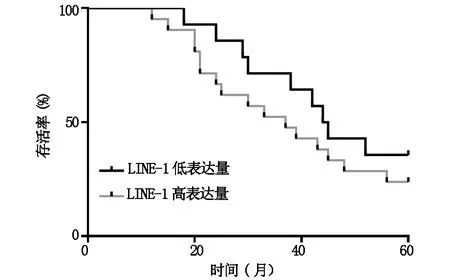
圖2 不同LINE-1表達水平的腦膠質瘤患者生存率的比較
3 討論
腦膠質瘤是最為常見的原發性顱腦惡性腫瘤,具有發病率高、治愈率低、死亡率高等特點,研究者對于腦膠質瘤的發病機制尚不明確,臨床上也缺乏有效的治療手段和預測預后情況的分子靶點。近年來,逆轉座子LINE-1在腫瘤發生、發展過程中的作用,引起了研究者的關注。LINE-1的異常活化會對細胞基因組產生重大影響,一方面LINE-1的插入可能會引發癌基因的激活,抑癌基因的失活,成為腫瘤發生的重要誘因[12],另一方面,LINE-1活化會增加細胞內逆轉錄酶ORF2p的表達水平,造成microRNA調控網絡的紊亂,破壞細胞基因組穩定性,引發各類疾病,而基因組不穩定也是腫瘤細胞的一個重要特征[13]。近年來研究者在多種腫瘤組織均檢測到了LINE-1異常活化的證據,例如腎癌、卵巢癌、肺癌和前列腺癌等,這種LINE-1的異常活化通常預示著較差的預后和較深的癌變程度[14,15]。本文中,我們檢測了腦膠質瘤癌組織和癌旁組織中LINE-1編碼的ORF1的表達情況,結果表明膠質瘤組織中LINE-1的活化程度顯著高于癌旁組織,說明逆轉座子LINE-1在膠質瘤中同樣存在者異常激活,LINE-1的活化很可能破壞細胞基因組穩定性,進而促進了腫瘤細胞的發生、發展。
在確定了膠質瘤組織中存在LINE-1異常活化之后,我們進一步分析了LINE-1的高表達與膠質瘤病理特征及預后情況的關聯,在WHO分級為Ⅲ-Ⅳ級的膠質瘤中,LINE-1的表達水平明顯高于Ⅲ-Ⅳ級的膠質瘤;在Ki-67高表達的膠質瘤組織,LINE-1 ORF1同樣也有著更高的表達,高的分級通常反應了病灶浸潤程度,Ki-67代表腫瘤細胞的活力,這些數據都說明LINE-1的活化程度與病理特征的惡化程度直接相關,上述結論與其他研究者在肺癌、白血病等其他腫瘤中的發現類似。通過對患者的預后隨訪,我們繪制了腦膠質瘤患者的生存曲線,結果表明:LINE-1高表達的患者生存率顯著低于LINE-1低表達的患者,這說明LINE-1的異常表達與患者的不良預后相關。考慮到本文選取的樣本數量有限,仍需要更多數據論證LINE-1能否成為腦膠質瘤不良預后的分子標志物。
綜上所述,逆轉座子LINE-1在腦膠質瘤組織中存在異常表達,逆轉座子的活化與膠質瘤的病理分級顯著相關,同時也是腦膠質瘤患者不良預后的一個顯著標志。LINE-1有潛力成為腦膠質瘤診斷、治療的新靶點。

