神經膠質細胞轉化的神經元或可治療帕金森病
此類基因療法的簡便性和高效率使其極具潛力,有望治療像帕金森病這樣的神經系統疾病。

近期,來自加州大學圣地亞哥分校的付向東團隊在《自然》(Nature)發表文章表示,通過消解特定蛋白質,可使星形膠質細胞向神經元細胞轉變,從而逆轉帕金森病小鼠的病例癥狀。而在更早些時候,來自中國科學院楊輝團隊也以相似的思路完成了神經元轉變,并將研究成果發表于《細胞》(Cell)。毫無疑問,這兩大重磅研究為人類攻克帕金森病開辟了全新的道路。
帕金森病模型小鼠的實驗
皮膚細胞和星形膠質細胞可以通過強制表達(或過表達)轉錄因子、microRNA或小分子等方法在體外轉化為其他類型的細胞,能誘導產生多巴胺的神經元(iDA神經元)便是其中一種細胞類型。目前已有科學家使用這種方法成功將小鼠大腦紋狀體中的星形膠質細胞轉化為了iDA神經元:這些小鼠身患帕金森病,同人類患者一樣,中腦黑質里的iDA神經元都已變性死亡(該病最主要的病理特征);但經過實驗,它們失而復得,小鼠的運動缺陷也因此得到了改善。
不過靠此方法得來的iDA神經元既無法形成健康大腦里應有的遠距離神經元聯結,也難以使患病小鼠的運動行為完全恢復正常。付向東團隊選擇了另一種策略,有效地將星形膠質細胞重編程為神經元,帕金森病小鼠的病情恢復也相對更為徹底。
該研究團隊一開始對分離自小鼠大腦皮層和中腦以及人類皮質中的星形膠質細胞進行了體外實驗。他們的目標是除掉星形膠質細胞里的PTB蛋白,以此促進星形膠質細胞轉變為iDA神經元——PTB是一種具有剪接作用的多聚嘧啶序列結合蛋白,存在于星形膠質細胞當中,它的表達會抑制神經元分化。付向東等人此前已證實PTB蛋白越少,細胞越容易變成神經元。
他們采用的方法是破壞編碼PTB蛋白的Ptbp1基因的轉錄過程。具體操作就是使用一種小發夾結構RNA(shRNA)降解掉那段能指導PTB蛋白合成的信使RNA。如此一來,數量多、易增殖,且具有高度可塑性的星形膠質細胞便可以最大限度地向iDA神經元轉化,結果也確實如他們所愿。
值得一提的是,楊輝團隊借助基因組編輯技術CRISPR-CasRx切掉了小鼠星形膠質細胞中Ptbp1基因的mRNA,也達到了相同的目標。(用具備CRISPR-CasRx能力的病毒感染小鼠的星形膠質細胞。)
體外成功之后就是體內實驗。付向東團隊使實驗小鼠大腦中的星形膠質細胞可以被專吃Ptbp1基因的shRNA病毒靶向。shRNA病毒一來,PTB蛋白自然就銷聲匿跡了。最后的實驗結果為:小鼠注射病毒后,20%的星形膠質細胞很快就轉變為神經元;10周后,這個數字升高至80%;最喜人的是注射12周后,30%~35%的星形膠質細胞成為多種類型的iDA神經元。
iDA轉化依托于多種轉錄因子
通過除掉PTB的方式讓星形膠質細胞發生轉化,轉化而來的細胞類型很大程度由其所處腦區決定,例如,在紋狀體中,iDA神經元即是轉化終點。那么這種特異性從何而來呢?
付向東等人發現中腦星形膠質細胞會表達低水平的轉錄因子Lmx1a和Foxa2;中腦發育過程中,它倆在釋放多巴胺的神經元的祖細胞中表達,也是這些祖細胞向神經元發展必不可少的要素。 PTB的離去進一步加強了Lmx1a和Foxa2的表達,像Ctip2和Cux這類與皮質神經元相關的轉錄因子的表達水平也隨著升高。
此外,對黑質或鄰近腹側被蓋區(VTA)中的星形膠質細胞進行重編程,產生了iDA神經元的不同亞型:黑質中的Sox6和Aldh1a1,以及VTA中的Otx2。
付向東和同事們的研究結果表明,腦區域特定的轉錄因子有助于星形膠質細胞向iDA神經元的轉化。但楊輝團隊的細胞轉變是在紋狀體里實現的,紋狀體的星形膠質細胞不同于黑質及VTA,不會表達Lmx1a和Foxa2這些因子,自然沒法用付團隊發現的機制來解釋。
那么紋狀體中導致iDA轉換的機制可能是什么呢?
楊輝團隊發現接受治療1個月后的帕金森病小鼠,iDA轉換效率差不多提高了2倍。他們提出:在面對內源性的多巴胺神經元缺失時,星形膠質細胞本身或周圍環境中的細胞,會表達一些促進星形膠質細胞向iDA神經元轉化的因子。換言之,黑質及VTA本身就會表達Lmx1a和Foxa2這些促使iDA轉化的因子,在PTB缺失的情況,這種表達還會加強,所以付向東的實驗結果水到渠成;而紋狀體雖然原本不表達Lmx1a或Foxa2,但在多巴胺神經元缺失的情況下,會啟動另一套轉錄因子分泌程序,這些因子同樣可以推進星形膠質細胞向iDA神經元轉變,因此楊輝等人也得到了差不多的實驗結果。
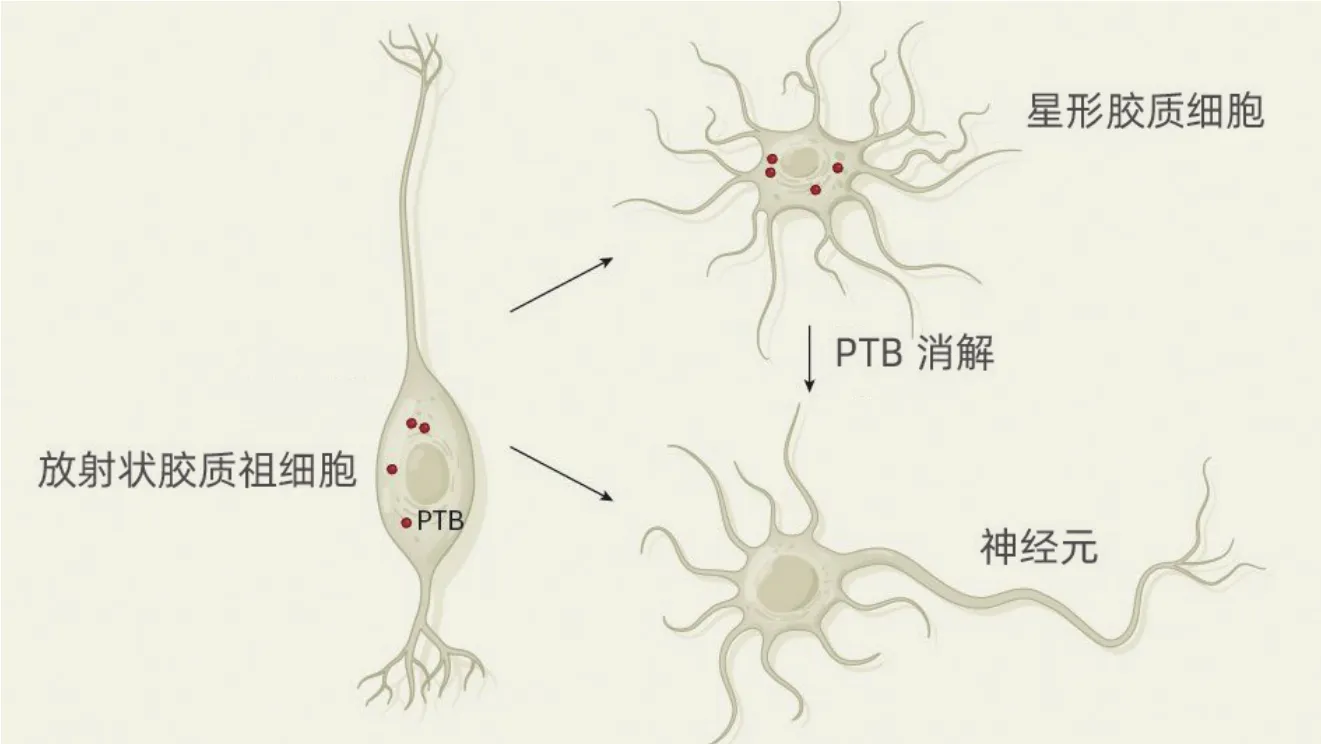
星形膠質細胞向神經元轉化的路徑。放射狀膠質祖細胞是干細胞樣細胞,在發育的小鼠中腦里表達著編碼PTB蛋白的信使RNA。它們可產生神經元,也可分化出星形膠質細胞這樣的非神經元細胞,但星形膠質細胞只有在沒了PTB之后才能轉化為神經元
分化有先后,PTB有專攻
這些研究引出了一個有趣的問題,那就是為什么星形膠質細胞會不斷抑制神經元的基因表達。一種解釋指向細胞的發育起源:星形膠質細胞和神經元有共同的祖先——放射狀膠質祖細胞,這是一種干細胞樣細胞,能夠先產生神經元,然后又分化出星形膠質細胞和其他支持神經元的神經膠質細胞。
在處于發育過程的小鼠中腦里,所有放射狀膠質細胞類型都可以正常表達Ptbp1基因,而走在分化之路上的神經元前體細胞,和已經分化完成的神經元,則不再表達Ptbp1。其中原因可能在于星形膠質細胞作為放射狀神經膠質細胞的后代,已經承繼了一套讓已有神經元安然休眠的程序——除非PTB消失,休眠才可解除。
另外,Ptbp1基因也會在其他類型的中腦細胞里表達,這些細胞包括血管中的內皮細胞和周細胞,心室腔內的室管膜細胞,以及小膠質細胞(一種免疫細胞)。接下來的研究應重點關注在其他種類的帕金森病動物模型中,PTB的消解是否也能同樣帶來iDA神經元的轉化。
付向東和楊輝等人的策略要在臨床上發揮作用,可能需要先提高效率。比方說,注射shRNA的星形膠質細胞最終有60%~65%是不會成為iDA神經元的。若想提高效率,研究者必須讓shRNA病毒更集中地靶向黑質里的星形膠質細胞,或再引入某些因子,使得其他非黑質星形膠質細胞也可以轉化為iDA神經元。
付向東等人在新發表研究的最后一組實驗中,探索了一種實現臨床應用的方法:一種稱為反義寡核苷酸的短核酸,能與mRNA結合并阻止其翻譯出蛋白質。借助該反義寡核苷酸破壞PTB的表達過程或許可以有效實現iDA樣神經元的轉化。他們最后也確實通過此方法,恢復了帕金森病小鼠的運動行為。
未來的實驗將研究人類中腦或紋狀體的星形膠質細胞是否也可以轉化為iDA神經元,以及轉化后的神經元細胞是否可以保持長期穩定,能否精確誘導多巴胺分泌。另外,消解PTB是否有安全隱患,以及怎樣制定出一套完善的治療策略以避免各種健康風險(如星形膠質細胞數量減少的后果),也同樣需要研究者花大工夫去琢磨。
總而言之,許多問題等待解決,但此類基因療法的簡便性和高效率,使其極具潛力,有望為治療像帕金森病這樣的神經系統疾病開辟新的篇章。
資料來源 Nature

