PAX8 在卵巢癌中的表達及臨床意義
徐穎,傅芬
(1 江西省上饒市第二人民醫院,江西 上饒;2 南昌大學第二附屬醫院,江西 南昌)
0 引言
卵巢癌是發生在卵巢的惡性腫瘤疾病,其病理類型復雜,其中85% -90%為卵巢上皮性腫瘤[1,2],主要以卵巢漿液性癌最常見。由于卵巢解剖位置隱蔽,卵巢癌早期病變不易發現,而目前又缺乏卵巢癌普查和早期診斷的有效措施,導致多數患者就診時已達晚期[3],治療效果和預后很差,致使卵巢癌的5 年存活率僅為40% -50%,死亡率居婦科惡性腫瘤之首[4]。近年來越來越多的研究發現轉錄因子與腫瘤的發生密切相關,因其具有調控基因轉錄、調控細胞周期和促進發病機制的功能,在腫瘤發生發展過程中起著重要作用[5]。PAX8(paired-box 8) 是類非常保守的轉錄因子,特異性表達在甲狀腺、腎導管組織、副中腎管組織及其腫瘤中[6-8]。女性生殖系統起源于胚胎副中腎管,近年來有研究發現PAX8 是上皮性卵巢癌重要的標志物[9,10]。本文利用GEO 和TCGA 公共數據庫重點研究PAX8 在卵巢癌中的表達情況,分析PAX8 與卵巢癌臨床病理特征和患者預后的關系,結果報道如下。
1 材料與方法
1.1 數據源
本研究從GEO(https://www.geogroup.com)下載卵巢癌基因表達譜數據集,通過cBioPortal(http://www.cbioportal.org/) 下載TCGA 卵巢癌臨床樣本的基因組數據,通過GTEx(https//www.gtexportal.org/) 數據庫下載正常卵巢樣本,從TCGA 數據庫中下載卵巢癌患者的臨床病理特征數據和表達值數據,從KM-plot 數據庫(http://kmplot.com/analysis/)下載GEO 數據集合中患者的生存和預后信息。
1.2 方法
本研究在GEO 數據庫搜索關鍵詞:Ovarian cancer,限 制Organism 為Homo sapiens, 限 制Study type 為Expression profiling by array。 納 入 標 準:(1)數 據 集為全基因組的表達mRNA 芯片數據;(2)芯片平臺包括[HG-U133_Plus_2] Affymetrix Human Genome U133 Plus 2.0 Array,[HT_HG-U133A] Affymetrix HT Human Genome U133A Array, [HG-U133A_2] Affymetrix Human Genome U133A 2.0 Array,[HG-U133A] Affymetrix Human Genome U133A Array;(3)臨床樣本為卵巢癌組織和非卵巢癌組織(包括正常組織、非癌組織和癌旁組織);(4)原始數據集為GEO。經過條件檢索篩選出7 個表達譜數據集(GSE6008,GSE26712,GSE27651,GSE2945 0,GSE36668,GSE18520 和GSE52037),統一用RMA 算法對7 個數據集進行預處理,借助R 語言,利用Rstudio軟件(1.0.136 版本)和R 軟件(3.2.3 版本)對基因表達譜進行Meta 分析。下載TCGA 卵巢癌臨床樣本的基因組數據(截止日期為2017 年10 月), 選取的數據集為Ovarian Serous Cystadenocarcinoma。采用均數作為Kaplan-Meier 曲線分析以及Cox 回歸分析模型中的截斷值。繪制Kaplan-Meier 生存曲線,采用對數秩檢驗來檢驗表達不同的兩組生存與基因表達有無統計學意義。
1.3 統計學分析
利用R 軟件(3.2.3 版本)對基因表達譜進行統計學分析,通過SPSS22.0 的χ2檢驗對基因表達水平與患者臨床病理特征進行統計學分析,生存分析采用Kaplan-Meier 法結合對數秩檢驗,當P<0.05 認為差異有統計學意義。
2 結果
2.1 PAX8 在卵巢癌中的表達水平
從7 個表達譜數據集中收集到450 個樣本(396 個病例和54 個對照),篩查到PAX8 所對應探針(221990-at)在所有7 個研究中與對照組比較均顯著上調(P<0.01,表1)。
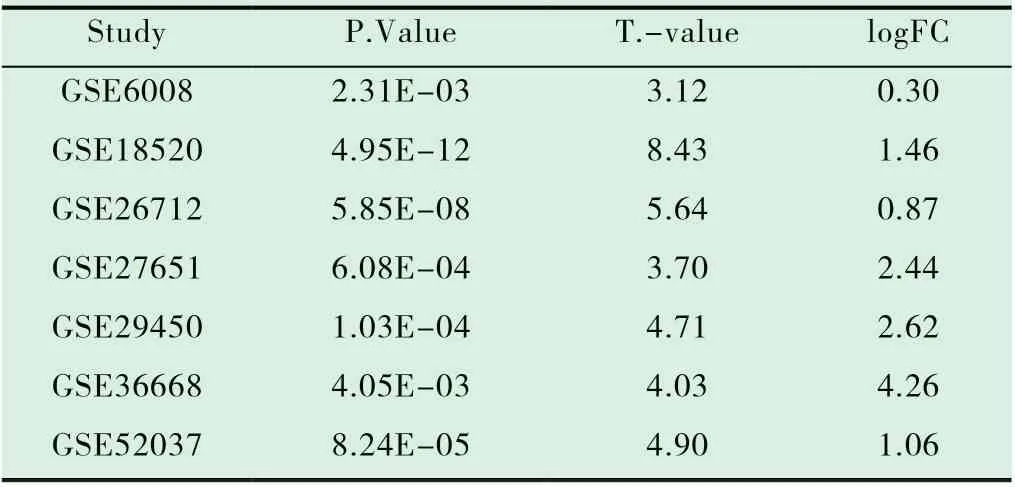
表1 PAX8 所對應探針(221990-at)的差異表達情況
從7 個數據集得到的13,294 個基因的表達矩陣進行Meta 分析,將GEO 數據集中Meta 分析的Z 值與P值進行散點圖(圖1)比對,可以看出有明顯的線性關系,即兩種Meta 分析有明顯的一致性。PAX8 所對應探針(221990-at)與對照組比較,顯著表達量顯著上調(Z=10.526,P=6.53E-26)。
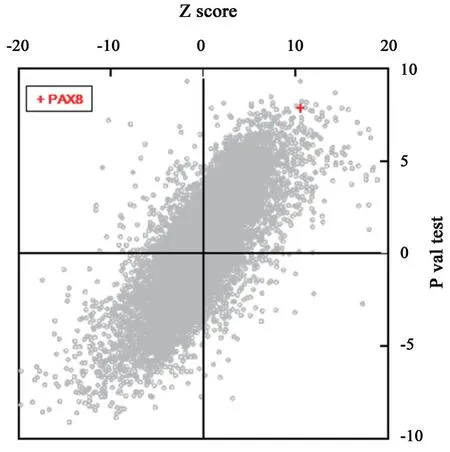
圖1 7 個卵巢癌數據集中組織和癌旁組織表達差導的Meta 分析總結
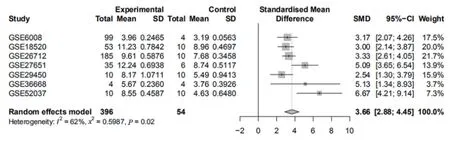
圖2 PAX8 在癌癥組織和癌旁組織表達差異的Meta 分析的森林圖
通過計算效應尺度加權均數差及其95%CI 繪制出Meta分析的森林圖(圖2)證實,PAX8 在多個研究中高表達穩定,無異質性(SMD =3.66,95%CI =2.88-4.45,P=0.02)。
為了驗證以上結構,本研究獲取截止2017 年10月TCGA 數據庫中卵巢癌臨床樣本的基因組數據,該數據包含了426 例卵巢癌臨床樣本,并通過GTEx 數據庫下載88 例正常卵巢樣本,進行表達差異分析。與正常卵巢組織相比,PAX8 表達在卵巢癌組織中的確上調(P=1.55E-104)。
同時,通過對31 種腫瘤(包括9498 個病例和5540個對照)的分析顯示,PAX8 在大多數腫瘤的癌組織中均低表達,僅在CHOL、OV、PAAD、STAD、UCEC 和UCS中高表達,提示該基因在卵巢癌中發揮特異性調控作用。
2.2 PAX8 過表達對卵巢癌臨床表型的影響
從TCGA 網站下載415 例卵巢癌表達譜及臨床信息,分析探討了PAX8 表達水平與卵巢癌臨床病理因素的相關性,PAX8 高表達與患者腫瘤TNM 分期、腫瘤組織學分級無關(P>0.05),而與患者的年齡有關(P<0.01,表2)。
基于GEO 數據集中患者的生存和預后信息的生存分析(圖3),PAX8高表達確實與卵巢癌生存預后相關(P=0.0035,圖3-B),高水平的PAX8 的患者生存能力好;且高水平的PAX8 的患者無病生存期也延長,提示PAX8 與好的生存預后顯著相關。以上兩個結果提示,PAX8 很可能作為腫瘤良好生存預后的預測因子,在卵巢癌的發生過程中可能具有重要作用,可能作為卵巢癌發生過程中潛在的預測靶點。
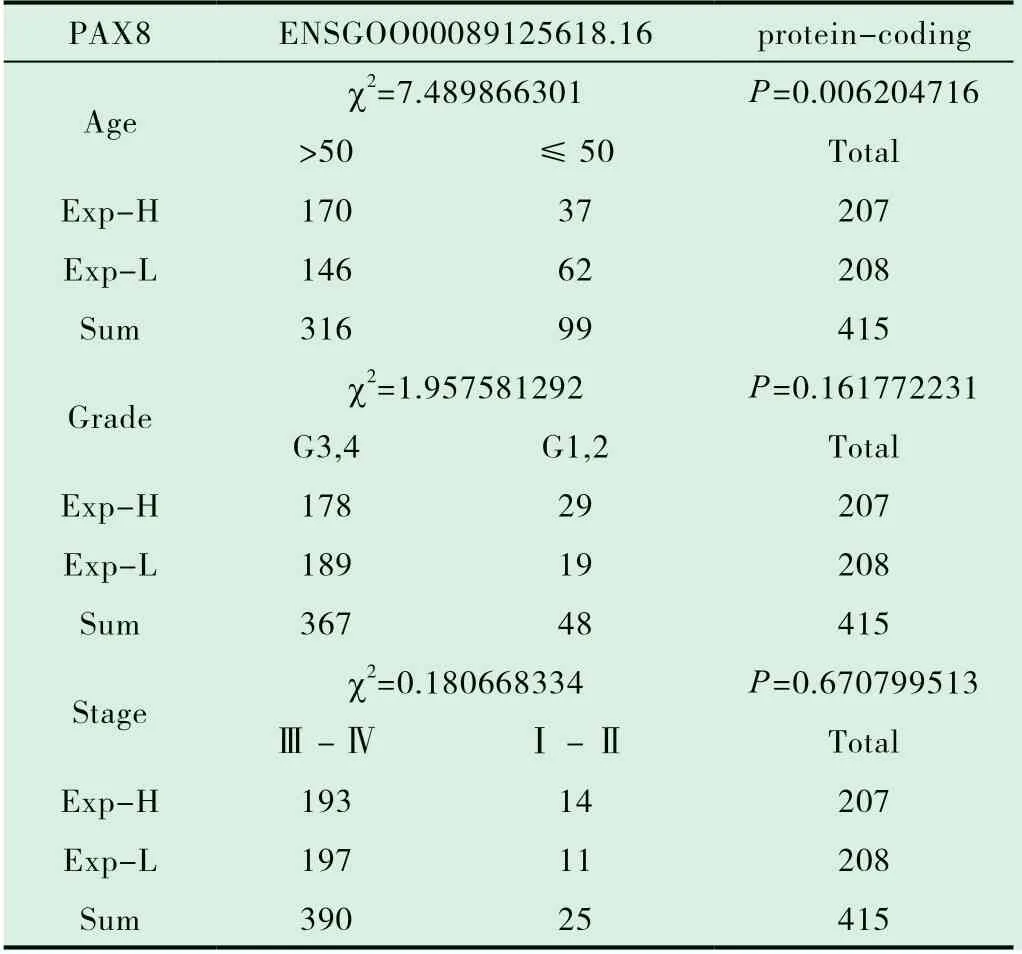
表2 PAX8 表達水平與患者年齡、腫瘤組織學分級、腫瘤TNM分期的相關性
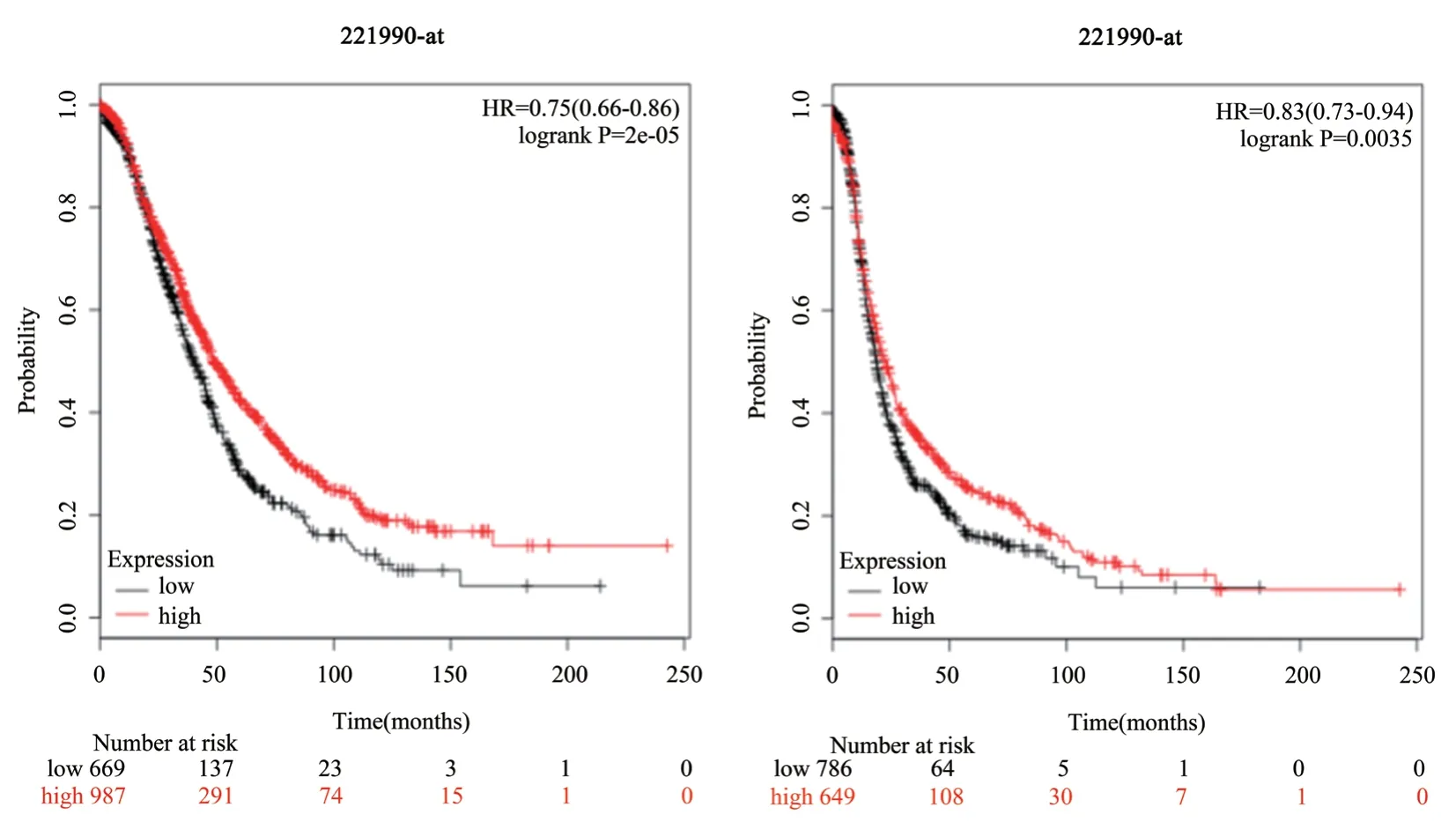
圖3 PAX8 表達在卵巢癌中的生存分析 A)基于總生存時間的分析;B)基于無病生存期的分析
3 討論
PAX(paired box)因子是類非常保守的轉錄因子,由配對域、八肽域和同源域三個結構域構成,配對域是PAX 蛋白與DNA 結合的主要功能域,八肽域則行使轉錄抑制調節作用[11]。PAX 因子具有調節多個基因轉錄的功能,在機體的生長發育過程中對組織、器官的分化起著重要的調控作用。PAX 因子的異常表達會導致多種器官發育畸形和惡性腫瘤的發生,例如脊柱畸形[12]、眼球缺損或白內障[13]、腎細胞癌[14]、甲狀腺癌等。PAX8 是PAX 基因家族的一個成員,有研究報導PAX8 與泌尿生殖系統的發育密切相關[15,16],PAX8 突變體導致甲狀腺良、惡性腫瘤的形成[17],但是目前PAX8 突變導致腫瘤形成的分子機制尚不明確。
本研究利用GEO 和TCGA 數據庫分析卵巢癌中PAX8 表達情況。從GEO 數據庫篩選出7 個符合標準的表達譜數據集進行Meta 分析,結果顯示PAX8 在卵巢癌組織中的表達普遍高于癌旁組織。從TCGA 數據庫篩選出426 例卵巢癌臨床樣本進行表達差異分析,同時通過對31 種腫瘤組織和正常組織的表達差異分析,均提示PAX8 在卵巢癌組織中高表達,PAX8 的過表達是卵巢癌的特異,和其他學者的研究結論一致。從TCGA 數據庫下載415 例卵巢癌表達譜及臨床病理特征數據,同時下載GEO 數據集合中患者的生存和預后信息,結果顯示PAX8 高表達與腫瘤TNM 分期、腫瘤組織學分級無關,而與患者的年齡有關,高表達的PAX8 的患者生存能力好,且高表達的PAX8 的患者無病生存期也延長,PAX8 高表達與腫瘤的不良預后呈負相關,提示PAX8 很可能作為腫瘤良好生存預后的預測因子。
綜上所述,PAX8 表達于卵巢癌具有較高的特異性和敏感性,可作為卵巢癌的潛在預測靶點。卵巢癌中PAX8的表達與腫瘤TNM 分期、腫瘤組織學分級無關,而與患者年齡有關,PAX8 高表達的卵巢癌患者預后較好。

