枯草芽孢桿菌S6抗棉花枯萎病菌拮抗蛋白的分離純化與抑菌活性研究
李麗 程煜 袁建琴

摘 ? ?要:為了探尋枯草芽孢桿菌S6菌中對棉花枯萎病菌有拮抗作用的蛋白,將S6菌進行液體發酵培養,初步提取得到了粗蛋白提取液。粗提液經硫酸銨沉淀、Sephadex G-50脫鹽、Sephadex G-100凝膠層析、DEAE-52纖維素離子交換層析,得到了對棉花枯萎病菌有高效拮抗作用的蛋白質,純化倍數達17。形成分離純化S6菌株的棉花枯萎病菌拮抗蛋白的可靠技術路線,為研究和生產防治棉花枯萎病菌的生物制劑提供了理論基礎。
關鍵詞:棉花枯萎病;拮抗蛋白;分離純化;芽孢桿菌
中圖分類號:S476 ? ? ? ? ? ?文獻標識碼:A ? ? ? ? DOI 編碼:10.3969/j.issn.1006-6500.2020.06.002
Abstract: In order to study the protein of the bacterial strain (S6) which was identified as bacillus could antagonistic against cotton fusarium wilts efficiently, S6 bacteria was cultured by liquid fermentation, and crude protein extract was obtained by preliminary extraction. The crude extract was purified by ammonium sulfate precipitation, Sephadex G-50 desalting, Sephadex G-100 gel chromatography, DEAE-52 cellulose ion exchange chromatography, the protein with high antagonistic effect on cotton fusarium wilt was obtained, and the purification multiple reached 17 times. The reliable technical route for separating and purifying cotton fusarium wilt antagonistic protein of S6 strain was formed,which provided a theoretical basis for the research and production of biological agents for controlling cotton fusarium wilt.
Key words: cotton fusarium wilt; antagonistic protein; isolation and purification; bacillus
棉花枯萎病菌由尖孢鐮刀菌萎蔫專化型(Fusarium oxysporum f.sp.vasinfectum)引起,它們使棉花萎蔫致死,且極難防治,造成的經濟損失也最慘重[1-3]。抗病育種由于高抗種質資源缺乏,育種方法單一等原因,致使育種工作進展緩慢[2];化學藥劑防治效果差,還會加重環境污染,可形成抗逆性很強的微菌核[4]。因此,開辟新的防病措施已成為當務之急,而生物防治以其無毒無害等優點給棉花枯萎病的防治帶來了新的希望[5]。枯萎病生防細菌中比較有前途的種類是嗜麥芽糖寡養單胞菌(Stenotrophomonas maltophila)[6]、枯草芽孢桿菌(Bacillus subtilis)[7-9]、熒光假單胞桿菌(Pseudomonas fluorescens)[10]等。抗菌蛋白的分離提取和研究,是以不同分離提純技術的組合形成的分離方案為基礎的。現行的蛋白分離技術主要有以下幾種:硫酸銨沉淀法、凝膠色譜法、離子交換層析法、SDS-PAGE法、高效液相色譜法等。
本研究利用傳統研究技術與現代微生物技術結合從土壤中篩選到有自主知識產權的高效拮抗菌株枯草芽孢桿菌S6菌,采用分子生物學手段分離純化對棉花枯萎病菌有拮抗作用的蛋白質,目的是形成分離純化該蛋白的技術路線,為其應用于微生物農藥,有效防治枯萎病提供理論依據和應用基礎。
1 材料和方法
1.1 試驗材料
1.1.1 菌株 尖孢鐮刀菌(F. oxysporum) ,由中國農科院簡桂良教授惠贈;枯草芽孢桿菌(B.subtilis)S6由中國農業科學院研究生院生物化學與分子生物學實驗室自主篩選,從湖南、廣西、北京等地采集辣椒、黃瓜、煙草等根際周圍土樣中自主篩選。
1.1.2 培養基[11] LB(Luria-Bertani)培養基:培養S6菌;PDA(Potato Dextrose Agar)培養基:培養棉花枯萎病菌株,測定抗菌活性。
1.2 試驗方法
1.2.1 S6菌的活化與指標平板的制作 S6菌用劃線法涂布于LB培養基活化,培養過夜,挑取單菌落劃平板,再次活化,放入4 ℃冰箱備用。挑取枯萎病菌單菌落,用劃線分別法接種于PDA固體培養基,培養24 h,挑取枯萎病菌接于PDA液體培養基,28 ℃以200 r·min-1在搖床培養24 h,用紗布過濾后,取含孢子的培養液稀釋0.5 mL,均勻涂布于剛凝固的PDA固體培養基,于28 ℃恒溫培養箱中培養過夜,然后放入4 ℃冰箱備用。
1.2.2 粗蛋白的提取、分級沉淀與拮抗活性驗證[12]將S6菌接種于LB液體培養基中,28 ℃搖床培養36 h。收集發酵液分裝于200 mL離心管8 000 r·min-1離心10 min去除菌體,取上清即為蛋白粗提液。粗提液中緩慢加入粉末狀硫酸銨使其飽和度達40%,于4 ?℃冰箱中靜置30 min,后10 000 r·min-1離心15 min,分離上清液,沉淀溶于5 mL 0.05 mol·L-1、pH 值7.2的磷酸緩沖液中,即為40%硫酸銨沉淀蛋白粗提液。取上一步離心后的上清液,加入硫酸銨使飽和度達到70%,按同樣方法處理,即得到70%硫酸銨沉淀蛋白粗提液。用同樣方法處理,即可得到100%硫酸銨沉淀蛋白粗提液。接不同濃度的硫酸銨沉淀蛋白粗提液于PDA平板,在PDA平板上將枯萎病菌接種于平板中央,28 ℃培養24 h在菌絲周圍打孔,將待測的活性物質注入孔內,每孔約200 μL,28 ℃下再培養,觀察抑菌狀況及抑菌圈大小,重復3次。蛋白活性(mm2·mg-1)=抑菌圈面積/蛋白含量[13-14]。1.2.3 拮抗蛋白的純化 (1)Sephadex G-50除鹽。將預處理過的Sephadex G-50用0.05 mol·L-1的磷酸緩沖液(pH值 7.2)平衡后裝柱(26 mm×300 mm),上樣量6 mL,再用同樣磷酸緩沖液洗脫,流速為50 mL·h-1,洗脫液分部收集,繪制洗脫曲線。收集洗脫峰,用鈉氏試劑檢測無鹽,裝入透析袋中用聚乙二醇6 000濃縮至6 mL左右。
(2)Sephadex G-100分離蛋白。將預處理過的Sephadex G-100用同樣的磷酸緩沖液平衡后裝柱,上樣量6 mL,用同樣的磷酸緩沖液洗脫,流速為50 mL·h-1,洗脫液分部收集,繪制洗脫曲線。用鈉氏試劑檢測各洗脫峰為無鹽,分別裝入透析袋中用聚乙二醇6 000濃縮至5 mL左右。
(3)DEAE-52纖維素純化蛋白。將經過凝膠過濾的經平板檢驗有活性的蛋白液加入離子交換柱,用含0.1~0.6 mol·L-1 NaCl的0.05 mol·L-1 pH值為7.2的磷酸緩沖液進行梯度洗脫,流速為50 mL·h-1,洗脫液分部收集,繪制洗脫曲線。用鈉氏試劑檢測各洗脫峰為無鹽,分別裝入透析袋中用聚乙二醇6 000濃縮至5 mL左右。
(4)用平板打孔法測定各合并管拮抗活性,保留具有拮抗活性的峰管。留存250 μL樣品作為試驗對照。
2 結果與分析
2.1 分級沉淀粗蛋白的拮抗活性對比
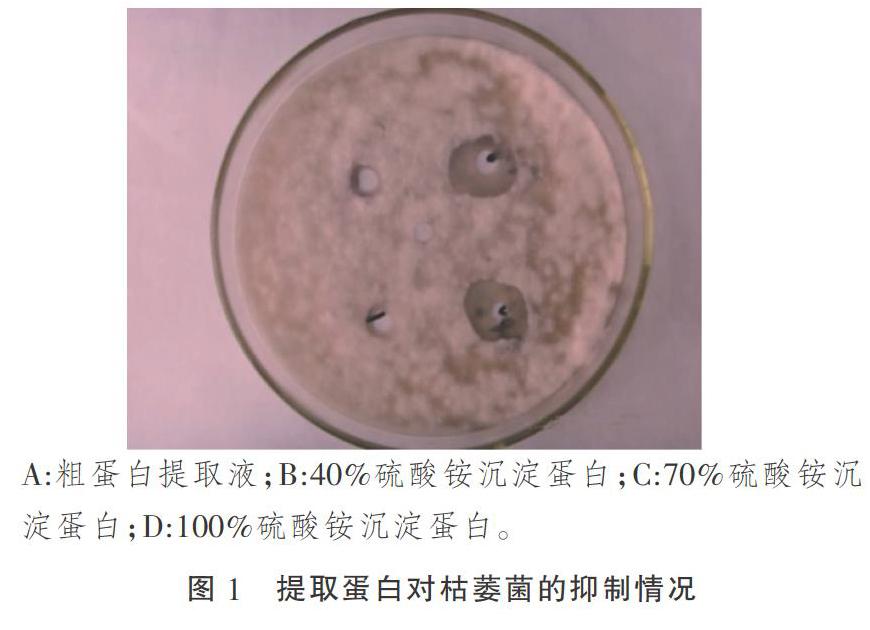
對粗蛋白進行分級沉淀,粗蛋白液、40%沉淀蛋白、70%沉淀蛋白、100%沉淀蛋白質量濃度分別為12.65,51.12,26.25,8.83 g·L-1。把它們分別接于棉花枯萎病菌指示平板中,對照為pH值為7.2的0.05 mol·L-1的磷酸緩沖液,觀察抑菌情況(圖1)。
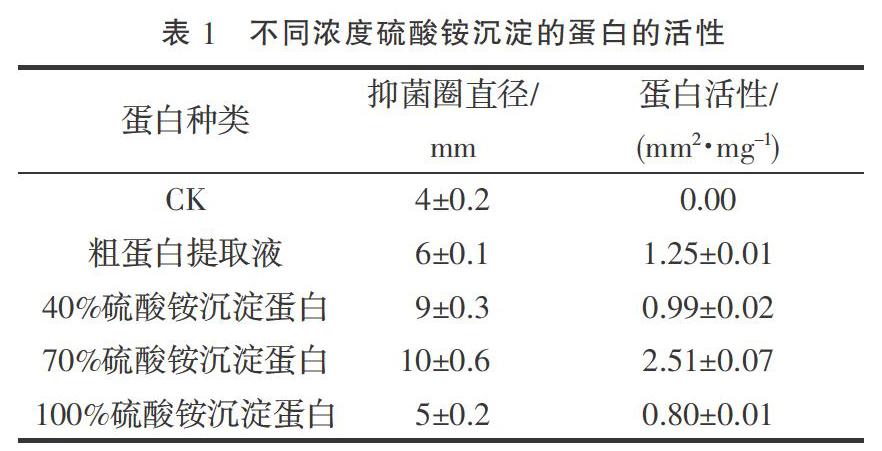
根據抑菌結果,分別測定了抑菌圈直徑并計算了各抑菌圈的蛋白活性(表1)。結果顯示:粗蛋白提取液以及3種鹽析蛋白均有抑菌活性,100%硫酸銨沉淀蛋白的棉花枯萎病菌的抑菌圈最小,蛋白活性最弱;70%硫酸銨沉淀蛋白作用的棉花枯萎病菌的抑菌圈最大,蛋白活性也最強;40%硫酸銨沉淀蛋白的棉花枯萎病菌有較好抑制作用,但不如70%硫酸銨沉淀蛋白作用明顯。由此可知,70%硫酸銨沉淀蛋白粗提液抑制效果最佳,可作為下一步研究對象。
2.2 Sephadex G-50除鹽
選經70%硫酸銨鹽析的S6菌的蛋白,經Sephadex G-50層析脫鹽,280 nm檢測,得到1個峰形陡的蛋白峰(圖2)。
2.3 Sephadex G-100分離蛋白并檢測活性
脫鹽后的蛋白再用Sephadex G-100分離純化,得到2個峰(圖3),收集體積分別為12 mL和60 mL,濃縮為5 mL左右,峰一蛋白的質量濃度1.01 g·L-1、峰二蛋白的質量濃度3.21 g·L-1。用打孔法檢測拮抗性,觀察抑菌情況(圖4)。
根據抑菌結果,分別測定了抑菌圈直徑并計算了各抑菌圈的蛋白活性(表2)。
由圖4與表2可知,G-100純化后的峰一蛋白與峰二蛋白對棉花枯萎病菌有拮抗活性,但峰二蛋白的抑制現象更為明顯,蛋白活性提高到11.74 mm2·mg-1,可作為進一步純化對象。
2.4 DEAE-52纖維素純化蛋白并檢測活性
用DEAE-52纖維素分離純化經Sephadex G-100分離后的峰二蛋白,得到2個洗脫峰,其洗脫體積分別為36 mL、20 mL,用PEG 6 000濃縮至5 mL,蛋白質量濃度分別為1.20 g·L-1、0.81 g·L-1。
用打孔法檢測拮抗性,觀察抑菌情況(圖5)。根據抑菌結果,分別測定了抑菌圈直徑并計算了各抑菌圈的蛋白活性(表3)。
經DEAE純化后峰一蛋白對棉花枯萎菌拮抗作用較強,蛋白活性提高到了21.58 mm2·mg-1。由此可知,初步得到了棉花枯萎病菌的拮抗蛋白(圖5、表3)。
2.5 純化效率
為了了解純化效率,計算了每一步的純化倍數(表4)。
從S6菌產生的粗蛋白對枯萎菌的蛋白活性為1.25,而經過硫酸銨分段沉淀、G100、DEAE分離純化后蛋白活性提高到了21.58 mm2·mg-1。純化倍數達到了17倍。說明我們經過一系列的分離純化得到了較純的對棉花枯萎菌有拮抗活性的蛋白,也說明我們的設計方案是可行的。該方案可用于拮抗枯萎菌蛋白的分離純化(表4)。
3 結論與討論
隨著對生態環境保護意識的提高,可以大規模生產的無毒、不破壞環境、已經成為防治棉花枯萎病菌等病蟲害的主要方法之一。齊東梅等[15]從土貝母和臘腸等中藥和發酵食品中篩選出對棉花枯萎病菌有廣譜拮抗作用的芽孢桿菌29株,經初步鑒定為枯草芽孢桿菌和地衣芽孢桿菌。孫瑤等[16]從根際土壤中分離到對棉花枯萎病菌具有強烈拮抗細菌BDT-25,經生理生化特征的鑒定證明為枯草芽孢桿菌(Bacillus subtilis)。李術娜等[17]從棉花葉部組織中分離出LC-04菌株,實驗證明菌株發酵液中含有對大麗輪枝菌有拮抗活性的蛋白質類抗菌物質,經鑒定也是一株類芽孢桿菌。郝華昆等[18]分離得到對棉花枯萎病原真菌具有強烈抑制作用的菌株B110,經鑒定也為枯草芽孢桿菌(Bacillus subtilis)。本研究采用從湖南、廣西、北京等地采集的辣椒、黃瓜、煙草等根際周圍土樣中自主篩選的對枯萎病菌都有一定拮抗作用的S6菌,經過檢測確定為芽孢桿菌。由此可知,芽孢桿菌普遍對枯萎病菌有一定的拮抗作用。
杜紅方[19]通過硫酸銨的分級沉淀、DEAE-Sephadex A-50與Sepharyl S-100,從LC105菌株的發酵液中得到了一種對棉花黃萎病菌具有拮抗作用的抗菌蛋白。胡明[20]確定硫酸銨分級沉淀在40%~60%范圍內,經過DEAE弱陰離子交換柱,并采用pH值 6.0的MES樣品緩沖液,用0~l mol·L-1的NaCI線性洗脫。再采用Sephacryl S-100凝膠的分子篩層析方法進行分離,經SDS-PAGE電泳檢測結果顯示獲得了一個純的蛋白組分。
本研究利用硫酸銨沉淀法初步分離了活性蛋白,而后采用凝膠層析和離子交換層析法進行分離純化,拮抗棉花枯萎病菌的蛋白活性從最初的1.25 mm2·mg-1提高到了21.58 mm2·mg-1,純化倍數達17.2倍。說明本文采取的技術方法是合理的,可以用于S6菌中棉花枯萎病菌拮抗蛋白的分離提取。但所得蛋白是否單一還不得而知,要進一步深入研究,需要采用更高級的分離技術,從而得到對棉花枯萎病菌的拮抗活性的特異蛋白。
參考文獻:
[1]石磊巖,簡桂良,孫文姬,等.我國棉花黃萎病研究現狀與方向[J].植物保護學報,1998,25(2):103-107.
[2]馬存,簡桂良,孫文姬.我國棉花抗黃萎病育種現狀、問題及對策[J].中國農業科學,1997,30(2):58-64.
[3]陳旭生,陳永萱,黃駿麒.棉花黃萎病菌鑒定技術進展[J].棉花學報,1997,9(2):64-67.
[4]WANG X,LIANG G.Control efficacy of an endophytic Bacillus amyloliquefaciens strain BZ6-1 against peanut bacterial wilt,Ralstonia solanacearum[J].BioMed research international,2014,12: 1-11.
[5]崔鄭龍,柴秀娟,孔德真,等.棉花枯萎病菌拮抗內生菌的篩選和拮抗效果檢測[J].江蘇農業科學,2016,44(2):158-163.
[6]BERG G,BALLIN G.Bacterial antagonists to verticillium dahliae kleb[J].Journal of phytopathology,1994,141:99-110.
[7]PODILE A R,PRASAD G S,DUBE H C.BACILLS SUBTILIS as antagonist vascular with pathogens[J].Current science,1985,54:864-865.
[8]SAFIYAZOV J S,SATTAROVA R K.The use of bacterial antagonist for control of cotton disease[J]. Field crops reseach,1995,43:51-54.
[9]于杰,張榮意,譚志瓊,等,枯草芽孢桿菌B25抗真菌作用及抗菌蛋白的分離純化[J].基因組學與應用生物學,2016,35(3):629-634.
[10]LEBEN S D,WADI J A.Effects of pseudomonas fluorsecens on potato plant growth and control of verticillium dahliae[J]. Phytopathology,1987,77:1592-1295.
[11]李湘民,華菊玲,宋愛芝.棉花苗期病害拮抗菌的篩選[J].江西農業學報,1994,6(2):118-121.
[12]童有仁,馬志超,陳衛良,等. 枯草芽孢桿菌B 034拮抗蛋白的分離純化及特性分析[J].微生物學報,1999,39(4):339-343.
[13]游春平,肖愛萍,魏金蓮,等,稻瘟病拮抗細菌的活性研究[J].江西農業大學學報,2002,24(1):24-26.
[14]KEL,EMU S,BADEL J L.In vitro inhibition of colletotrichum gloesporiodies and other phytopathagenic fungi by an Amazoniam isolate of bacillus and its cell-free culture filtrate Aust[J].Plant pathol,1994,23(1)41-45.
[15]齊東梅,梁啟美,惠明,等.棉花枯萎、黃萎病拮抗芽孢桿菌的抗菌蛋白特性[J].微生物學通報,2005(4):42-46.
[16]孫瑤,馬平,朱寶成,等.棉花黃萎菌拮抗菌BDT_25的鑒定及抗菌蛋白產生條件研究[J].華北農學報,2006,21(6):119-123.
[17]李術娜,杜紅方,袁洪水,等.棉花黃萎病拮抗細菌LC-04菌株的抗菌蛋白產生條件研究[J].棉花學報,2006,18(4):233-23.
[18]郝華昆,韓俊華,李為民,等.棉花黃、枯萎病拮抗菌株B110的鑒定及其抑菌作用方式[J].植物保護,2007,33(2):77-80.
[19]杜紅方.棉花黃萎病拮抗細菌的篩選與抗菌蛋白的分離純化[D].保定:河北大學,2003.
[20]胡明.棉花黃萎病抗菌蛋白的分離純化及其部分性質的研究[D].保定:河北大學,2003.

