吡格列酮對高糖誘導的大鼠腎小管上皮細胞-間充質細胞轉分化的影響及機制研究
孫蘭 張帆 石明雋 田平平 郭兵

摘 要 目的:探討吡格列酮(PIO)對高糖誘導的大鼠腎小管上皮細胞-間充質細胞轉分化(EMT)的影響及可能機制,為防治糖尿病腎病提供理論依據及新靶點。方法:將大鼠腎小管細胞NRK-52E隨機分為對照組(5.5 mmol/L葡萄糖)、高糖組(30 mmol/L葡萄糖)、PIO干預組(30 mmol/L葡萄糖+5.0 μmol/L PIO)、GW9662干預組(30 mmol/L葡萄糖+5.0 μmol/L PIO+5.0 μmol/L特異性拮抗劑GW9662)。前3組細胞分別在培養6、12、24、48 h時進行動態檢測,GW9662干預組細胞在培養48 h時進行檢測。采用Real- time PCR法檢測細胞中第10號染色體缺失的磷酸酶和張力蛋白同源基因(PTEN)、過氧化物酶體增殖物激活受體γ(PPARγ)mRNA的表達水平;采用Western blotting法檢測細胞中PTEN、PPARγ、α-平滑肌肌動蛋白(α-SMA)、上皮鈣黏素(E-cadherin)的表達以及磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)信號通路的變化。結果:隨培養時間的延長,與正常組比較,高糖組細胞中PPARγ、PTEN mRNA及蛋白(除PPARγ 6 h外)表達水平均顯著降低,α-SMA、p-AKT(Thr308)蛋白表達水平均顯著升高,E-cadherin蛋白表達水平顯著降低(P<0.05),且呈時間依賴趨勢;與高糖組比較,PIO組細胞中PPARγ(除6 h時的蛋白表達外)、PTEN的mRNA及蛋白表達水平均顯著升高,α-SMA、p-AKT(Thr308)(除6 h外)蛋白表達水平均顯著降低,E-cadherin蛋白表達水平顯著增高(P<0.05),且呈時間依賴趨勢。與高糖組比較,GW9662干預組細胞PTEN、PPARγ mRNA及蛋白表達水平,α-SMA、E-cadherin、p-AKT(Thr308)蛋白表達水平的差異均無統計學意義,PIO的作用效應被PPARγ拮抗劑GW9662阻斷。結論:在高糖條件下PIO可能是通過激活PPARγ而實現對PTEN表達的調控,使PI3K/AKT信號通路受到抑制,進而抑制腎小管上皮細胞EMT的發生。
關鍵詞 吡格列酮;腎小管上皮細胞;過氧化物酶體增殖物激活受體γ;第10號染色體缺失的磷酸酶和張力蛋白同源基因;磷脂酰肌醇-3-激酶/蛋白激酶B信號通路;上皮細胞-間充質細胞轉分化;大鼠
ABSTRACT? ?OBJECTIVE: To investigate the effects of pioglitazone(PIO)on high glucose-induced epithelial-mesenchymal transition(EMT) in renal tubular epithelial cells of rat and its possible mechanism, and to provide theoretic reference and new target for the prevention and treatment of diabetic nephropathy.? METHODS: The rat renal tubular epithelial NRK-52E cells were randomly divided into control group (5.5 mmol/L glucose), high-glucose group (30 mmol/L glucose), PIO intervention group (30 mmol/L glucose+5.0 μmol/L PIO), GW9662 intervention group (30 mmol/L glucose+5.0 μmol/L PIO+5.0 μmol/L specific anta- gonist GW9662). The cells of the first 3 groups were detected at 6, 12, 24, 48 h of culture, while those in GW9662 intervention group were detected at 48 h of culture. mRNA expression of PTEN and PPARγ were detected by real-time PCR. The protein expression of PTEN, PPARγ, α-SMA and E-cadherin as well as the changes of PI3K/AKT signaling pathway were determined by Western blotting assay. RESULTS: With the extension of culture time, compared with control group, the mRNA and protein expression of PPARγ (except for protein expression at 6 h) and PTEN in high-glucose group reduced significantly, while the protein expression of α-SMA and p-AKT(Thr308) increased significantly, and the protein expression of E-cadherin reduced significantly(P<0.05), showing time-dependent trend. Compared with high-glucose group, the mRNA and the protein expression(except for 6 h) of PPARγ and PTEN were increased significantly in PIO intervention group, while the protein expression of α-SMA and p-AKT(Thr308) were decreased significantly, and the protein expression of E-cadherin was increased significantly (P<0.05), showing time-dependent trend. There was no statistical significance in mRNA and protein expression of PPARγ and PTEN, protein expression of E-cadherin,α-SMA and p-AKT(Thr308) between GW9662 intervention group and high-glucose group; the effect of PIO was blocked by PPARγ antagonist GW9662. CONCLUSIONS: PIO may up-regulate the expression of PTEN by activating PPARγ, inhibit PI3K/AKT signaling pathway so as to inhibit the occurrence of EMT of renal tubular epithelial cells.
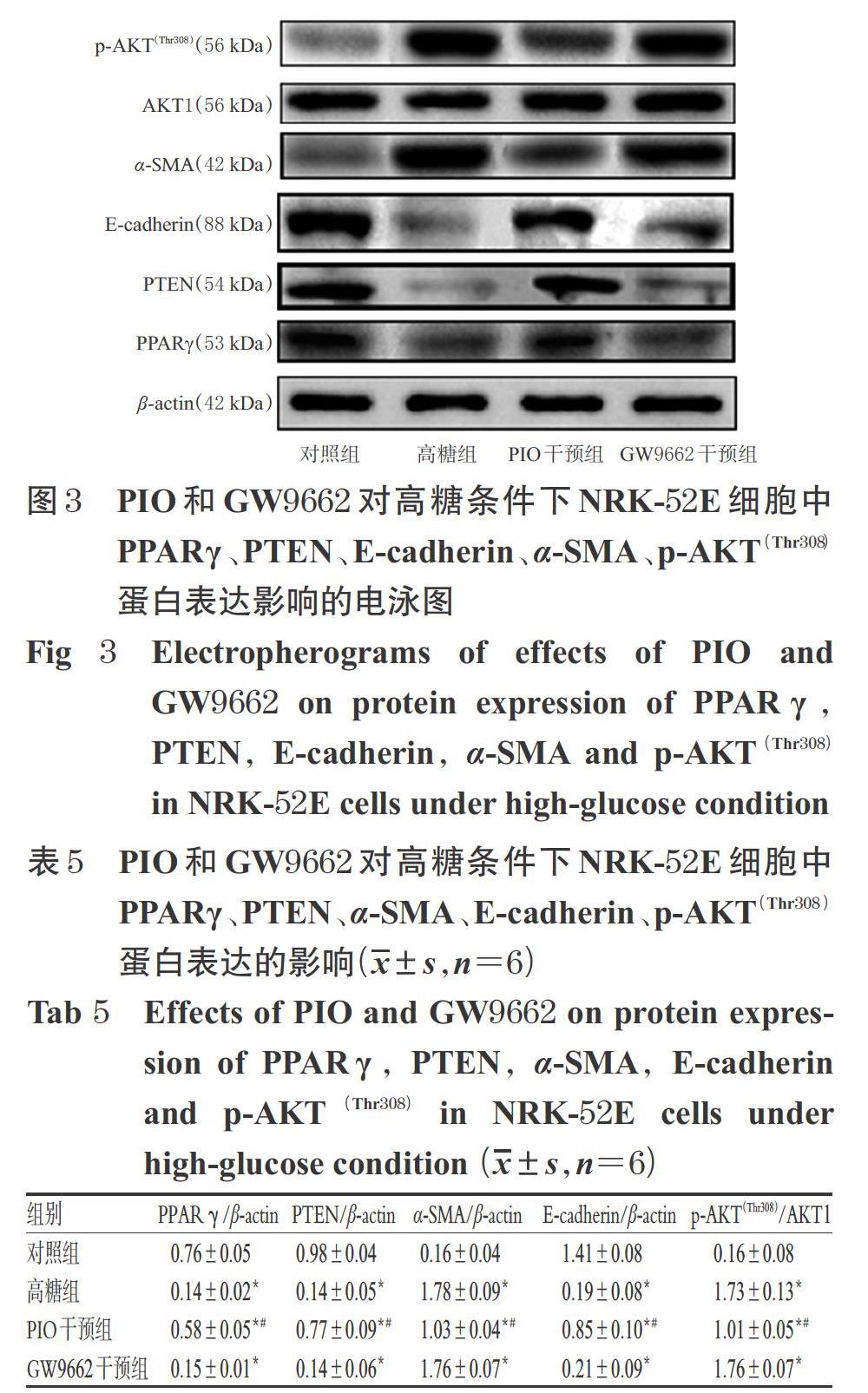
3.3.2 對蛋白表達的影響 Western blotting法結果顯示,與高糖組比較,PIO干預組細胞中PPARγ、PTEN和E-cadherin蛋白的相對表達水平均顯著升高,α-SMA、p-AKT(Thr308)蛋白的相對表達水平均顯著降低(P<0.05);而與高糖組比較,GW9662干預組細胞中各蛋白相對表達水平的差異均無統計學意義(P>0.05),表明PPARγ拮抗劑GW9662可以阻斷PIO的作用效應。PIO和GW9662對高糖條件下NRK-52E細胞中PPARγ、PTEN、E-cadherin、α-SMA、p-AKT(Thr308)蛋白表達影響的電泳圖見圖3,對蛋白表達水平的影響見表5。
4 討論
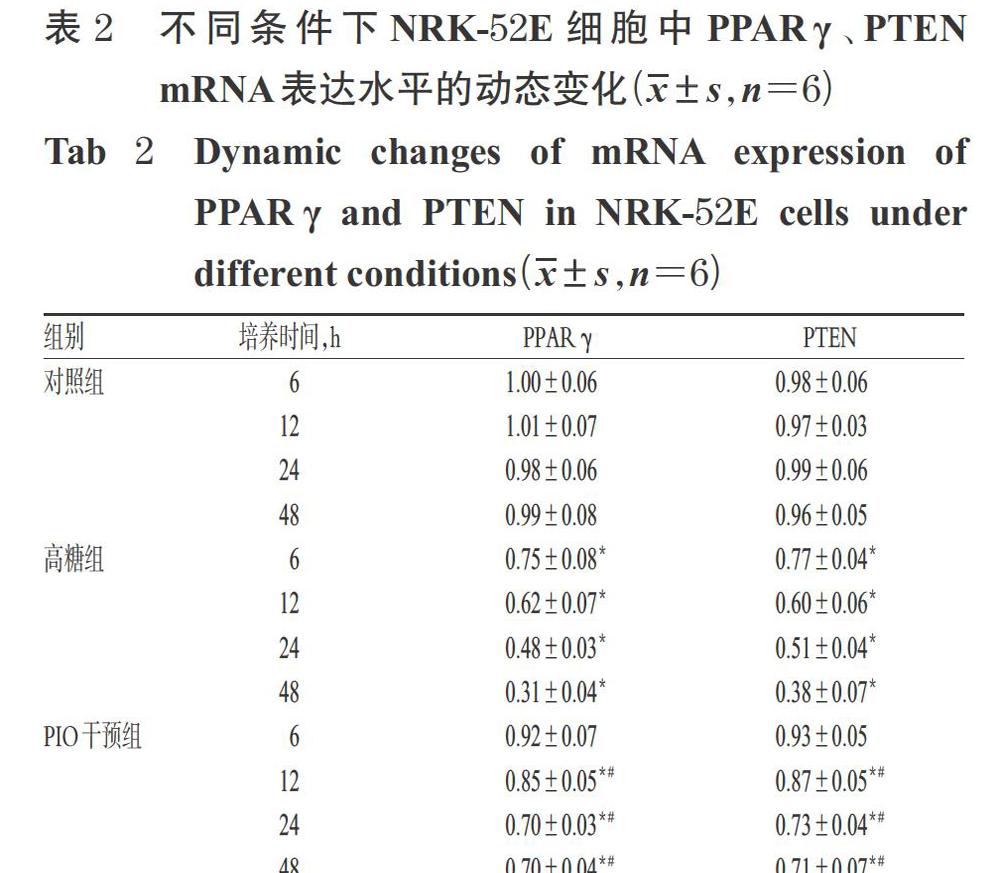
DN是糖尿病最常見的并發癥,主要有腎小球硬化和腎小管間質纖維化等病理表現,但其發病機制中的很多具體環節目前尚不甚清楚。近年來研究認為,腎小管間質纖維化在DN的發生發展中具有更為重要的作用[10-11]。而已有研究表明,促進腎間質纖維化并進一步導致DN腎臟損傷的主要機制是EMT[1-2]。目前認為,上皮細胞標志物E-cadherin表達于上皮細胞中,在EMT過程中其表達減少甚至消失,而間質細胞標志物α-SMA在EMT早期則表達增多[12]。PTEN是第一個被發現具有磷酸酶活性的抑癌基因,可通過負性調控PI3K/AKT信號通路而發揮抗纖維化效應[3]。本研究結果也驗證了隨著高糖處理時間的逐漸延長,體外培養的腎小管上皮細胞NRK-52E中PPARγ和PTEN的mRNA及蛋白表達水平,以及上皮細胞標志物E-cadherin的蛋白表達水平均較對照組進行性降低,而間質細胞標志物α-SMA和PI3K/AKT通路因子p-AKT(Thr308)的蛋白表達水平均較正常對照組進行性升高。這提示,PI3K/AKT信號通路可以在高糖條件下被激活,同時高糖培養的NRK-52E細胞中PPARγ和PTEN的表達較正常時明顯降低,表明腎小管上皮細胞發生了明顯的EMT。
噻唑烷二酮類藥物是PPARγ的選擇性激動劑,有研究發現,其抗腎臟纖維化病變的機制是通過活化PPARγ 而實現的[9]。研究表明,PPARγ對PTEN表達進行調控的機制可能是其可以與位于PTEN上游的2個反應元件直接結合[6-7]。然而,噻唑烷二酮類藥物是否通過活化PPARγ而具有上調高糖誘導的NRK-52E細胞中PTEN表達的功能,從而發揮抗EMT的作用,尚未有研究闡明。本研究選用噻唑烷二酮類抗糖尿病藥物PIO,通過MTT檢測顯示,PIO對NRK-52E細胞增殖的影響具有雙相性,濃度為2 μmol/L時能促進細胞增殖,10 μmol/L時則抑制細胞增殖。本次試驗選擇5 μmol/L濃度的PIO,該濃度既可對NRK-52E細胞產生一定抑制作用,又對細胞增殖無明顯影響。
本研究結果顯示,PIO干預組細胞在不同作用時間(除少數時間點外)下,其PPARγ、PTEN mRNA及蛋白表達水平均較高糖組顯著升高,α-SMA和p-AKT(Thr308)蛋白表達水平均較高糖組顯著降低,上皮細胞標志物E-cadherin蛋白表達水平較高糖組顯著升高,且呈時間依賴趨勢。這提示,PIO可一定程度地激活PPARγ、上調PTEN并抑制PI3K/AKT信號通路的過度激活,從而表現出抑制NRK-52E細胞EMT發生和進展的作用。
為了進一步確定PIO是否通過PPARγ途徑上調PTEN來發揮抑制EMT的作用,筆者應用PPARγ特異性拮抗劑GW9662進行反向驗證。GW9662能不可逆性地與PPARγ的285位半胱氨酸位點共價結合,有體外細胞試驗已證實,1~10 μmol/L的GW9662具有特異性拮抗PPARγ活化的功能[13]。因此,選擇GW9662作為驗證藥物來確定PIO是否通過PPARγ依賴性途徑對PTEN的表達產生影響。本研究結果顯示,與高糖組比較,PIO確能使PPARγ和PTEN mRNA及蛋白的表達水平以及E-cadherin蛋白的表達水平明顯升高,使α-SMA、p-AKT(Thr308)蛋白的表達水平明顯降低;而加入PPARγ特異性拮抗劑GW9662干預后,PPARγ、PTEN mRNA及蛋白的表達水平以及其余各蛋白的表達水平與高糖組均無顯著性差異,即GW9662阻斷了PIO對NRK-52E細胞的上述所有保護性作用。這進一步明確了PIO是通過PPARγ/PTEN/PI3K/AKT通路來發揮對NRK-52E細胞發生EMT的抑制作用。
綜上,在高糖條件下PIO可能是通過激活PPARγ而實現對PTEN表達的調控,使PI3K/AKT信號通路受到抑制,進而抑制腎小管上皮細胞EMT的發生。本研究結果可為明確DN的發病機制以及尋找DN防治的有效藥物提供理論依據。
參考文獻
[ 1 ] LOEFFLER I,WOLF G. Epithelial-to-mesenchymal transition in diabetic nephropathy:fact or fiction? [J]. Cells,2015,4(4):631-652.
[ 2 ] 周星丞,張帆,嚴瑞,等. SAA1在狼瘡小鼠腎臟中的表達及其對小鼠腎小管上皮細胞EMT的作用[J].中國免疫學雜志,2019,35(21):2561-2565、2575.
[ 3 ] LI L,ZHU X,SHOU T,et al. MicroRNA-28 promote cell proliferation and invasion in gastric cancer via the PTEN/PI3K/AKT signaling pathway[J]. Mol Med Rep,2017,17(3):4003-4010.
[ 4 ] 王圓圓,劉瑞霞,郭兵,等.大鼠腎組織PETN表達下調在糖尿病腎病發展中的作用[J].生理學報,2011,63(4):325-332.
[ 5 ] 李霜,王圓圓,郭兵,等. 控制血糖對糖尿病大鼠腎PTEN表達及纖維化病變的影響[J].貴陽醫學院學報,2012,37(1):14-19.
[ 6 ] LIU YW,DAI B,XU CG,et al. Rosiglitazone inhibits transforming growth factor-β1 mediated fibrogenesis in ADPKD cyst-lining epithelial cells[J]. PLoS One,2011. DOI:10.1371/journal.pone.0028915.
[ 7 ] ZAMBRANO S,BLANCA AJ,RUIZ-ARMENTA MV,et al. L-carnitine attenuates the development of kidney fibrosis in hypertensive rats by upregulating PPAR-γ[J].? ?Amer J Hypertens,2014,27(3):460-470.
[ 8 ] BONOFIGLIO D,GABRIELE S,AQUILA S,et al. Estrogen receptor alpha binds to peroxisome proliferator-activated receptor response element and negatively interferes with peroxisome proliferator-activated receptor gamma signaling in breast cancer cells[J]. Clin Cancer Res,2005,17(11):6139-6147.
[ 9 ] FANG HQ,FANG WT,CAO HW,et al. Di-(2-ethylhexyl)-phthalate induce apoptosis via the PPARγ/PTEN/AKT pathway in differentiated human embryonic stem cells[J].Food Chem Toxicol,2019. DOI:10.1016/j.fct.2019.05. 060.
[10] 彭君,彭家清,秦鵬,等. miR-27a-3p靶向SnoN抑制高糖誘導的人近端腎小管上皮細胞EMT的作用[J].免疫學雜志,2020,36(1):45-51.
[11] 孫小鴻,黃凱鵬,黃河清. Connexin43通過SIRT1-HIF1-α通路改善糖尿病腎小管間質纖維化的研究[J].中國藥理學與毒理學雜志,2019,33(9):718.
[12] LAMOUILLE S,XU J,DERYNCK R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol,2014,15(3):178-196.
[13] LEESNITZER LM,PARKS DJ,BLEDSOE RK,et al. Functional consequences of cysteine modification in the ligand binding sites of peroxisome proliferators activated receptors by GW9662[J]. Biochemistry,2002,41(21):6640- 6650.
(收稿日期:2020-02-13 修回日期:2020-06-28)
(編輯:段思怡)

