低氧誘導(dǎo)因子1α調(diào)控骨代謝和骨微環(huán)境血管生成的研究進(jìn)展
張士花 元宇 鄒軍*
1.上海體育學(xué)院運(yùn)動(dòng)科學(xué)學(xué)院,上海 200438
2.華南師范大學(xué)體育科學(xué)學(xué)院,廣東 廣州 510631
骨血管為骨組織提供氧、營(yíng)養(yǎng)、激素、細(xì)胞因子等物質(zhì),在骨生長(zhǎng)發(fā)育、骨缺損修復(fù)以及骨代謝平衡中發(fā)揮重要作用。有研究[1]報(bào)道,骨組織血流量和骨密度高度相關(guān),骨質(zhì)疏松患者的骨血流量供給相對(duì)要低于正常人群。動(dòng)物實(shí)驗(yàn)[2]也證實(shí),去卵巢骨質(zhì)疏松小鼠在骨量下降的同時(shí)伴隨著骨血液供給水平的下降。近年來(lái),《Nature》相繼報(bào)道了兩項(xiàng)研究[3-4],關(guān)于骨血管生成與骨形成相互耦聯(lián),抑制骨血管生成導(dǎo)致骨形成受阻。此外,老年化導(dǎo)致的骨血管生成能力下降也抑制了骨形成,導(dǎo)致骨量流失。骨血管生成與骨形成是一個(gè)相互偶聯(lián)的過(guò)程,骨血管的生成能夠促進(jìn)骨形成,成骨細(xì)胞也能夠分泌促血管生成細(xì)胞因子調(diào)控血管內(nèi)皮細(xì)胞的增殖及血管化[5]。低氧誘導(dǎo)因子1α(hypoxia inducible factor 1α,HIF-1α)在骨代謝過(guò)程中發(fā)揮著重要作用[6],并且是血管生成的主要調(diào)節(jié)因子,通過(guò)與促血管生成因子如內(nèi)皮細(xì)胞生長(zhǎng)因子(vascular endothelial growth factor,VEGF)等協(xié)同參與脈管系統(tǒng)形成[7]。血管生成是腫瘤生長(zhǎng)的先決條件,自然殺傷細(xì)胞(natural killer cells,NK)中HIF-1α的缺失抑制了腫瘤生長(zhǎng)[8]。關(guān)于非小細(xì)胞肺癌(non-small cell lung cancer,NSCLC)血管生成分子機(jī)制的研究表明,HIF-1α參與miR-206調(diào)節(jié)的血管生成過(guò)程,miR-206能夠抑制STAT3 / HIF-1α/ VEGF途徑來(lái)降低血管生成[9]。
目前,關(guān)于HIF-1α調(diào)控骨微環(huán)境血管生成的報(bào)道較為鮮見(jiàn),因此,本文主要綜述HIF-1α在骨微環(huán)境血管生成中的作用機(jī)制,為骨血管生成防治骨質(zhì)疏松的機(jī)制研究提供理論基礎(chǔ)。
1 HIF1α的生物學(xué)功能
HIF-1α是HIF-1蛋白家族的三個(gè)成員之一,由α亞基和β亞基組成的二聚體,在軟骨細(xì)胞和其他細(xì)胞類(lèi)型的氧穩(wěn)態(tài)中起關(guān)鍵作用[10-11]。在含氧量正常的條件下,HIF-1α在氧依賴(lài)性降解(oxygen-dependent degradation,ODD)結(jié)構(gòu)域內(nèi)的關(guān)鍵脯氨酸殘基處被脯氨酰羥化酶(prolyl hydroxylases,PHD)羥基化,羥基化時(shí),HIF-1α與一種E3泛素連接酶(Von Hippel-Lindaum,VHL)蛋白結(jié)合,隨后被蛋白酶體降解[11-13]。在低氧條件下,HIF-1α的脯氨酰羥基化被抑制,HIF-1α在細(xì)胞核中積累后與HIF-1的β亞基異二聚體反式激活HIF反應(yīng)基因,包括參與血管生成的基因,如VEGF[14-16]。迄今為止,已經(jīng)確定的HIF的靶基因有超過(guò)100個(gè)[17],它們?cè)诙喾N生物過(guò)程中發(fā)揮不同作用,包括調(diào)控能量代謝、血管生成、紅細(xì)胞生成、細(xì)胞存活、細(xì)胞凋亡和調(diào)節(jié)pH[18]。
HIF-1α能夠通過(guò)靶向作用于GLUT1、ADRP、CAXII、VEGF等細(xì)胞因子調(diào)控各種生理過(guò)程[19]。如通過(guò)GLUT1調(diào)控葡萄糖的轉(zhuǎn)運(yùn),通過(guò)ADRP調(diào)控脂代謝,通過(guò)CAXII調(diào)控細(xì)胞內(nèi)pH穩(wěn)態(tài)[20]。此外,HIF-1α還能通過(guò)激活BNIP3調(diào)節(jié)細(xì)胞自噬和凋亡過(guò)程[21]。
2 HIF1α調(diào)控骨代謝
高原鼠兔(ochotona curzoniae)是一種高耐缺氧物種,生活在青藏高原海拔3 000~5 000米處,Li等[22]發(fā)現(xiàn)在高原鼠兔的大多數(shù)組織中,HIF-1α蛋白表達(dá)水平明顯高于生活在海平面的小鼠,并隨著棲息地高度的增加而增加。在骨生成過(guò)程中,HIF-1α能夠調(diào)控成骨細(xì)胞的增殖和遷移,促進(jìn)BMP誘導(dǎo)干細(xì)胞成軟骨分化,促進(jìn)軟骨細(xì)胞外基質(zhì)的分泌。低氧環(huán)境下成骨細(xì)胞中HIF-1α表達(dá)上調(diào),但成骨細(xì)胞活性降低且凋亡增多,過(guò)表達(dá)HIF-1α能緩解缺氧所引起的凋亡及活性降低,而敲除HIF-1α后成骨細(xì)胞活性進(jìn)一步下降[23]。在小鼠中過(guò)表達(dá)HIF-1α能夠增加骨形成,提高長(zhǎng)骨體積[24]。這些研究提示,低氧應(yīng)激時(shí)成骨細(xì)胞HIF-1α分泌適應(yīng)性增多,HIF-1α能夠調(diào)控VEGF等下游基因促進(jìn)骨血管生成,同時(shí)能夠緩解缺氧引起的細(xì)胞凋亡,促進(jìn)成骨細(xì)胞的增殖及分化,促進(jìn)骨形成。
在破骨細(xì)胞中,HIF-1α似乎扮演著另一種角色。破骨細(xì)胞位于低氧骨膜區(qū)域,當(dāng)卵巢功能正常時(shí),雌激素抑制破骨細(xì)胞HIF-1α功能;去卵巢后,雌激素缺乏致使HIF-1α功能趨向穩(wěn)定,破骨細(xì)胞活性增強(qiáng),促進(jìn)骨吸收。給予外源性雌激素干預(yù)后,HIF-1α受到抑制,骨吸收減弱[25]。此外,將去卵巢小鼠破骨細(xì)胞HIF-1α基因敲除后,破骨細(xì)胞活性減弱,骨量增加。在睪丸切除的雄鼠中也發(fā)現(xiàn)類(lèi)似現(xiàn)象,睪丸切除后HIF-1α蛋白表達(dá)上調(diào),骨量流失;補(bǔ)充睪酮后HIF-1α受到抑制,骨吸收減弱[26]。由此表明,抑制破骨細(xì)胞中HIF-1α表達(dá)能夠抑制破骨細(xì)胞活性,削弱骨吸收,改善骨代謝。
在軟骨內(nèi)骨形成期間,生長(zhǎng)板中心內(nèi)的軟骨細(xì)胞增殖并合成無(wú)血管細(xì)胞外基質(zhì),隨著軟骨細(xì)胞的增殖和分化會(huì)出現(xiàn)軟骨細(xì)胞肥大并釋放相關(guān)分子,包括刺激血管侵入生長(zhǎng)板的促血管生成細(xì)胞因子VEGF[27],在骨骼發(fā)育和骨修復(fù)中,VEGF依賴(lài)性血管侵入無(wú)血管軟骨是骨形成的關(guān)鍵步驟[28],HIF-1α信號(hào)傳導(dǎo)在該過(guò)程中參與血管生成和骨生成的耦合。近期,Stegen等[29]發(fā)表在《Nature》的研究報(bào)道了軟骨細(xì)胞中過(guò)度的HIF-1α信號(hào)傳導(dǎo)通過(guò)干擾細(xì)胞的生物能和生物合成致使骨骼發(fā)育不良。其具體機(jī)制體現(xiàn)在葡萄糖氧化的減少導(dǎo)致能量缺乏,這限制了細(xì)胞的增殖,激活了未折疊蛋白質(zhì)反應(yīng)同時(shí)也減少膠原蛋白的合成,外源性補(bǔ)充谷氨酰胺使之通量增加,進(jìn)而α-酮戊二酸水平升高,這又反過(guò)來(lái)增加了膠原蛋白上的脯氨酸和賴(lài)氨酸羥基化。在這種代謝調(diào)節(jié)方式下的膠原蛋白修飾使得軟骨基質(zhì)能更好的抵抗蛋白酶介導(dǎo)的降解,從而增加骨量。因此,不適當(dāng)?shù)腍IF-1α信號(hào)傳導(dǎo)會(huì)導(dǎo)致由膠原蛋白過(guò)度修飾引起的骨骼發(fā)育不良,這種效應(yīng)也可能導(dǎo)致與細(xì)胞外基質(zhì)相關(guān)的其他疾病,例如癌癥和纖維化[29]。
近期有研究[30]報(bào)道,在microRNAs調(diào)控骨代謝過(guò)程中HIF-1α也發(fā)揮了重要的介導(dǎo)作用。關(guān)于miR-21在促進(jìn)骨髓間充質(zhì)干細(xì)胞(bone marrow mesenchymal stem cells,BMSCs)的遷移和成骨分化的實(shí)驗(yàn)中發(fā)現(xiàn),miR-21通過(guò)增加P-Akt和HIF-1α活化程度來(lái)促進(jìn)BMSCs的成骨分化能力。Costa V等[31]采用熒光激活細(xì)胞分選術(shù)(fluorescence-activated cell sorting, FACS),通過(guò)基因表達(dá)和蛋白質(zhì)分析來(lái)研究HIF-1α和miR-675-5p在血管生成和成骨耦合作用的相關(guān)研究中發(fā)現(xiàn),miR-675-5p通過(guò)增加HIF-1α表達(dá)和激活Wnt /β-catenin信號(hào)通路來(lái)促進(jìn)人骨髓間充質(zhì)干細(xì)胞(human bone marrow mesenchymal stem cells,hMSC)向成骨細(xì)胞分化。
3 HIF1α調(diào)控骨微環(huán)境血管生成
成體哺乳動(dòng)物(包括人)外周血、骨髓中的內(nèi)皮祖細(xì)胞(endothelial progenitor cells,EPCs)與骨髓中的多能成體祖細(xì)胞(multipotent adult progenitor cells,MAPCS)在體內(nèi)外均可分化為成熟血管內(nèi)皮細(xì)胞(endothelial cells,ECs),且聚集于靶器官,參與新血管的形成過(guò)程[32]。許多細(xì)胞因子都具有成血管活性,一項(xiàng)關(guān)于HIF-1α信號(hào)傳導(dǎo)在調(diào)節(jié)血管生成素(angiogenin,ANG)表達(dá)和上皮-間質(zhì)轉(zhuǎn)化(Epithelial-mesenchymal transition,EMT)在缺氧視網(wǎng)膜色素上皮細(xì)胞中作用的研究[33]發(fā)現(xiàn),在ARPe-19的缺氧小鼠模型中,ANG的表達(dá)水平增加,阻斷HIF-1α信號(hào)傳導(dǎo)會(huì)抑制ANG的高表達(dá)。目前已知受HIF-1α調(diào)控的下游基因有60多種,其中最主要的下游基因是VEGF[34],在HIF-1α缺失的情況下,VEGF表達(dá)降低[35]。進(jìn)一步研究[36]發(fā)現(xiàn),HIF-1α通過(guò)與VEGF啟動(dòng)子區(qū)域中的缺氧反應(yīng)元件結(jié)合而上調(diào)VEGF的產(chǎn)生,內(nèi)皮細(xì)胞生長(zhǎng)因子受體1(vascular endothelial growth factor receptor,VEGFR-1) 和內(nèi)皮細(xì)胞生長(zhǎng)因子受體2(vascular endothelial growth factor receptor,VEGFR-2) 是在內(nèi)皮細(xì)胞上表達(dá)的兩種均由HIF-1α介導(dǎo)的受體,而VEGF是通過(guò)VEGFR-1和VEGFR-2實(shí)現(xiàn)內(nèi)皮細(xì)胞的趨化和促進(jìn)有絲分裂,進(jìn)而引起細(xì)胞增殖、遷移和血管生成[37],提示HIF-1α在血管生成中有著不可或缺的作用。有研究[38-39]報(bào)道,HIF-1α在誘導(dǎo)血管生成中效果顯著,其誘導(dǎo)的新生血管結(jié)構(gòu)正常,無(wú)組織水腫、血管平直舒緩少曲折,囊性血管形成率幾乎為零。
骨骼是一種高度血管化的組織,但骨腔中的骨微環(huán)境則是一個(gè)天然的低氧環(huán)境。在骨組織中,氧分壓約為1%~6%或小于1%,其中骨內(nèi)膜氧分壓小于1.8%,骨腔內(nèi)血管氧分壓小于1.3%[40-41]。HIF-1α是低氧或缺氧條件下調(diào)控細(xì)胞內(nèi)穩(wěn)態(tài)的核心轉(zhuǎn)錄因子。低氧時(shí)HIF-1α分泌增多并轉(zhuǎn)運(yùn)至細(xì)胞核中與 HIF-1β 形成聚合體,啟動(dòng)VEGF及促紅細(xì)胞生成素(erythropoietin,EPO)等下游基因的轉(zhuǎn)錄,引起一系列的耐氧適應(yīng)性反應(yīng)[42]。
在血管的發(fā)育過(guò)程中,HIF-1α通過(guò)調(diào)控 VEGF 基因促進(jìn)血管生成。低表達(dá)HIF-1α?xí)r,即便是在低氧條件下,VEGF 表達(dá)也會(huì)受到抑制。HIF-1α還能介導(dǎo)VEGF調(diào)控血管生成與骨生成間的耦聯(lián)[43]。在骨生成過(guò)程中,軟骨細(xì)胞分泌VEGF并激活血管的生成,促進(jìn)軟骨發(fā)育。過(guò)表達(dá)HIF-1α能誘導(dǎo)VEGF等血管生成因子過(guò)量分泌,刺激長(zhǎng)骨血管生成,在血管過(guò)度生長(zhǎng)的長(zhǎng)骨區(qū)域也伴隨著過(guò)度活躍的骨生成現(xiàn)象[44]。近年Kusumbe等[45]在Nature上報(bào)道,在小鼠的骨骼系統(tǒng)中存在H型內(nèi)皮及L型內(nèi)皮兩種特殊的毛細(xì)血管亞型,其中H型內(nèi)皮是骨血管生成的關(guān)鍵,成骨細(xì)胞及其前體細(xì)胞主要分布在H型內(nèi)皮細(xì)胞周?chē)6^(guò)表達(dá)HIF-1α能夠擴(kuò)增H型內(nèi)皮及干骺端血管,提高成骨細(xì)胞前體細(xì)胞數(shù),促進(jìn)骨生成[24]。
VHL基因敲出小鼠的HIF-1α表達(dá)顯著上調(diào),血管分布明顯增加,并且在牽引成骨過(guò)程中骨生成增加,但在成骨細(xì)胞中缺乏HIF-1α的小鼠血管新生和骨愈合明顯受損[46],過(guò)表達(dá)HIF-1α的MSC血管生成和成骨活性都有明顯增強(qiáng)[47-48]。去鐵胺(deferoxamine,DFO)是一種廣泛使用的缺氧模仿劑[16,49]。在一項(xiàng)有關(guān)促進(jìn)骨質(zhì)疏松性骨缺損愈合的潛在機(jī)制研究[50]中,用DFO構(gòu)建缺氧模型,從聚乳酸-羥基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA) 釋放的DFO可以激活HIF-1α信號(hào)通路后影響幾種下游的血管生成因子,包括VEGF、FGF-2、ANGFT-1。VEGF和FGF-2不僅促進(jìn)血管生成,而且對(duì)MSC的成骨分化具有刺激作用[51-53],因此HIF-1α在加速骨缺損愈合過(guò)程中發(fā)揮重要作用。
脛骨軟骨發(fā)育不全(tibial dyschondroplasia,TD)是一種棘手的家禽疾病,其特征是脛骨生長(zhǎng)板(tibial growth plates,TGP)中出現(xiàn)非血管化和非礦化的軟骨塊[54],其病因是由于血液供應(yīng)降低或缺乏導(dǎo)致脛骨軟骨細(xì)胞死亡,進(jìn)而導(dǎo)致骨骼發(fā)育異常。Genin等[55]的研究表明,脈管系統(tǒng)缺失與TD生長(zhǎng)板損傷關(guān)系重大,且可能與HIF-1α的表達(dá)異常有關(guān)。一項(xiàng)關(guān)于血管生成與TD的研究[54]發(fā)現(xiàn),TD的直接原因是脛骨血管生成受到抑制,抑制HIF-1α和VEGFA / VEGFR信號(hào)傳導(dǎo)途徑能夠阻斷軟骨細(xì)胞的營(yíng)養(yǎng)供應(yīng),導(dǎo)致軟骨細(xì)胞死亡,脛骨生長(zhǎng)板發(fā)育受阻。而上調(diào)HIF-1α能夠激活VEGFA及其在軟骨細(xì)胞中的受體,進(jìn)而刺激血管生成,從而實(shí)現(xiàn)在缺氧條件下促進(jìn)脛骨生長(zhǎng)板的正常發(fā)育。見(jiàn)圖1。
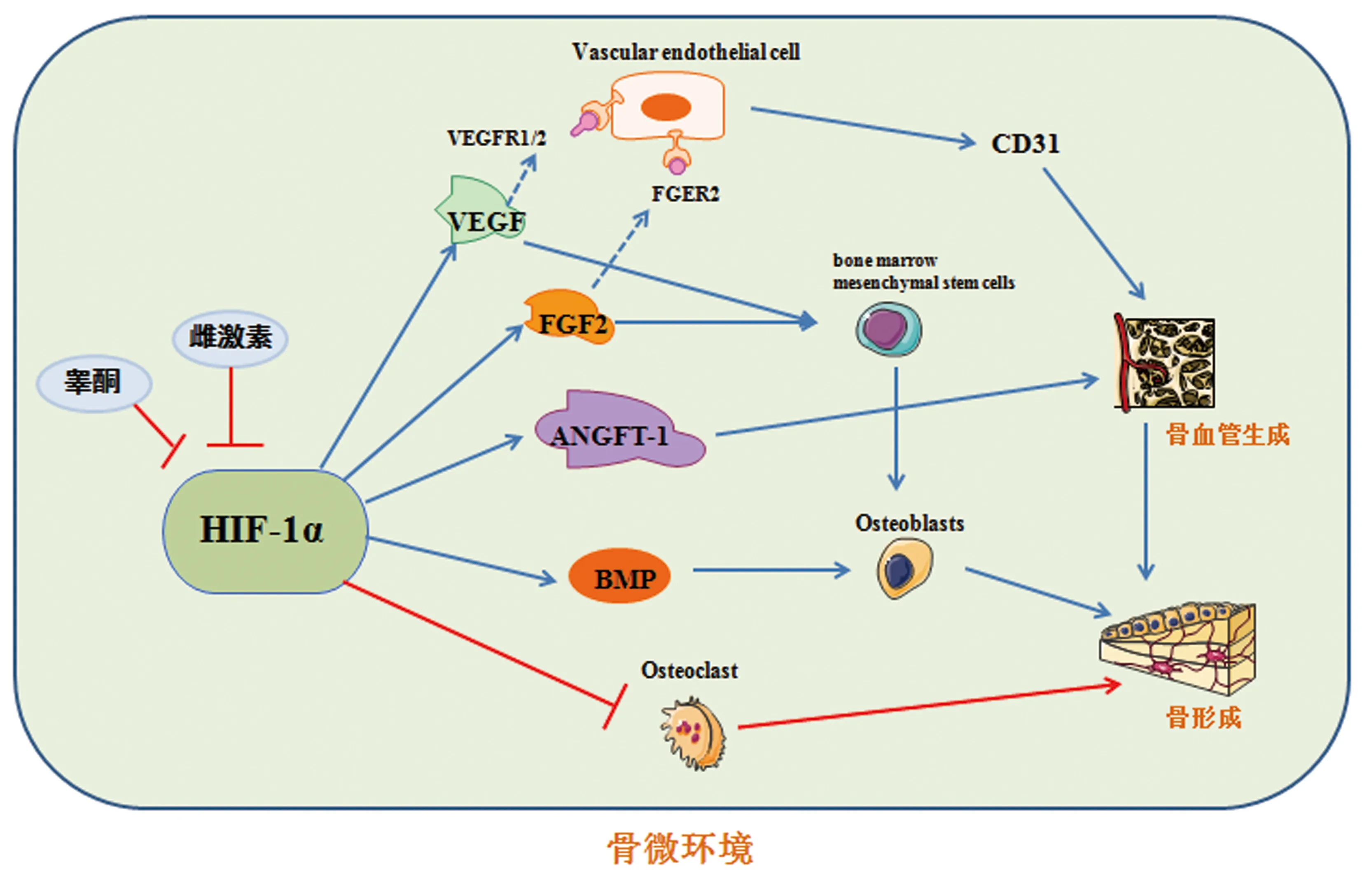
圖1 HIF-1α調(diào)控骨代謝、骨微環(huán)境血管生成作用機(jī)制圖Fig.1 Mechanism of HIF-1α regulating bone metabolism and angiogenesis in bone microenvironment
4 小結(jié)
HIF-1α在骨代謝中發(fā)揮著重要作用,能夠調(diào)控成骨細(xì)胞、破骨細(xì)胞以及軟骨細(xì)胞的增殖、活性及功能。HIF-1α還廣泛參與血管生成過(guò)程的調(diào)控。在骨微環(huán)境中,血管生成能力的減弱將導(dǎo)致骨形成能力衰退。HIF-1α能夠通過(guò)調(diào)控 VEGF及FGF2等血管生成因子促進(jìn)血管生成,進(jìn)而促進(jìn)骨形成。目前關(guān)于HIF-1α在骨血管生成中的研究還處于初級(jí)階段,其確切機(jī)制尚未清楚,如HIF-1α與外泌體、非編碼RNA之間的關(guān)系及其在骨血管生成中的調(diào)控作用等仍有待更深入地進(jìn)一步研究。

