N-Fe/CNT對Pb(Ⅱ)去除的熱力學與動力學研究
劉清 ,楊濤 ,滑熠龍,何小燕,招國棟
(1.南華大學 污染控制與資源化技術湖南省重點實驗室,湖南 衡陽 421001;2.南華大學 資源環境與安全工程學院,湖南 衡陽 421001;3.株洲市水務投資集團有限公司,湖南 株洲 412000)
我國是重金屬鉛的消費大國,鉛的污染物大多難于降解,主要通過水體等進入自然環境,危害人類健康[1]。納米零價鐵(nZVI)具有反應活性強、比表面積大等優點,在去除重金屬污染物時備受青睞[2]。nZVI的傳統制備方法成本高、易團聚等,限制其在生態環境修復中的應用。本文使用向日葵綠色制備nZVI,原理是利用植物提取液中含有的黃酮、多酚等具有還原性的物質還原制備nZVI[3]。MWCNT是一種碳材料,比表面積大,呈中空結構,對污染物具有去除性能[4]。本文將綠色制備的nZVI負載于MWCNT上,擬解決nZVI的易團聚問題,并利用兩者協同去除污染物,實現對含鉛廢水的高效去除。
1 實驗部分
1.1 試劑與儀器
硫酸亞鐵、無水乙醇均為分析純;多壁碳納米管(MWCNT)(純度>95%,直徑50~100 nm,長度1~3 μm)、10~60 mg/L的Pb(Ⅱ)標準溶液。
HH-2s數顯恒溫水浴鍋;SHZ-D(Ш)循環水式真空泵;TGL-20B離心機;SIM-ED5-2.5冷凍干燥機;QYC2112恒溫振蕩箱;梅特勒FE20pH計;JSM-7500F型掃描電子顯微鏡;AA6300原子吸收儀。
1.2 綠色N-Fe/CNT復合材料的制備
1.2.1 nZVI的制備 將新鮮向日葵葉用清水及蒸餾水清洗干凈,晾至表面無明顯水跡后,將向日葵葉剪碎,并稱取200 g置于大燒杯中,加入1 L蒸餾水,用保鮮膜密封后,放在80 ℃水浴鍋中恒溫加熱3 h。取出,冷卻至室溫,抽濾制得向日葵葉提取液。在40 ℃且氮氣流速100 mL/min的條件下,將向日葵提取液與Fe2+濃度為0.05 mol/L的FeSO4·7H2O溶液按照1∶1等體積混合于三口瓶中,以500 r/min的速度攪拌90 min制得nZVI懸濁液。
1.2.2 綠色N-Fe/CNT復合材料的制備 按比例稱量一定量的MWCNT置于nZVI懸濁液中,攪拌120 min,得N-Fe/CNT懸濁液。將懸濁液高速離心,所得懸濁液置于-50 ℃的冷凍箱中冷凍24 h,然后置于冷凍干燥機中,冷凍干燥24 h,即可制得大小約為100目的碳納米管-納米零價鐵(N-Fe/CNT)材料。
1.3 吸附實驗
取50 mg/L Pb(Ⅱ)標準溶液25 mL于50 mL錐形瓶中,調節pH,加入0.1 g N-Fe/CNT材料,密封錐形瓶,分別在20,30,40 ℃恒溫搖床中以150 r/min速度振蕩2 h。用針式濾頭過濾,取上清液,采用原子吸收儀測定其吸光度,重復3次,取均值,并計算Pb(Ⅱ)剩余濃度,并按式(1)和式(2)計算N-Fe/CNT對Pb(Ⅱ)的吸附量及吸附率。
(1)
(2)
式中q——N-Fe/CNT對Pb(Ⅱ)的吸附量,mg/g;
R——Pb(Ⅱ)的吸附率,%;
Co——吸附前溶液Pb(Ⅱ)濃度,mg/L;
Ce——吸附后溶液Pb(Ⅱ)濃度,mg/L;
V——溶液體積,L;
m——N-Fe/CNT質量,g。
1.4 N-Fe/CNT對Pb(Ⅱ)的吸附等溫實驗和熱力學分析
取0.1 g N-Fe/CNT置于各50 mL錐形瓶中,分別加入一系列不同濃度Pb(Ⅱ)標準溶液25 mL,調節pH為6,分別放入20,30,40 ℃恒溫搖床中振蕩吸附一定時間,待反應平衡后,立即離心過濾,測定Pb(Ⅱ)的濃度。
1.5 N-Fe/CNT對Pb(Ⅱ)的吸附動力學實驗
取0.1 g N-Fe/CNT依次置于50 mL錐形瓶中,加入50 mg/L的Pb(Ⅱ)標準溶液25 mL,調節pH為6,將錐形瓶放入恒溫搖床中且設置搖床溫度為20 ℃,反應時間分別為10,20,40,60,80,100,120 min,取樣后立即離心過濾,測定Pb(Ⅱ)的濃度。
2 結果與討論
2.1 N-Fe/CNT去除 Pb(Ⅱ)
2.1.1 pH對N-Fe/CNT去除 Pb(Ⅱ)的影響 在Pb(Ⅱ)初始濃度50 mg/L,吸附劑投加量4 g/L,反應溫度為20 ℃的條件下,調節pH,吸附120 min,過濾,上清液測定Pb(Ⅱ)的剩余濃度,探究pH對N-Fe/CNT吸附Pb(Ⅱ)的影響,結果見圖1。
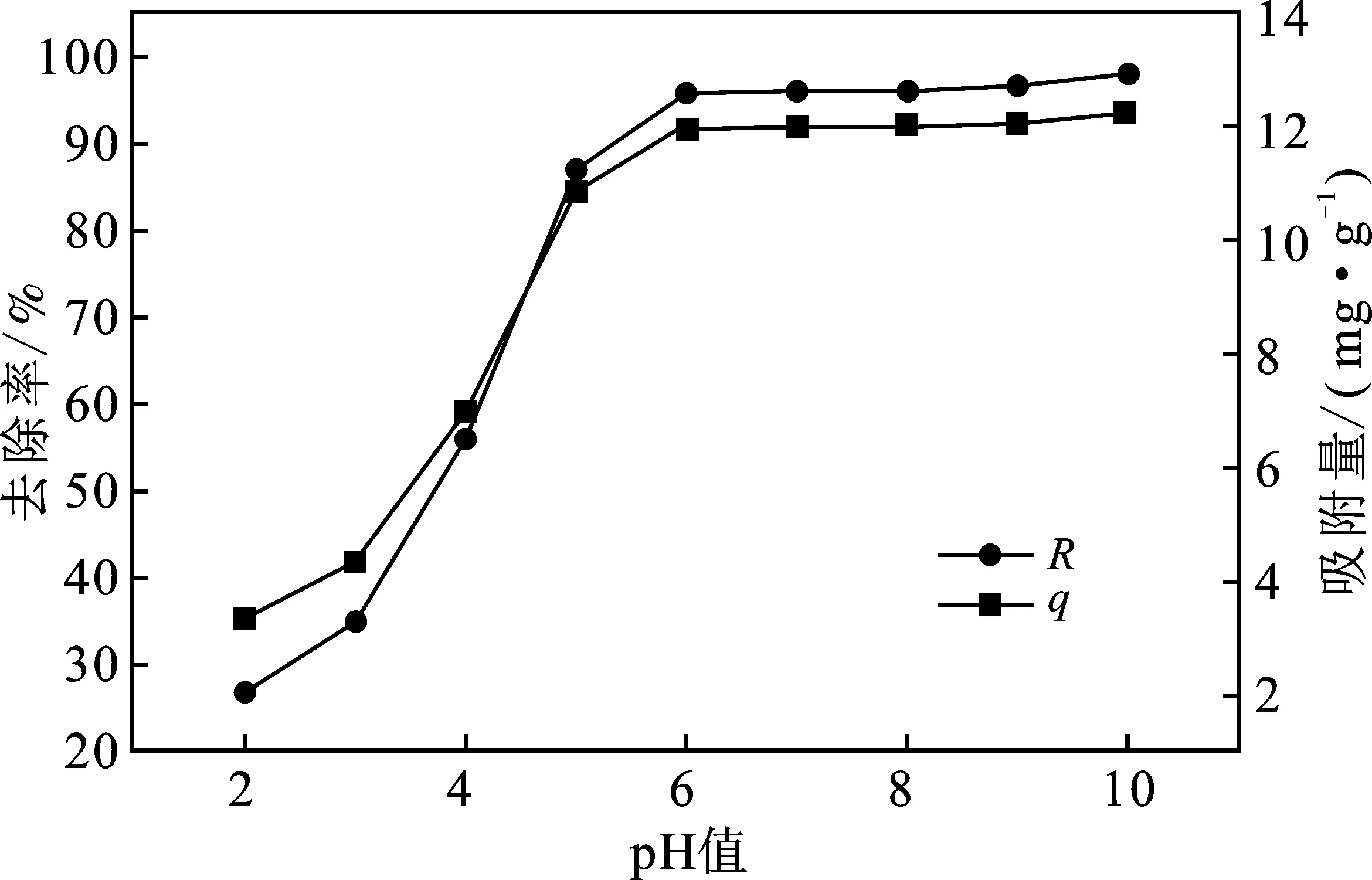
圖1 pH對去除率的影響

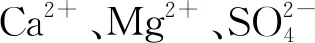

(a)陽離子濃度對反應影響
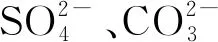
2.1.3 反應時間對N-Fe/CNT去除 Pb(Ⅱ)的影響 在Pb(Ⅱ)初始濃度50 mg/L,投加量4 g/L、反應溫度20 ℃和pH=6的條件下,分別取反應時間為10,20,40,60,80,100,120 min的樣品過濾上清液并測定Pb(Ⅱ)剩余濃度,探究反應時間對N-Fe/CNT吸附Pb(Ⅱ)的影響,結果見圖3。
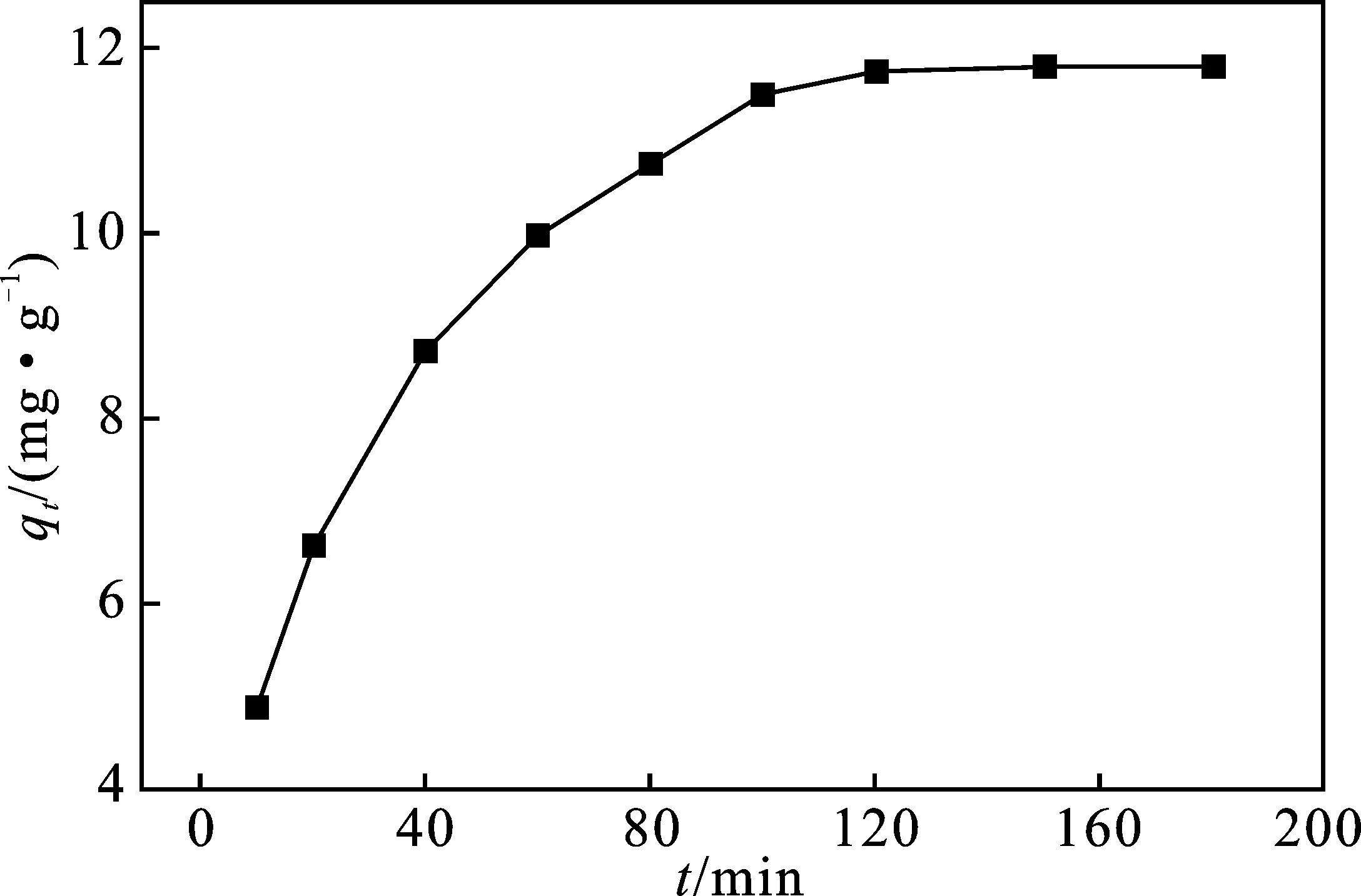
圖3 反應時間對N-Fe/CNT去除Pb(Ⅱ)的影響
由圖3可知,隨著反應時間的增加,吸附量上升,此時N-Fe/CNT對Pb(Ⅱ)的去除主要以吸附和氧化還原作用為主;在120 min時吸附基本達到平衡,吸附量達到11.97 mg/g;反應時間超過120 min后,吸附量變化不大,此時反應位點已基本被Pb(Ⅱ)所占據。
2.2 N-Fe/CNT對Pb(Ⅱ)的熱力學
2.2.1 N-Fe/CNT對Pb(Ⅱ)的吸附等溫線 為研究N-Fe/CNT對Pb(Ⅱ)的吸附機理,本實驗采用Freundlich 與 Langmuir 等溫吸附方程擬合N-Fe/CNT對Pb(Ⅱ)的吸附過程,結果見圖4和表1。

表1 吸附等溫模型擬合參數
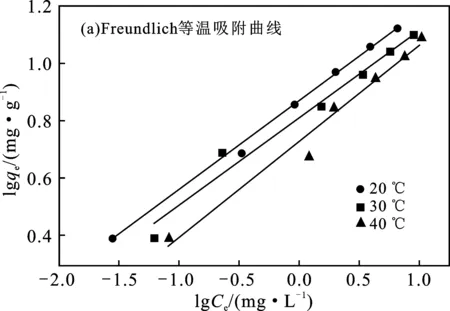
圖4 吸附等溫曲線
Freundlich等溫吸附方程[5-6]:
qe=kCe1/n
(3)
對式(3)兩邊取對數,可得:
lgqe=1/nlgCe+lgk
(4)
Langmuir 等溫吸附方程[7]:
(5)
式中Ce——平衡濃度,mg/L;
k和n——經驗常數;
b——Langmuir常數,L/mg;
qmax——最大飽和吸附量,mg/g。
由表1和圖4可知,20,30,40 ℃時,Langmuir、Freundlich兩個方程的擬合程度均較高,說明Langmuir等溫吸附方程和Freundlich等溫吸附方程均可描述N-Fe/CNT對Pb(Ⅱ)的等溫吸附行為。但Freundlich等溫吸附方程相關系數R2均大于Langmuir等溫吸附方程相關系數R2,說明N-Fe/CNT對Pb(Ⅱ)的吸附是以表面吸附為主,并不是均勻的單層吸附。從Langmuir方程中可以看出,20 ℃時,N-Fe/CNT對Pb(Ⅱ)的吸附量最大;在Freundlich方程中,3個溫度下的n值都>1,為“優惠型”吸附[8],即在低濃度也有較大吸附量,表明N-Fe/CNT適用于處理含Pb(Ⅱ)廢水。
2.2.2 N-Fe/CNT對Pb(Ⅱ)的熱力學計算 焓變ΔH(kJ/mol)、熵變ΔS[J/(mol·k)]和吉布斯自由能變ΔG(J/mol)等吸附熱力學參數可較好說明吸附劑和吸附質分子以及吸附溶劑之間的作用。
吸附過程的ΔG可通過式(6)計算,ΔH和ΔS通過式(7)計算[9]:
ΔG=-RTlnKD
(6)
lnKD=ΔS/R-(ΔH/R)/T
(7)
式中ΔS、ΔH——吸附熵變,J/(mol·k)和吸附焓變,J/mol;
R——通用氣體常數8.314 J/(mol·k);
T——熱力學溫度,K。
熱力學參數可以通過不同溫度下的熱力學平衡常數KD進行計算,KD可通過式(8)計算而得。
KD=qe/ce
(8)
ΔH和ΔS可由lnKD對1/T做出的斜率和截距求得,濃度為50 mg/L Pb(Ⅱ)的lnKD與1/T的擬合曲線見圖5,擬合方程的R2=0.994 5。
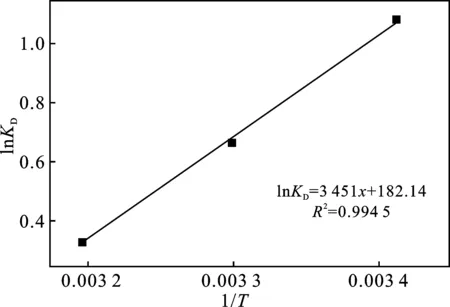
圖5 N-Fe/CNT吸附Pb(Ⅱ)的lnKD與1/T的相關曲線
由表2可知,焓變ΔH<0,表明N-Fe/CNT對Pb(Ⅱ)的吸附是放熱過程,且吸附以物理吸附為主,Pb(Ⅱ)主要與N-Fe/CNT發生了物理吸附和氧化還原反應;ΔS>0,表示該過程在固液兩相面具有不規則性,即自由度增加,是熵驅動過程;吸附吉布斯自由能ΔG<0,表明N-Fe/CNT對Pb(Ⅱ)的吸附過程可自發進行,且溫度的變化方向與ΔG絕對值的變化方向呈負相關。ΔG在3個不同溫度下均為負值,可知該吸附過程主要是以熵而不是焓的變化為主[10]。

表2 熱力學擬合參數
2.3 N-Fe/CNT對Pb(Ⅱ)的吸附動力學
通過使用準一級、復合二級與Elovich 動力學方程對N-Fe/CNT吸附Pb(Ⅱ)的實驗數據擬合,描述吸附所反映的動力學行為,研究N-Fe/CNT吸附Pb(Ⅱ)的機理,結果見圖6。

(a) N-Fe/CNT對Pb(Ⅱ)的準一級動力學曲線
準一級吸附模型線性表達式為[11]:
ln(qe-qt)=lnqe-k1t
(9)
式中qe——平衡吸附量,mg/g;
t——吸附時間,h;
qt——t時N-Fe/CNT吸附Pb(Ⅱ)的吸附量,mg/g;
k1——吸附速率常數,min-1。
復合二級反應動力學方程是用來描述Pb(Ⅱ)與N-Fe/CNT發生反應,向N-Fe/CNT內部擴散的過程,Pb(Ⅱ)在吸附過程中,一方面,Pb(Ⅱ)向反應界面擴散,與N-Fe/CNT表面發生反應;另一方面,Pb(Ⅱ)可進一步向N-Fe/CNT擴散,繼續發生反應,溶液中被吸附的Pb(Ⅱ)可用如下二級反應動力學方程來描述:
(10)
式中[M]0和[M]s分別表示金屬離子在溶液相和界面中的濃度,kd為二級反應速度常數。復合二級反應動力學方程可簡化如下[12]:
(11)
Elovich動力學方程描述了吸附速率隨吸附劑表面吸附量的增加而成指數下降,其簡化表達式如下[13]:
(12)
其中αE——吸附速率常數,mg/(min·g);
βE——脫附速率常數,g/mg。
吸附動力學擬合參數見表3。

表3 動力學擬合參數
由表3可知,在初始Pb(Ⅱ)濃度相同的情況下,Elovich 動力學方程更適合描述 N-Fe/CNT吸附Pb(Ⅱ)動力學過程,N-Fe/CNT對Pb(Ⅱ)的吸附過程主要是表面吸附[14]。
2.4 N-Fe/CNT對Pb(Ⅱ)的機理分析
2.4.1 SEM 圖7為N-Fe/CNT吸附Pb(Ⅱ)前后的SEM圖像。

(a)反應前
由圖7可知,吸附前N-Fe/CNT呈不規則的網狀中空結構,清晰可見球狀、橢球狀的nZVI分散包裹在呈桿狀的MWCNT周圍,表面存在大量細小孔洞,大幅增加了N-Fe/CNT的孔隙率,裸露出更多結合位點,利于提高N-Fe/CNT復合材料對Pb(Ⅱ)的吸附效率。吸附Pb(Ⅱ)后,N-Fe/CNT較吸附前表面平滑,表面孔洞已被吸附的Pb(Ⅱ)填充,布滿密集物變的平整且密實,形狀、結構均發生了很大變化,可以說明N-Fe/CNT與Pb(Ⅱ)發生了反應[15]。
2.4.2 XRD 圖8是N-Fe/CNT去除Pb(Ⅱ)反應前后的XRD圖。
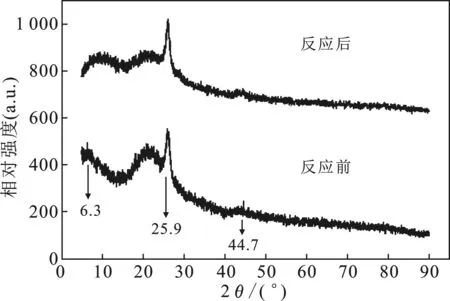
圖8 N-Fe/CNT反應前后XRD圖
由圖8可知,反應前,在2θ=25.9°出現較強的衍射峰,代表了N-Fe/CNT有較高強度的纖維結構,說明nZVI成功負載在了碳納米管表面;在2θ=6.3°和2θ=44.7°處出現了較弱的衍射峰,可能是N-Fe/CNT被部分向日葵提取液所包裹和部分nZVI被氧化生成了Fe2O3和Fe3O4等氧化物。反應后,在2θ=25.9°和2θ=44.7°處出現了很強的衍射峰,表明N-Fe/CNT反應后晶粒變大,結晶程度增加,可能原因是N-Fe/CNT與Pb(Ⅱ)反應后N-Fe/CNT出現較強團聚現象,N-Fe/CNT上的nZVI被氧化,Fe氧化物覆蓋在N-Fe/CNT表面上,形成了新的物質如Fe2O3和Fe3O4等,使得晶體結構發生了改變[16-17]。
2.4.3 FTIR N-Fe/CNT與Pb(Ⅱ)反應前后的FTIR圖,見圖9。
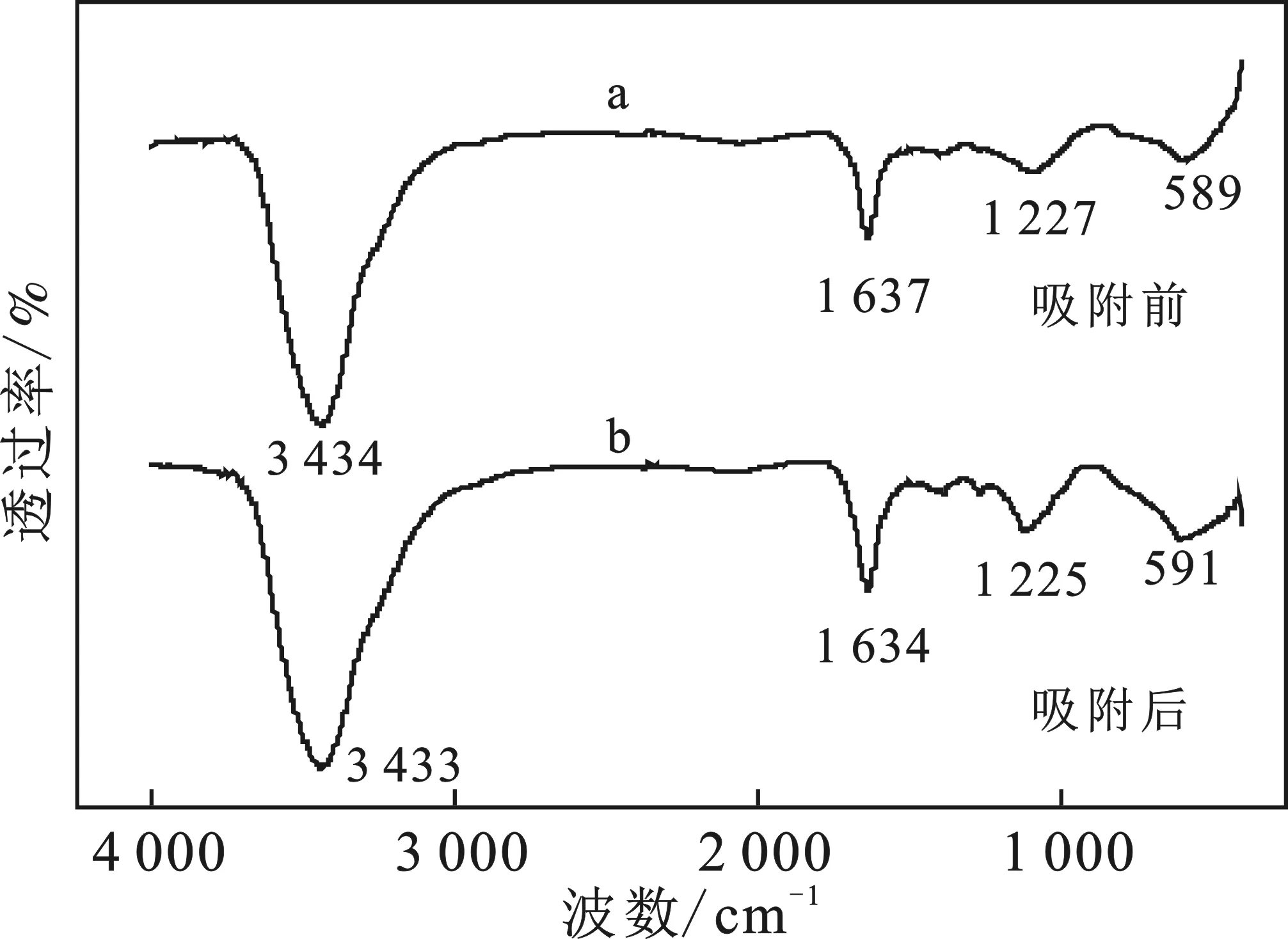
圖9 N-Fe/CNT反應前后的FTIR圖

3 結論
(1)制備了碳納米管-綠色納米鐵復合材料(N-Fe/CNT),用于對水中的Pb(Ⅱ)去除處理。pH對N-Fe/CNT去除Pb(Ⅱ)有較大影響,pH=6、120 min時去除效果最佳,對50 mg/L Pb(Ⅱ)的去除效率94.7%,吸附量為11.97 mg/g。

(3)等溫吸附研究表明,方程Langmuir與Freundlich的擬合程度均較高,但20,30,40 ℃時Freundlich等溫模型擬合度較好,可以說明N-Fe/CNT對Pb(Ⅱ)的吸附是以表面吸附為主,推算出最大吸附量為Qmax=15.02 mg/g。
(4)熱力學研究表明,焓變ΔH<0,熵變ΔS>0,吉布斯自由能ΔG<0,表明N-Fe/CNT對Pb(Ⅱ)的吸附是放熱、自發且以物理吸附為主的過程,ΔG在3個不同溫度下均為負值,該吸附過程主要是以熵而不是焓的變化為主。
(5)動力學研究表明,Elovich 動力學方程能較好地描述N-Fe/CNT對Pb(Ⅱ)吸附動力學行為,表明N-Fe/CNT對Pb(Ⅱ)吸附的過程主要是表面吸附。
(6)機理分析表明,N-Fe/CNT對Pb(Ⅱ)的去除主要是—OH、等官能團與其反應,以吸附和氧化還原反應為主。

