豬鏈球菌2型的分離鑒定及致病性試驗
潘建剛,張華偉,陳波,周明光,王召賀,徐高原
(武漢科前生物股份有限公司,武漢 430070)
豬鏈球菌(Streptococcussuis)可引起豬腦膜炎、關節炎、心內膜炎、敗血癥、肺炎和突然死亡[1-2],嚴重危害著養豬業的發展。根據莢膜多糖抗原的差異,可將其分為35個血清型,即1~34及1/2型[3]。對豬致病性較強的有豬鏈球菌1 型、2 型、7型和9型,尤其是豬鏈球菌2 型,不僅對豬的致病性最強,而且可感染特定人群并致死,是一種重要的人畜共患病病原菌[4]。本試驗從我國部分豬場分離出1株2型豬鏈球菌,鑒定菌株7種毒力因子基因,并用分離菌株進行了小鼠致病性試驗,以期為豬鏈球菌2型疫苗的研究提供必要條件和有利數據。
1 材料與方法
1.1 材料
1.1.1 病料來源 2014-2016年從全國部分豬場采集疑似豬鏈球菌感染病例腦樣品,腦組織有明顯的肉眼可見出血,共20份。
1.1.2 豬鏈球菌培養基 TSA(Tryptic Soy Agar)、TSB(Tryptic Soy Broth)培養基購自BD生物科技有限公司。
1.1.3 主要試劑 新生牛血清購自內蒙古金源康生物工程有限公司;革蘭氏染液購自南京建成科技有限公司;引物合成及基因測序由擎科新業生物技術有限公司完成。
1.1.4 細菌基因組DNA提取試劑盒 購于北京莊盟國際生物基因科技有限公司。
1.1.5 試驗動物 18~22 g的昆明鼠,購自湖北省實驗動物中心。
1.2 方法
1.2.1 細菌分離 將采集的20份腦樣品,分別于無菌操作臺中使用接種環挑取部分組織,均勻涂劃在加有5%新生牛血清的TSA平板中,于37 ℃條件下培養24 h,觀察結果。24 h后于無菌條件下挑取平板上的疑似菌落劃線接種于5%新生牛血清的TSA平板上,于37 ℃條件下培養24 h,觀察細菌形態。
1.2.2 PCR鑒定
1.2.2.1 DNA提取 用細菌基因組DNA提取試劑盒提取DNA,-20 ℃以下保存備用。
1.2.2.2 PCR引物 選取豬鏈球菌屬保守基因gdh(谷氨酸脫氫酶),血清型特異性基因cas2J(莢膜多糖)以及7種主要毒力因子fbps(纖連蛋白原結合蛋白)、sly(溶血素)、orf2(毒力相關因子)、mrp(溶菌酶釋放蛋白)、89k(毒力島)、gapdh(甘油醛-3-磷酸脫氫酶)和epf(胞外因子)基因,參考文獻設計引物[5-9],引物序列見表1。

表1 豬鏈球菌引物Tab 1 Primer of Streptococcus suis
1.2.2.3 PCR檢測及測序分析 PCR擴增體系:10×buffer 5.0 μL,dNTP(2.5 mmol/L)4.0 μL,引物P1(10 μmol/L)1.0 μL,引物P2(10 μmol/L)1.0 μL,模板DNA 2.0 μL,Taq酶(5 U/μL)0.25 μL,加注射用水至50 μL;反應條件為:95 ℃預變性3 min,95 ℃變性30 s,退火30 s,72 ℃延伸1 min,30個循環,72 ℃終延伸10 min。PCR產物經1.0%瓊脂糖凝膠電泳。用DNA回收試劑盒回收PCR產物,將該PCR產物連接pMD18-T載體,送擎科新業生物技術有限公司測序,并與BLAST上的相關序列比較分析。
1.2.3 形態觀察 按常規方法對分離菌株進行革蘭氏染色,普通光學顯微鏡下觀察菌體形態特征。
1.2.4 生長曲線的測定 分離菌株接種TSB液體培養基,37 ℃培養8~10 h作為種子液。再將上述種子液按培養基總體積的2%接種TSB培養基,于37 ℃搖床170 r/min振蕩培養。其間每隔2 h取樣進行活菌計數,監測24 h。
1.2.5 小鼠致病性試驗 采用半數致死量(LD50)評價分離菌的致病性,取30只雄性昆明小鼠,隨機分為6組,每組5只,其中5組作為攻毒組,一組作為對照組。濃縮菌液,調整菌液初始濃度為1.0×1010CFU/mL,進行10倍倍比稀釋,選取100~10-45個梯度,每個梯度攻毒一組小鼠,腹腔注射菌液0.2 mL,對照組腹腔注射0.2 mL生理鹽水。連續觀察14 d,記錄各組死亡情況,對死亡小鼠立即解剖,觀察病變情況,進行各臟器細菌分離、鑒定。根據Reed-Muench累加法計算分離菌株的LD50[10-11]。
2 結果與分析
2.1 細菌分離 20份腦組織分別接種TSA平板,通過挑選可疑菌落,對其純化,總共分出10株疑似菌株。在平板上可見灰白色、半透明、表面光滑、圓形、邊緣整齊的小菌落。
2.2 細菌鑒定 分離的10株細菌,用豬鏈球菌屬引物gdh進行PCR鑒定,其中3株能擴增出約695 bp大小的條帶,分別回收PCR產物進行測序,在NCBI上進行BLAST比對,顯示與豬鏈球菌對應的序列同源性在95%以上,說明分離菌株為豬鏈球菌(圖1)。
2.3 2型豬鏈球菌PCR鑒定 3株豬鏈球菌經過cas2J引物PCR鑒定,1株能擴增出長度約為387 bp大小的條帶,回收PCR產物進行測序,發現所測序列片段大小和預期片段大小相同,同時把測出的序列結果在NCBI上進行BLAST比對,顯示與對應血清型的序列同源性在95%以上,說明所擴增的基因即為目的基因(圖2)。

M:DL2000 DNA Marker;1-10:疑似菌株;11:陰性對照 M:DL2000 DNA Marker;1-10:suspicious strain;11:Negative control圖1 豬鏈球菌PCR鑒定結果Fig 1 PCR identification results for Streptococcus suis
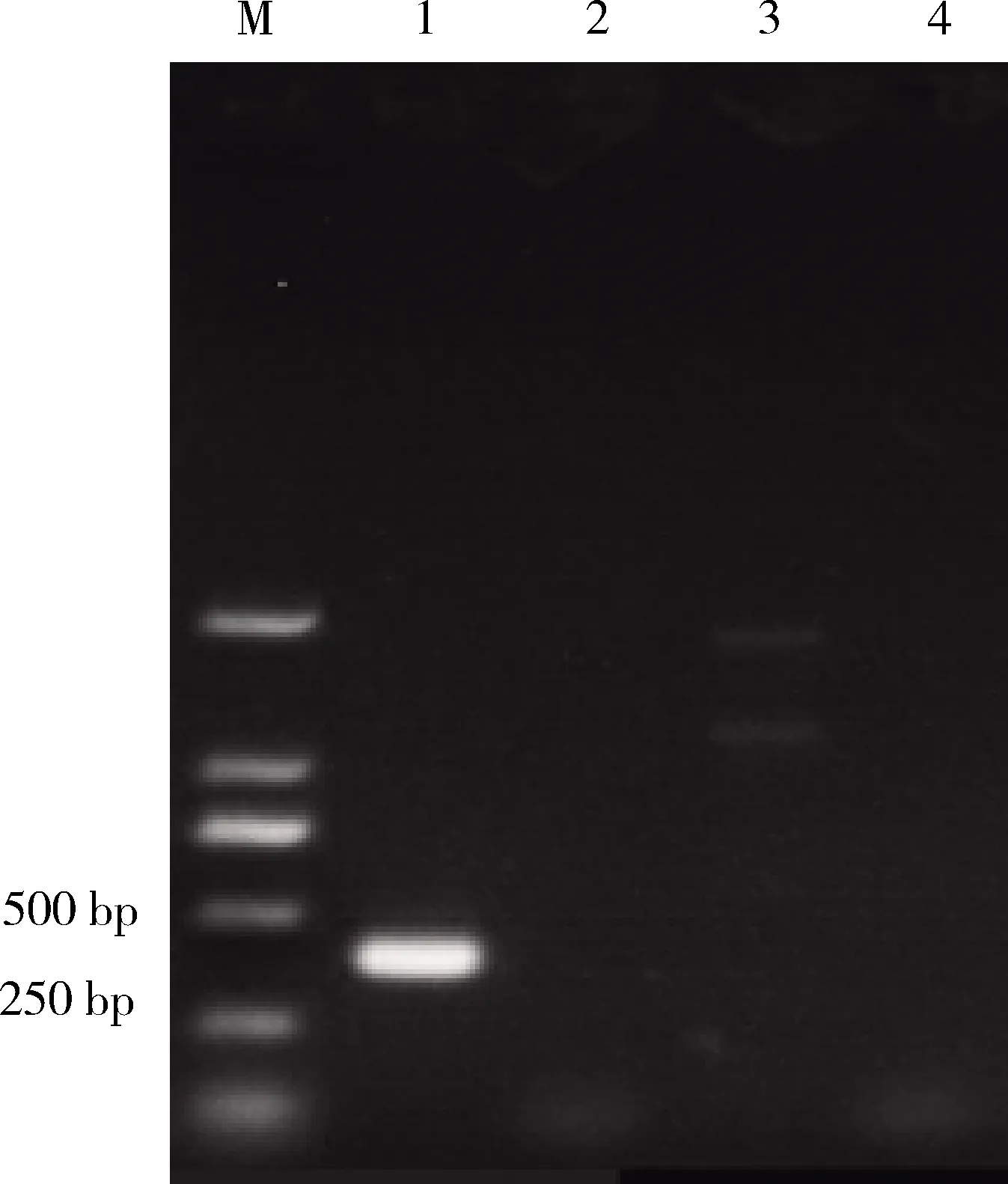
M:DL2000 DNA Marker;1-3:豬鏈球菌;4:陰性對照 M:DL2000 DNA Marker;1-3:Streptococcus suis;4:Negative control圖2 2型豬鏈球菌PCR鑒定結果Fig 2 PCR identification results for Streptococcus suistype 2
2.4 毒力因子鑒定 分離的1株2型豬鏈球菌通過 PCR檢測了mrp、epf、sly、orf2、gapdh、fbps和89k 7種毒力因子,結果7種毒力因子在分離菌株中都能檢測到(圖3)。對上述菌株毒力基因測序分析,結果發現所測序列片段大小和預期片段大小相同,同時把測出的序列結果在NCBI上進行BLAST比對,顯示與對應的毒力因子序列同源性在95%以上,說明所擴增的基因即為目的基因,分離菌株基因中幾種主要毒力因子都有分布。
2.5 形態學特性 分離的2型豬鏈球菌經過革蘭氏染色后在顯微鏡下觀察,細菌為革蘭氏陰性細小桿菌,具有多種不同形態,可見單個的球桿菌、桿菌或絲狀的菌體(圖4)。
2.6 生長曲線繪制 在液體TSB培養基中培養分離菌株,分離菌6 h左右開始進入對數生長期,培養8~10 h活菌數達到最高峰,但從10 h開始活菌數一直呈現下降趨勢。分離菌株在TSB液體培養基繁殖速度快,活菌數高(圖5)。
2.7 小鼠攻毒試驗 昆明小鼠腹腔注射不同濃度的菌液后,試驗小鼠最早于攻毒后第1天開始出現死亡現象,死亡高峰出現在攻毒后2~5 d,7 d后停止死亡。按Reed-Muench法計算,分離2型豬鏈球菌的LD50見表2。將濃縮菌液稀釋到4.8×107CFU/mL,攻毒0.2 mL,能使半數小鼠發生死亡,表明分離菌株毒力較強。
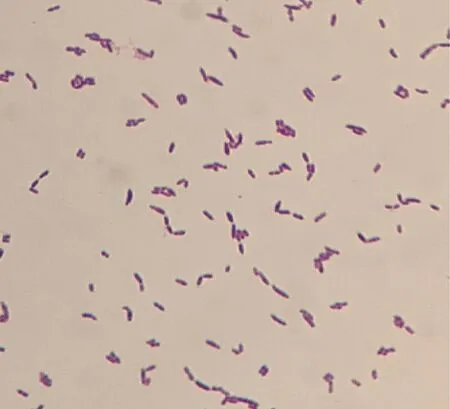
圖4 革蘭氏染色結果(100×)Fig 4 The results of Gram stain(100×)
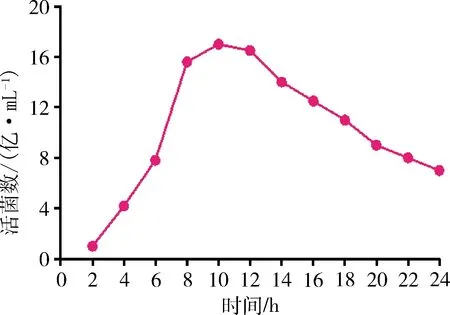
圖5 2型豬鏈球菌生長曲線Fig 5 The growth curve of Streptococcus suis type 2

表2 半數致死量(LD50)試驗結果Tab 2 The results of LD50
2.8 剖檢觀察 剖檢攻毒死亡小鼠,可見攻毒小鼠腹腔內滲出液增多,腦和各臟器出血;試驗結束后剖檢空白對照組小鼠,可見健康對照組小鼠腹腔及各器官正常。結果見圖6。分離的2型豬鏈球菌能引起小鼠的急性敗血癥及腦膜炎,導致小鼠死亡,成功在小鼠上建立攻毒模型。
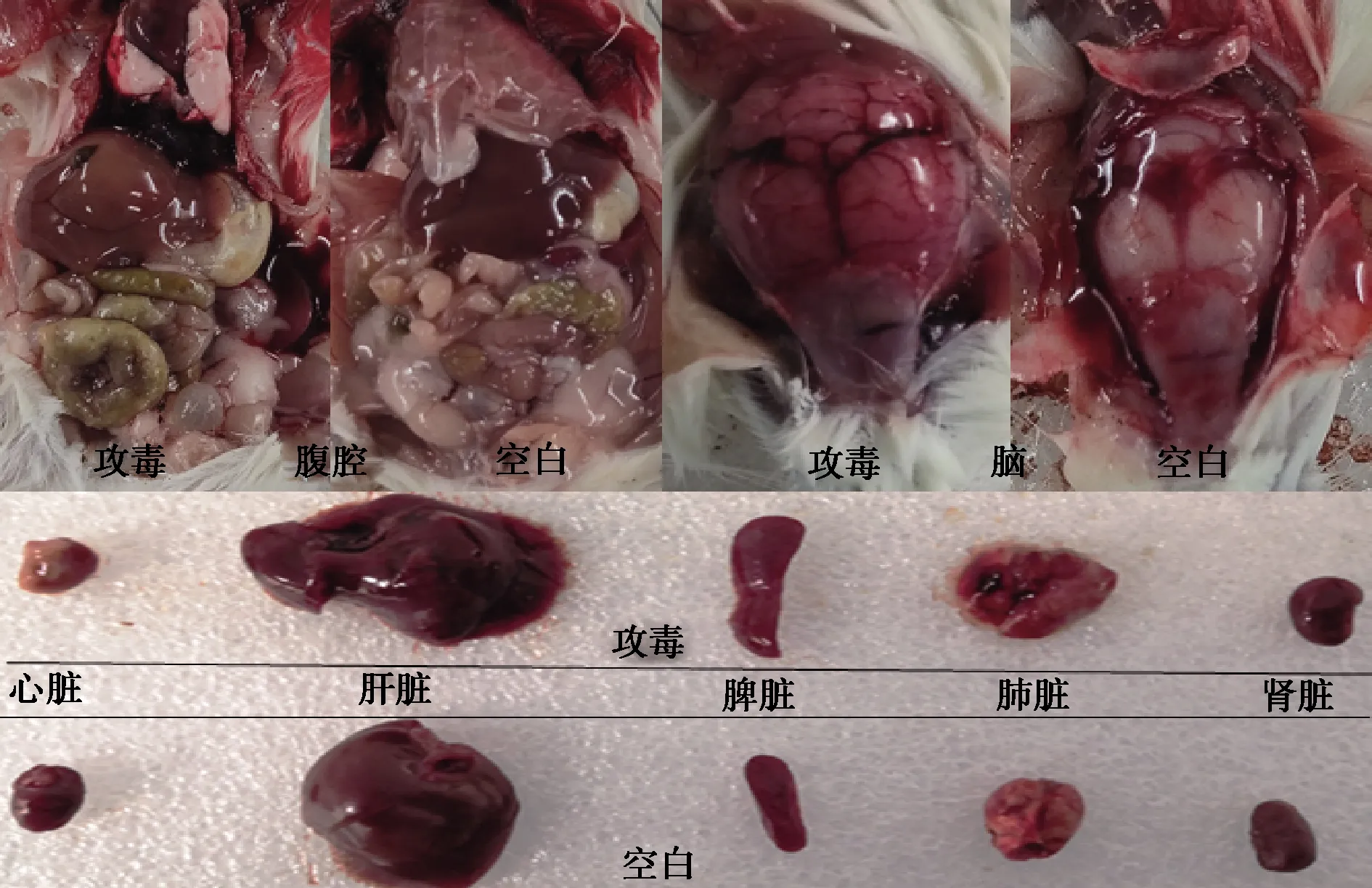
圖6 剖檢結果Fig 6 The results of anatomy
2.9 臟器細菌分離 剖檢死亡小鼠,取各臟器在無菌操作臺內進行細菌分離,結果顯示攻毒后死亡小鼠各臟器均能分離出細菌。對各臟器分離的細菌進行PCR鑒定并測序,結果表明各臟器分離菌株均為攻毒2型豬鏈球菌(圖7)。
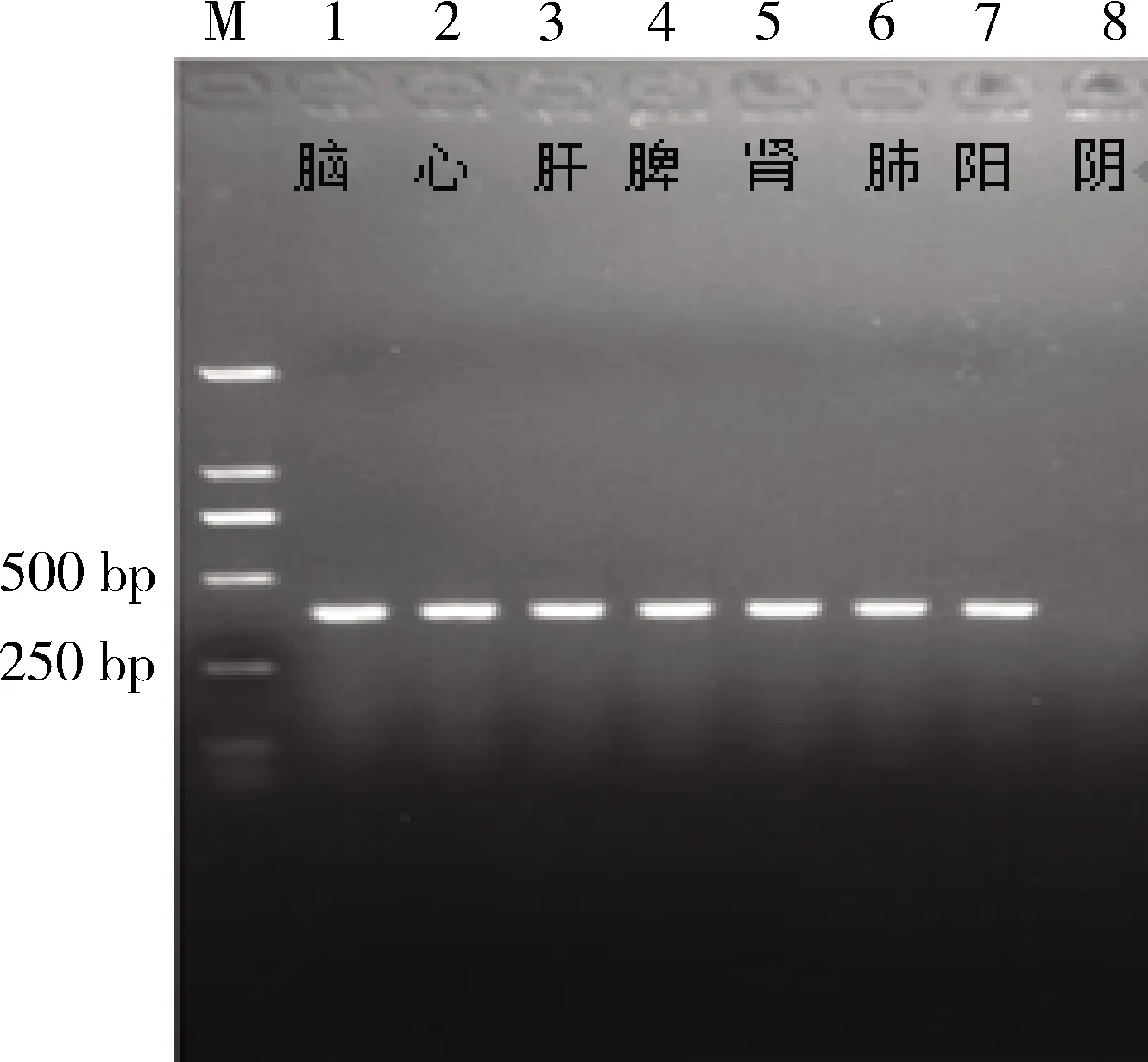
圖7 攻毒小鼠各臟器細菌分離鑒定Fig 7 Isolation and identification of bacteria from various organs of challenged mice
3 討論與小結
豬鏈球菌是一種重要的人畜共患病病原,其致病性差異很大,只有高致病力菌株才能引起豬腦膜炎、關節炎、心內膜炎、敗血癥、肺炎和突然死亡等癥狀,低致病力和無致病力的菌株常見于豬的呼吸道。在致病性血清型中2 型的致病力最強,發病率最高,流行范圍最廣,其致病性和它的毒力因子相關[12-13]。現有疫苗菌株分離年代都比較久遠,保護效果有一定的降低。本研究采集最近幾年疑似豬鏈球菌感染病例腦樣品,經過平板分離和 PCR鑒定成功獲得一株2型豬鏈球菌,PCR檢測顯示分離菌株基因中幾種主要毒力因子都有分布,在TSB液體培養基繁殖速度快,活菌數高,能引起小鼠的急性敗血癥及腦膜炎導致小鼠死亡,證明分離株毒力強,是潛在的疫苗菌株。

