17β-雌二醇對N-甲基-N-亞硝脲誘導大鼠視網膜損傷的保護效應
朱春暉,朱若晨,熊業城,陳 濤,俞小瑞,4*
(1西安交通大學醫學部基礎醫學院生物化學與分子生物學系,西安 710061;2陜西省牙頜疾病臨床研究中心;3西安交通大學口腔醫院牙周科;4西安交通大學醫學部環境與基因相關疾病教育部重點實驗室;*通訊作者,E-mail:xiaoruiy@xjtu.edu.cn)
神經退行性疾病是一類嚴重危害人類健康和影響生活質量的疾病,臨床常見疾病包括:阿爾茨海默癥、視網膜色素變性和老年性黃斑變性等。神經退行性疾病共同表現為非典型性蛋白的合成障礙、線粒體功能紊亂以及細胞凋亡的出現[1]。視網膜是由胚胎時期神經外胚葉構成的視杯發育分化而來,與大腦的起源相同。作為中樞神經系統的外延,視網膜也被稱為外周腦,因此視網膜也可作為研究中樞神經系統疾病機制與治療的重要突破口[2]。
近年來,越來越多的研究發現,雌激素在人體中具有抑制神經細胞凋亡,發揮神經保護作用的重要功能[3]。絕經婦女的雌激素水平降低,神經退行性疾病的發病率明顯增高[4]。雌激素替代療法已經成為防治該類疾病的有效手段[5]。當前,有關雌激素在中樞神經系統中的作用在神經科學領域備受關注[6]。17β-雌二醇(17β-estradiol,βE2)是體內最豐富、最有效的雌激素,本課題組前期在過氧化氫誘導的細胞和光損傷誘導的動物兩個水平,都觀察到βE2對大鼠視網膜感光細胞的神經保護作用[7,8]。N-甲基-N-亞硝脲(N-methyl-N-nitrosourea,MNU)是理想的誘導視網膜退行性變的化學誘導劑,可特異性誘導視網膜感光細胞的凋亡[9]。然而,βE2對MNU誘導的視網膜感光細胞凋亡的保護作用值得我們進一步探討。因此,本研究建立MNU誘導SD大鼠視網膜變性模型,探索βE2對感光細胞凋亡和氧化損傷的影響,為βE2在視網膜退行性疾病的臨床治療提供實驗參考和理論依據。
1 材料和方法
1.1 實驗動物分組及處理
取35日齡雌性SPF級SD大鼠72只,體質量(150±10)g,由西安交通大學醫學部動物實驗中心提供,許可證號:SCXK(陜)2007-001。24只35日齡SD雌性大鼠隨機分為對照(control)和MNU組(每組12只)。為進一步觀察βE2對MNU誘導大鼠視網膜損傷的保護作用,大鼠隨機分為生理鹽水(saline)-MNU組和βE2-MNU組(每組12只)。上述4組大鼠給藥后1 d各取6只利用TUNEL檢測視網膜凋亡細胞,給藥后7 d另取6只大鼠利用蘇木精-伊紅(HE)染色和視網膜電圖(ERG)檢測視網膜形態和功能。最后,為了揭示βE2對視網膜的保護作用和抗氧化的關系,大鼠隨機分為saline組,βE2組,saline-MNU組和βE2-MNU組(每組6只),各組藥物處理后1 d使用試劑盒檢測視網膜組織丙二醛(MDA)含量、抑制羥自由基能力及總抗氧化能力(T-AOC)。所有大鼠行卵巢摘除術后2周進行如下處理:MNU組經腹腔注射45 mg/kg MNU[9];saline組和βE2組分別經玻璃體腔注射4 μl saline或βE2(100 μmol/L);saline-MNU組經腹腔注射45 mg/kg MNU后立即經玻璃體腔注射4 μl生理鹽水;βE2-MNU組經腹腔注射45 mg/kg MNU后立即經玻璃體腔注射4 μl濃度為100 μmol/L的βE2;未做處理的同天數大鼠設置為control。
1.2 實驗試劑
鹽酸塞拉嗪(吉林方正公司);TUNEL試劑盒(武漢博士德公司);水合氯醛、酒精、二甲苯、蘇木素、伊紅(西安試劑廠);βE2、MNU、多聚甲醛(美國,Sigma公司);復方托吡卡胺滴眼液、鹽酸奧布卡因(日本,參天制藥有限公司);BCA蛋白定量試劑盒、A018羥自由基測定試劑盒、A003-1丙二醛測定試劑盒、A015-1總抗氧化能力測定試劑盒(南京建成科技有限公司)。
1.3 TUNEL技術檢測視網膜組織細胞凋亡
大鼠藥物處理后1 d,腹腔注射10%水合氯醛(3.5 ml/kg)麻醉大鼠,取眼球后頸椎脫臼處死。眼球置于4%多聚甲醛中過夜,后經酒精梯度脫水,石蠟包埋。使用組織切片機獲得5 μm厚組織切片,貼片于多聚賴氨酸修飾的載玻片,65 ℃烘箱烤干。參照TUNEL試劑盒說明書,染色前將視網膜組織切片置于60 ℃烘箱中20 min,隨后經二甲苯透明和酒精脫蠟。PBS漂洗后滴加20 μg/ml蛋白酶K,37 ℃作用10 min,隨后加入含有3%過氧化氫的甲醇封閉液室溫作用10 min。TdT酶反應液作用于組織切片,室溫避光37 ℃反應60 min后加入適量Steptativedin-HRP工作液,室溫避光37 ℃反應60 min。隨后使用DAB顯色,鏡下觀察,出現理想深度的顯色時,立即使用PBS漂洗3次,蘇木素復染。2%鹽酸分色,伊紅染數秒鐘。酒精脫水,石碳酸速過,二甲苯透明后樹脂封片,充分干燥后鏡下觀察TUNEL陽性的凋亡細胞被染色為深棕色。
1.4 視網膜組織勻漿的制備及蛋白濃度測定
大鼠藥物處理后1 d,腹腔注射10%水合氯醛(3.5 ml/kg)麻醉大鼠,用鑷子將大鼠眼瞼撐開,突出眼球,然后用刀片將角膜橫向劃開,取出的視網膜組織放入高壓處理過的EP管中,迅速將EP管放入液氮中,大鼠隨后經頸椎脫臼處死。待所有視網膜組織取材完畢后,秤重,加入預冷的9倍體積生理鹽水,將組織充分剪碎,研磨,制備10%組織勻漿。隨后,4 ℃離心機離心,3 000 r/min,離心10 min,吸取上清,進一步使用BCA蛋白定量試劑盒檢測視網膜中蛋白含量,為后續檢測視網膜組織勻漿中MDA、抑制羥自由基能力及T-AOC做準備。
1.5 MDA的測定
大鼠藥物處理后1 d,取組織勻漿,按照MDA試劑盒說明書進行試劑配制和檢測,分光光度儀于532 nm處測定各管OD值,使用說明書提供的公式計算樣品中MDA含量:MDA(nmol/mg)=(測定管OD值-對照管OD值)/(標準管OD值-空白管OD值)×標準管濃度÷蛋白含量(mg/ml)。其中,標準管濃度為10 nmol/ml。
1.6 抑制羥自由基能力檢測
大鼠藥物處理后1 d,取組織勻漿,按照羥自由基試劑盒說明書進行試劑配制和檢測,分光光度儀于532 nm處測定各管OD值,利用說明書提供的公式計算組織抑制羥自由基的能力:抑制羥自由基能力(U/ml)=(對照管OD值-測定管OD值)/(標準管OD值-空白管OD值)×標準管濃度÷蛋白含量(mg/ml)。其中,標準管濃度為8.824 mmol/L。
1.7 T-AOC的測定
大鼠藥物處理后1 d,取組織勻漿,按照T-AOC試劑盒說明書進行試劑配制和檢測,分光光度儀于520 nm處測定各管OD值,并利用說明書提供的公式計算組織中T-AOC:T-AOC(U/mg)=(測定管OD值-對照管OD值)×(反應液總體積/取樣量)÷0.3÷蛋白含量(mg/ml)。
1.8 視網膜電圖(electroretinogram,ERG)檢測視網膜功能
大鼠單次給藥后7 d,大鼠暗適應24 h后,將30 μl鹽酸塞拉嗪溶于10%水合氯醛中,配成大鼠ERG專用麻醉劑,按照3.5 ml/kg的劑量麻醉大鼠,并用復方托吡卡胺滴眼液散瞳。待大鼠進入深麻醉狀態時,在其眼球表面滴加鹽酸奧布卡因滴眼液,表面麻醉。大鼠平趴于動物平臺上,左側頰部插入參考電極,尾部皮下插入接地電極,記錄電極放置于左眼角膜中央,力度以剛剛接觸角膜為宜。在角膜和電極間滴加一滴生理鹽水,調節雙眼阻抗系數穩定小于3%。所有以上操作在微弱紅光下進行,測試時使用強度為0.011 cd*s/m2的單次白色閃光刺激大鼠,閃光刺激間隔1 min,按順序記錄視桿細胞反應(Rod-ERG)和最大混合反應(Max-ERG)。
1.9 蘇木素伊紅染色(hematoxylin and eosin staining,HE)觀察視網膜組織結構
大鼠單次給藥后7 d,腹腔注射10%水合氯醛(3.5 ml/kg)麻醉大鼠,取眼球后頸椎脫臼處死。眼球置于4%多聚甲醛中過夜,后經酒精梯度脫水,石蠟包埋,使用組織切片機獲得5 μm厚組織切片,65 ℃烘箱烤干。將載有組織切片的載玻片放入二甲苯脫蠟,隨后置于不同梯度酒精進行復性,蘇木素、伊紅染色,樹脂封片進行HE染色,鏡下觀察視網膜組織結構。
1.10 統計學分析
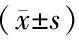
2 結果
2.1 MNU誘導SD大鼠感光細胞的凋亡
本研究首先使用TUNEL、HE和ERG技術檢測腹腔注射45 mg/kg MNU對大鼠視網膜感光細胞凋亡、視網膜結構和功能的影響。TUNEL結果顯示,與control組相比,MNU組視網膜外核層(outer nuclear layer,ONL)出現了大量的凋亡細胞(棕色細胞);HE結果顯示,MNU組大鼠視網膜的ONL和內核層(inner nuclear layer,INL)與control組相比均出現了細胞數量的減少,視網膜組織結構紊亂,色素上皮細胞遷移至原本ONL的位置;ERG結果顯示,control組Rod-ERG(a波均值74.56±12.77,b波均值189.96±18.8),Max-ERG(a波均值78.37±16.54,b波均值174.00±15.37),而MNU組出現了熄滅型電生理的表現,檢測不出來Rod-ERG和Max-ERG的值(見圖1)。本實驗使用MNU在SD大鼠中成功構建了感光細胞凋亡模型,為后續實驗提供模型基礎。
2.2 βE2保護大鼠視網膜免受MNU誘導的損傷
為了觀察βE2是否對MNU誘導大鼠視網膜損傷具有保護作用,本研究繼續使用TUNEL、HE和ERG檢測進行評估。TUNEL結果顯示,與saline-MNU組相比,βE2-MNU組大鼠視網膜ONL中的凋亡細胞數明顯減少(棕色細胞);HE染色結果顯示saline-MNU組ONL、INL發生融合,而βE2-MNU組雖然ONL的結構發生了一定紊亂,但是結構基本完整,ONL、INL的界限還依稀可見;ERG結果顯示,βE2-MNU組與saline-MNU組相比,Rod-ERG和Max-ERG反應a、b波均有明顯的恢復(見圖2)。

ONL:外核層;INL:內核層;GCL:神經節細胞層;Rod-ERG:視桿細胞反應視網膜電圖;Max-ERG:最大混合反應視網膜電圖圖2 βE2抑制視網膜細胞凋亡、保護視網膜結構與功能Figure 2 βE2 inhibits retinal cell apoptosis, and protects retinal structure and its function
2.3 βE2抵抗視網膜的氧化損傷
為了進一步揭示βE2對視網膜的保護作用是否和抗氧化有關,我們在各組藥物處理后1 d檢測了MDA、抑制羥自由基能力和T-AOC。各組大鼠藥物處理后1 d,與saline組相比,saline-MNU組視網膜組織內MDA的含量顯著增加,差異有統計學意義(P<0.05);與saline-MNU組相比,βE2-MNU組玻璃體腔注射βE2后視網膜中的MDA含量明顯降低,差異有統計學意義(P<0.05,見圖3)。
各組大鼠藥物處理后1 d,與saline組相比,saline-MNU組視網膜組織抑制羥自由基的能力顯著減弱,差異有統計學意義(P<0.05)。與saline-MNU組相比,βE2-MNU組視網膜組織抑制羥自由基的能力顯著增強,差異有統計學意義(P<0.05,見圖4)。

與saline組相比,*P<0.05;與saline-MNU組相比,#P<0.05圖3 大鼠處理后1 d βE2減少視網膜組織中MDA的含量Figure 3 Inhibitory effect of βE2 on MDA content in the retinal tissue at day 1 after treatment

與saline組相比,*P<0.05;與saline-MNU組相比,#P<0.05圖4 大鼠藥物處理后1 d βE2增強視網膜組織抑制羥自由基能力Figure 4 Effect of βE2 on hydroxyl radicals in the retinal tissue at day 1 after treatment
各組大鼠藥物處理1天后,與saline組相比,saline-MNU組視網膜組織T-AOC的能力顯著減弱,差異有統計學意義(P<0.05)。與saline-MNU組相比,βE2-MNU組視網膜組織T-AOC的能力顯著增強,差異有統計學意義(P<0.05,見圖5)。

與saline組相比,*P<0.05;與saline-MNU組相比,#P<0.05圖5 大鼠藥物處理后1 d βE2增強視網膜組織T-AOCFigure 5 Effect of βE2 on T-AOC capacity in the retinal tissue at day 1 after treatment
3 討論
視網膜退行性疾病以細胞凋亡為主要病理特征,然而,由于人類視網膜退行性疾病病因復雜,臨床缺乏有效的治療手段,因而構建視網膜退行性疾病動物模型來研究該類疾病的致病機制,尋找有效的治療方法,顯得十分重要。MNU作為一種烷化劑,通過使感光細胞DNA甲基化引發DNA突變,最終導致感光細胞凋亡。MNU誘導的大鼠視網膜感光細胞凋亡模型,與視網膜退行性疾病特征類似,且具有一次腹腔給藥、建模時間短、重復性好、經濟實用、便于操作等優點[10]。在本研究中,45 mg/kg的MNU經腹腔注射SD大鼠1 d后出現視網膜感光細胞凋亡,7 d后視網膜結構紊亂、功能下調,成功構建了MNU誘導的感光細胞凋亡模型,為后續實驗研究奠定良好的模型基礎。
大量的研究表明雌激素具有抑制神經細胞凋亡的作用。本課題組前期在光損傷誘導的感光細胞凋亡動物模型中,觀察到βE2具有抗凋亡保護視網膜感光細胞的作用[7,8]。為了探究βE2是否也能抵抗MNU誘導的視網膜感光細胞凋亡,發揮神經保護作用,我們在MNU誘導的視網膜感光細胞凋亡模型中,通過玻璃體腔注射βE2與注射saline相比,注射βE2后大鼠ERG的a、b波明顯恢復,ONL細胞丟失明顯改善,感光細胞的凋亡顯著減少,這些結果表明βE2具有抑制MNU誘導視網膜損傷的作用。MDA的含量常常反映機體內脂質過氧化的程度,間接反映細胞損傷的程度。羥基自由基是一種破壞能力極強的氧化劑,DNA受到羥自由基的攻擊后,會發生堿基的損傷、核酸斷裂等嚴重的氧化損傷,因此選擇體內抑制羥自由基能力作為檢測指標。同時,機體存在多種抗氧化物質,以便清除體內ROS,阻止氧化應激的產生,因此,檢測組織內T-AOC具有重要的生物學意義。為了揭示βE2是否通過抗氧化機制發揮其抑制MNU誘導視網膜損傷的作用,我們首先檢測了MNU腹腔給藥后視網膜組織中MDA的含量及抗羥自由基能力和T-AOC能力,發現MNU處理后視網膜組織中MDA的含量顯著上升,而抑制羥自由基能力和T-AOC能力均顯著下降,說明視網膜組織處于氧化應激狀態。而當玻璃體腔注射βE2后可以明顯逆轉上述指標,表明βE2具有提高視網膜組織抗氧化能力,降低氧化應激反應,實現抵抗MNU誘導大鼠感光細胞凋亡的神經保護作用。
雌激素發揮抗氧化作用的分子機制目前認為主要有兩種途徑:①雌激素分子本身具有抗氧化的性質,這是由于類固醇分子的A環C3位上存在的羥基,可以直接清除機體的自由基。研究發現人工合成雌激素的同型異質體ZYC-5,雖然缺乏激活經典雌激素受體(estrogen receptor,ER)的活性,卻能通過它的自由基清除功能保護皮質神經元,對抗N-甲基-D-天冬氨酸誘導的壞死及NMDA受體拮抗劑誘導的壞死和凋亡[11];②雌激素能提高神經細胞內抗氧化酶的活性,提高自由基清除速率、減少脂質過氧化物產物的堆積,從而減少細胞凋亡的發生[12]。在本研究中,βE2發揮抗氧化作用的分子機制可能也存在上述兩種途徑,但這還需要進一步研究證實。
βE2發揮抗凋亡神經保護作用的信號通路主要通過經典的基因組途徑和非基因組途徑。在經典基因組途徑中,βE2與靶細胞細胞質中的ER結合,引起受體構象變化,導致二聚化,受體易位至細胞核與DNA上ER原件結合,從而定位或靠近靶基因啟動子,啟動下游基因表達[13]。在βE2介導的非基因組通路中,βE2與細胞膜上的受體結合,快速激活多條信號通路,調控下游蛋白,發揮抗凋亡保護神經細胞的作用[14]。βE2可同時啟動基因組和非基因組機制,完成多種生理功能[15]。本研究中βE2能有效抑制MNU引起的視網膜結構和功能損傷,抑制視網膜細胞的凋亡,然而,具體通過經典或非經典途徑發揮效用,還需要進一步研究。
綜上所述,本研究應用MNU誘導SD大鼠視網膜感光細胞凋亡,并以此作為建立研究視網膜退行性疾病的動物模型。通過玻璃體腔注射βE2,觀察βE2在MNU誘導感光細胞凋亡動物模型中的神經保護作用,初步探討βE2保護作用的機制可能與βE2降低MDA含量,抗羥自由基能力和T-AOC的上升有關。然而,雌激素神經保護作用的分子機制尚需更深入的研究,最終為雌激素在神經退行性疾病中的臨床應用提供理論依據與指導。

