馬鈴薯氣孔密度表皮模式因子StSTOMAGEN的克隆和功能分析
王艷麗,謝 天,張春麗,李娟娟,劉溢健,李紅兵,殷俐娜,王仕穩,鄧西平,,可慶波
(1.西北農林科技大學生命科學學院,陜西 楊凌 712100; 2.西北農林科技大學水土保持研究所,陜西 楊凌 712100)
隨著全球氣候變化和生態環境的惡化,植物經常會遭受到高溫、高鹽、干旱等各種各樣的非生物脅迫[1],而干旱脅迫會影響植物的生長發育、地理分布以及農作物的產量[2]。因此,提高農作物的抗旱性,保證干旱脅迫下農作物的產量對保障全球糧食安全具有重要意義。
氣孔是高等植物莖葉等器官表皮上由1對保衛細胞特化而成的小孔結構,在植物蒸騰作用、呼吸作用和光合作用中發揮重要作用[3]。植物通過氣孔吸收CO2進行光合作用,從而促進自身生長;同時,植物通過氣孔的蒸騰作用推動物質運輸[4]。植物完成自身生長需要在最大化光合作用效率的同時最小化水分流失[5],所以氣孔調控對于植物生存是至關重要的。
隨著陸地植物的進化,氣孔的形成方式也經歷了一系列的演化[4],但是大量研究表明植物氣孔發育都經歷不對稱分裂、細胞命運轉化、胞間信號轉導等一系列復雜的發育調控事件[6],其分布幾乎都遵循“單細胞間隔法則(One cell spacing)[7]”。轉錄因子、信號肽以及促分裂原活化蛋白激酶信號等在氣孔發育過程中發揮重要作用[6]。目前已發現的在氣孔發育過程中發揮作用的細胞間信號轉導因子都是屬于類表皮模式因子家族(EPIDERMAL PAT-TERNING FACTOR-LIKE family, EPFL)的小分子分泌多肽,這些多肽通常具有N末端的分泌信號序列和C末端的相對保守的6個或8個半胱氨酸殘基, 前者在蛋白成熟過程中被剪切掉, 后者可能參與形成分子內二硫鍵[4]。擬南芥的EPFL家族包含11個成員[9],EPF1和EPF2是以負調控因子的作用來調節特定時期的氣孔發育。EPF1是最早發現的EPFL家族成員, 該基因在晚期的擬分生細胞、保衛母細胞和早期的保衛細胞中表達,EPF2的氨基酸序列與EPF1有很高的同源性,其作用時間早于EPF1,在早期的氣孔譜系細胞中表達[10]。EPF1和EPF2都依賴類受體膜蛋白TOO MANY MOUTHS(TMM)和ER家族(ERECTA family,ERf)類受體激酶發揮功能[11]。而STOMAGEN是EPFL家族中目前已知唯一的正調控因子,其蛋白質包括N末端分泌信號序列,前肽結構域和成熟肽結構域[4]。過表達STOMAGEN基因可以產生簇狀氣孔群, 而利用RNAi敲除STOMAGEN則使得植株幾乎不形成氣孔,這些均表明STOMAGEN能夠促進氣孔發育[12]。與EPF1和EPF2類似,STOMAGEN發揮作用需要TMM存在。這表明STOMAGEN可能是通過與EPF1和EPF2競爭性地結合TMM從而促進氣孔的形成[4]。前人研究表明,細胞中STOMAGEN的表達水平與氣孔密度呈正相關,在擬南芥中過表達STOMAGEN可以顯著增加氣孔密度,同時植株的光合作用得到明顯改善[12],但是STOMAGEN基因在植物逆境脅迫響應中的作用尚不清楚。
本研究克隆了馬鈴薯氣孔密度表皮模式因子StSTOMAGEN基因,分析了該基因的表達模式,并通過農桿菌介導的遺傳轉化獲得了過量表達StSTOMAGEN基因的擬南芥株系。通過分析轉基因擬南芥的氣孔密度和抗旱性,初步揭示StSTOMAGEN在氣孔運動及植物干旱脅迫響應中的作用,以期為通過基因編輯技術改變馬鈴薯氣孔密度調節因子StSTOMAGEN基因的表達水平,培育抗旱節水型馬鈴薯新品種奠定基礎。
1 材料與方法
1.1 試驗材料
植物材料有擬南芥[哥倫比亞生態型(Col-0)]和馬鈴薯(大西洋品種)。將擬南芥種子在超凈臺中用75%的酒精、1%次氯酸鈉溶液消毒后,用滅菌水沖洗3次,4℃低溫處理3 d。隨后播種在MS [1/2MS+3%蔗糖+0.5%瓊脂(pH 5.6~5.8)]培養基,放于光照培養箱中(光周期為14 h/10 h,光/暗、相對濕度80%、光照強度120 μmol·m-2·s-1、溫度22℃)培養。生長7 d后,選取長勢一致的幼苗移栽到基質∶蛭石∶珍珠巖=3∶1∶1的土壤中,放置于22℃,16 h/8 h,光/暗,60%的相對濕度的溫室中生長。
將繼代培養15 d長勢一致的馬鈴薯組培苗轉移至花盆(7 cm×7 cm×6.5 cm)中,生長溫度為25℃,相對濕度為60%,光周期為16 h/8 h(光/暗),光照強度為120 μmol·m-2·s-1。馴化1周,將馬鈴薯苗轉移至溫室中培養45 d。將馬鈴薯植株的莖尖、莖、葉、根和塊莖進行取樣,迅速放于液氮冷凍用于RNA的提取。對于不同脅迫處理,將繼代培養18 d的馬鈴薯組培苗移至霍格蘭營養液中培養,3周后對植株進行逆境處理。包括:5%的聚乙二醇(PEG6000)溶液、100 mM NaCl溶液、50 μm脫落酸(ABA)溶液,分別在處理0、1、4、8、12、16、20 h和24 h后從頂部取第二片完全展開葉并立即置于液氮中冷凍,用于脅迫條件下基因表達模式研究。
1.2 研究方法
1.2.1 RNA的提取及熒光定量PCR 采用Trizol(Invitrogen)提取馬鈴薯不同組織的總RNA,用DNase進行純化處理。然后取2 μg純化后的總RNA,用TaKaRa公司的反轉錄試劑盒PrimScriptTMII 1st Strand cDNA Synthesis Kit,按照說明書進行反轉錄反應。得到cDNA后進行實時定量PCR,實時定量 PCR 采用QuantiTect SYBR Green PCR 試劑盒(TaKaRa,Dalian,China),用LightCycler 480 II系統(Roche,Basel,Switzerland)進行相關基因表達量分析。qRT-PCR所用的反應體系:2× UltraSYBR Mixture 10 μL,上游引物(10 mmol·L-1)1 μL,下游引物(10 μmol·L-1)1 μL,cDNA 1 μL,ddH2O 7 μL,共20 μL。最后采用 2-ΔΔCT法進行定量數據分析,每一處理進行3次生物學重復。引物序列見表1。
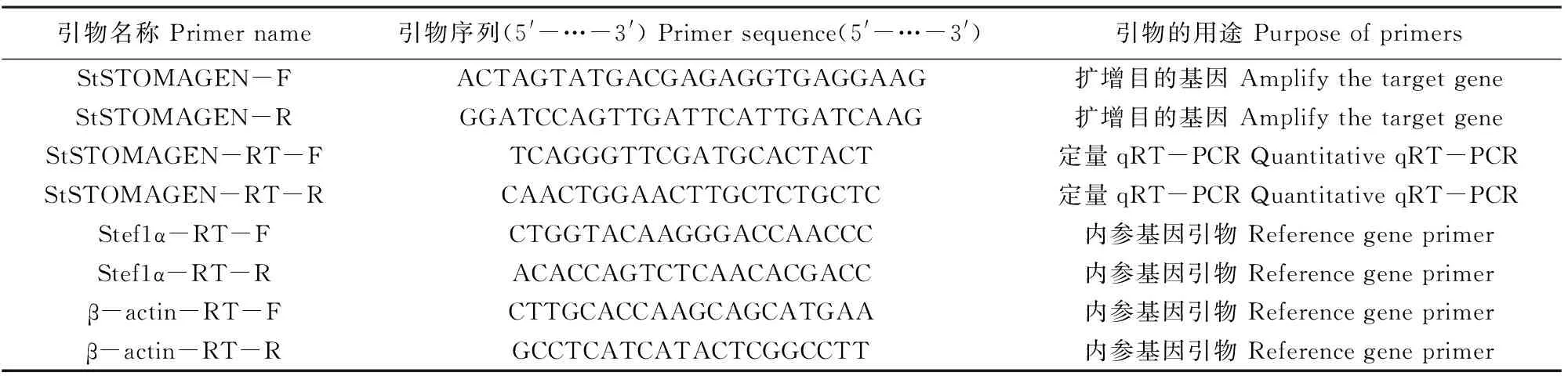
表1 研究所用引物序列
1.2.2StSTOMAGEN基因的克隆和表達載體的構建 以1.2.1中獲得的馬鈴薯的cDNA為模板,按照KOD Plus-Neo(Toyobo, Osaka, Japan)試劑盒的說明書進行PCR擴增,得到目的基因StSTOMAGEN,引物見表1。PCR反應程序為:95℃預變性3 min,95℃ 變性10 s,55℃ 退火30 s,72℃延伸30 s,35個循環。利用SpeI和BamH I對克隆序列和表達載體pCAMBIA1305進行雙酶切,利用DNA連接酶(TaKaRa,大連)連接獲得重組質粒,并將其轉化至農桿菌(Agrobacterium)EHA105。
1.2.3 系統進化分析 以StSTOMAGEN基因推導的氨基酸序列為目標序列在NCBI BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)網站上進行BlastP分析,獲得各物種同源基因的蛋白序列,并用MEGA 6.0軟件對StSTOMAGENA蛋白序列與薺菜(Capsellarubella, XM_023779504.1)、亞麻薺(Camelinasativa, XR_757444.2)、琴葉擬南芥(Arabidopsislyrate,XM_002863154.2)、擬南芥(Arabidopsisthaliana,NM_117366.4)、山崳菜(Eutremasalsugineum, XM_006414920.2)、白菜(Brassicarapa, XM_009109421.3)、石榴(Punicagranatum, XM_022160362.1)、大豆(Glycinemax, NM_001255343.2)、木薯(Manihotesculenta, XM_021776765.1)、橡膠樹(Heveabrasiliensis, XM_021821217.1)、猩紅猴面花(Erythrantheguttatus, XM_012979755.1)、番茄(Solanumlycopersicum, XM_004245347.4)、辣椒(Capsicumannuum, XM_016723913.1)、胡蘿卜(Daucuscarota, XM_017397194.1)和煙草(Nicotianatabacum, XM_016654878.1)的蛋白序列進行比對,并使用最大似然法生成系統進化樹,分析StSTOMAGEN的進化關系。
1.2.4StSTOMAGEN的亞細胞定位 將含有pCaMV35S-StSTOMAGEN-GFP表達載體的農桿菌和含P19沉默抑制基因表達載體的農桿菌用注射緩沖液(10 mM MES,10 mM MgCl2和100 μM acetosyringone)稀釋到OD600=1,然后按照1∶1將二者混合后,注射到4周齡的煙草葉片中,每株注射3片葉片,每片葉片4個注射點,室溫暗處培養3 d后,通過生物激光共聚焦顯微鏡(Leica TCs SP2,488 nm,633 nm)觀察綠色熒光蛋白(GFP)信號,根據熒光的位置確定蛋白的亞細胞定位。
1.2.5 轉基因擬南芥的獲得 將pCaMV35S-StSTOMAGEN-GFP表達載體轉化至農桿菌GV3101后,利用浸花法[13]將該重組載體對擬南芥Col-0進行遺傳轉化,獲得轉基因植株(稱為ST),收獲浸染后的T0代種子,消毒后再播種于含有25 μg·mL-1潮霉素的1/2 MS固體培養基上,種子萌發后,根部正常延伸且葉片保持綠色的即可初步認定為篩選的T1代轉基因陽性苗,移栽至土壤中進一步生長,收獲T2代種子。在1/2 MS篩選培養基(含25 μg·mL-1潮霉素)繼續篩選,可獲得純合株。最后分別進行DNA水平(基因組DNA的PCR)和RNA水平(qRT-PCR)鑒定,確定T-DNA成功插入擬南芥基因組并且StSTOMAGFEN基因在擬南芥中得到表達。
1.2.6 氣孔密度的觀察 分別取生長30 d的ST和WT擬南芥幼苗同一葉位、長勢健康的葉片,根據Sugano等[12]的方法,首先用固定液(無水乙醇∶乙酸=9∶1)對葉片固定7 h以上,然后用脫色液(水合氯醛溶液∶水∶甘油=8∶2∶1)進行脫色,最后用1 μg·mL-1番紅染色,在奧林巴斯BX51電子顯微鏡(Olympus America Inc., Melville, NY, USA)下觀察氣孔數目。每片蓮座葉上表皮選取4~6個視野進行拍照,統計氣孔數目,計算氣孔密度(個·mm-2),每組重復3次。
1.2.7 轉基因擬南芥的光合指標測定 待ST和WT擬南芥生長6周后,選取同一葉位的葉片用LiCOR 6800(Li-COR, Lincoln, NE, USA)便攜式光合作用測定系統,在9∶00—12∶00進行測定。通過開放式氣路,設定溫度為25℃,CO2濃度為719.6 mg·m-3,空氣相對濕度為50%,光強梯度為1 000、800、600,400、300、250、200、150、100、50 μmol·m-2·s-1和0 μmol·m-2·s-1PAR,間隔2~3 min的條件下測定葉片在每一光強下的凈光合速率(Pn)、氣孔導度(gs)和蒸騰速率(Tr)。同時使用FluorPen FP 100(PSI, Drasov, Czech Republic)測定Fv/Fm,即PSⅡ最大光量子產量。
1.2.8 葉片相對含水量的測定 對于對照和干旱處理的擬南芥,采用烘干稱量法測定葉片相對含水量。每組處理采集5片新鮮的完全展開葉,迅速測定其鮮重(FW),然后將葉片浸入去離子水中,放置24 h后稱其飽和鮮重(SW),之后將葉片置于烘干箱內烘至恒量,稱其干重(DW),采用以下公式計算葉片相對含水量:
1.2.9 離體葉片水分散失速率測定 摘取生長6周的WT和ST植株的相同葉位的成熟葉片,置于25℃環境下,自然風干2 h。每10 min測1次樣品重量,重復3次。葉片失水率=(鮮重-風干后重量)/鮮重×100%。
1.2.10 葉面積測定 為了測定不同株系擬南芥的葉面積,將正常供水與干旱處理后采的新鮮葉片用掃描儀Epson Perfection V700 Photo scanner(Seiko Epson Corporation,Beijing,China)掃描后,用WinRRHIZO PRO 2009軟件(Regent Inc.,Quebec,Canada)對其葉面積進行統計,每個株系重復3次。
1.2.11 開花時間測定 參照Zhai等[14]的方法,將移栽后的擬南芥放于光照培養箱,按1.1中的條件正常光照培養生長,等擬南芥抽薹1 cm后,統計蓮座葉葉片數,用葉片數衡量開花時間。
1.2.12StSTOMAGEN過表達擬南芥的抗旱性分析 用干旱法[15]測定轉基因擬南芥的抗旱性。分別將正常生長6周的ST和WT擬南芥干旱處理7 d后,然后復水2 d。在干旱處理5 d后觀察植株的抗旱表型并統計轉基因和野生型擬南芥的存活率并拍照,同時測量WT與ST擬南芥的地上部生物量、H2O2含量、相對含水量(RWC)、水分利用效率(iWUE)和其他氣體交換參數。
1.2.13 DAB染色 取WT 和ST擬南芥同一葉位成熟葉片在自然條件下,風干1 h后,使用DAB(3,3’-diaminobenzidine-HCl)染色。然后抽真空2 min,去除染色液,加入適量的脫色液(無水乙醇)于60℃烘箱中進行脫色。
1.2.14 H2O2含量測定 參照過氧化氫含量測定試劑盒(Solarbio,Beijing,China)說明書測定WT和ST轉基因擬南芥植株的過氧化氫含量,每個樣品重復3次。
1.2.15 數據分析 試驗數據采用Microsoft Excel 2010處理,用 SPSS17. 0(version 17.0; SPSS, Chicago, IL, USA)統計分析軟件進行方差分析和Duncan顯著性檢驗。
2 結果與分析
2.1 StSTOMAGEN基因的克隆及進化樹分析
通過Joint Genome Institute Phytozome數據庫(www.phytozome.com),利用基于同源性的BLAST搜索(DOE JGI,Walnut Creek,CA,USA)從馬鈴薯中分離出StSTOMAGEN基因的cDNA,其開放閱讀框(ORF)長度為288 bp,編碼含96個氨基酸的蛋白質。利用MEGA 6.0軟件將StSTOMAGEN的氨基酸序列與其他15個物種的蛋白序列進行分析構建進化樹(圖1A),發現馬鈴薯StSTOMAGEN與番茄SlSTOMAGEN親緣關系最近,同源性最高。通過比較StSTOMAGEN和AtSTOMAGEN的氨基酸序列發現,StSTOMAGEN在N端含有信號肽序列,在C端含有6個保守的半胱氨酸殘基(圖 1B),這表明StSTOMAGEN基因在功能上存在潛在的保守性。
2.2 StSTOMAGEN基因的表達模式
為了進一步驗證StSTOMAGEN的組織表達模式,通過qRT-PCR方法檢測StSTOMAGEN基因在馬鈴薯不同組織中的表達情況。結果顯示,StSTOMAGEN基因主要在葉片中表達,在頂端未展開葉中的表達量最高,約是塊莖的200倍(圖 2A)。同時,StSTOMAGEN基因的表達量會隨著葉位的下降而下降,在新葉中表達量較高,而在底部老葉中的表達量較低。
此外,為了研究StSTOMAGEN在細胞中的表達位置,將StSTOMAGEN-FP 融合表達載體注射到煙草葉片,用激光共聚焦顯微鏡觀察融合蛋白的亞細胞定位。結果表明,StSTOMAGEN-GFP融合蛋白的熒光均勻分布于細胞間隙和細胞核,因此可以推測StSTOMAGEN基因編碼的蛋白主要定位在植物的細胞間隙和細胞核(圖 2B)。
隨后,對馬鈴薯植株進行不同的非生物脅迫處理,發現在正常條件下,該基因的表達量在一天中呈現周期性變化,長日照條件下(16 h/8 h,光/暗),在授時因子為 20 h 時表達量達到最高。PEG模擬干旱脅迫處理后,其表達量在4 h時達到峰值,ABA和NaCl脅迫處理后,其表達水平呈現出持續降低的趨勢(圖 3)。
2.3 過表達StSTOMAGEN基因擬南芥的分子鑒定
通過浸花法將含有StSTOMAGEN基因過表達載體的農桿菌EHA105對擬南芥進行遺傳轉化。經過潮霉素抗性篩選,獲得8個T3代純合株系,以野生型擬南芥為對照,對ST轉基因擬南芥葉片進行PCR檢測,結果如圖4A所示,在8株轉基因擬南芥的基因組內均檢測到目的片段,而在WT擬南芥中沒有檢測到,說明StSTOMAGEN基因已經整合到擬南芥基因組。qRT-PCR結果如圖4B,結果表明,8個ST株系的StSTOMAGEN表達水平都顯著升高。選取表達量較高的ST 7-3和ST 26-6進行后續試驗。通過觀察氣孔密度發現,這兩個株系葉片的氣孔密度顯著增大(圖4C和5B),相對于WT,分別增加了83.4%和57.2%(圖4C),同時,地上部生物量也顯著增大(圖5A和C)。此外,WT與ST擬南芥的開花時間(圖4D)和葉面積(圖5D)沒有顯著差異,開花時蓮座葉的數目都為10片左右。
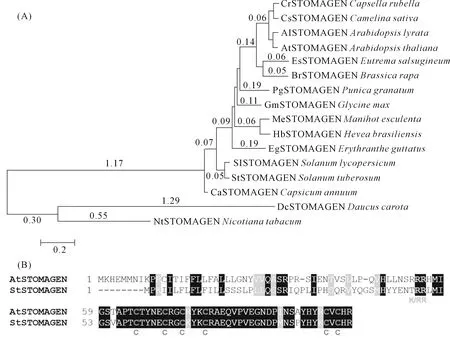
注:(A)StSTOMAGEN蛋白與其他15個不同物種StSTOMAGEN蛋白的進化分析。(B)馬鈴薯StSTOMAGEN和AtSTOMAGEN氨基酸序列比較。黑色陰影表示相同的氨基酸殘基,灰色陰影表示相似的氨基酸殘基,C表示保守的半胱氨酸殘基。Note:(A) Phylogenetic analysis of the StSTOMAGEN protein in 15 plant species. (B) Comparison of StSTOMAGEN and AtSTOMAGEN amino acid sequences. Identical and similar amino acid residues are shaded in black and gray, respectively. C is conservative cysteine residue.圖1 StSTOMAGEN蛋白的進化分析Fig.1 Phylogenetic analysis of the deduced StSTOMAGEN amino acid sequence
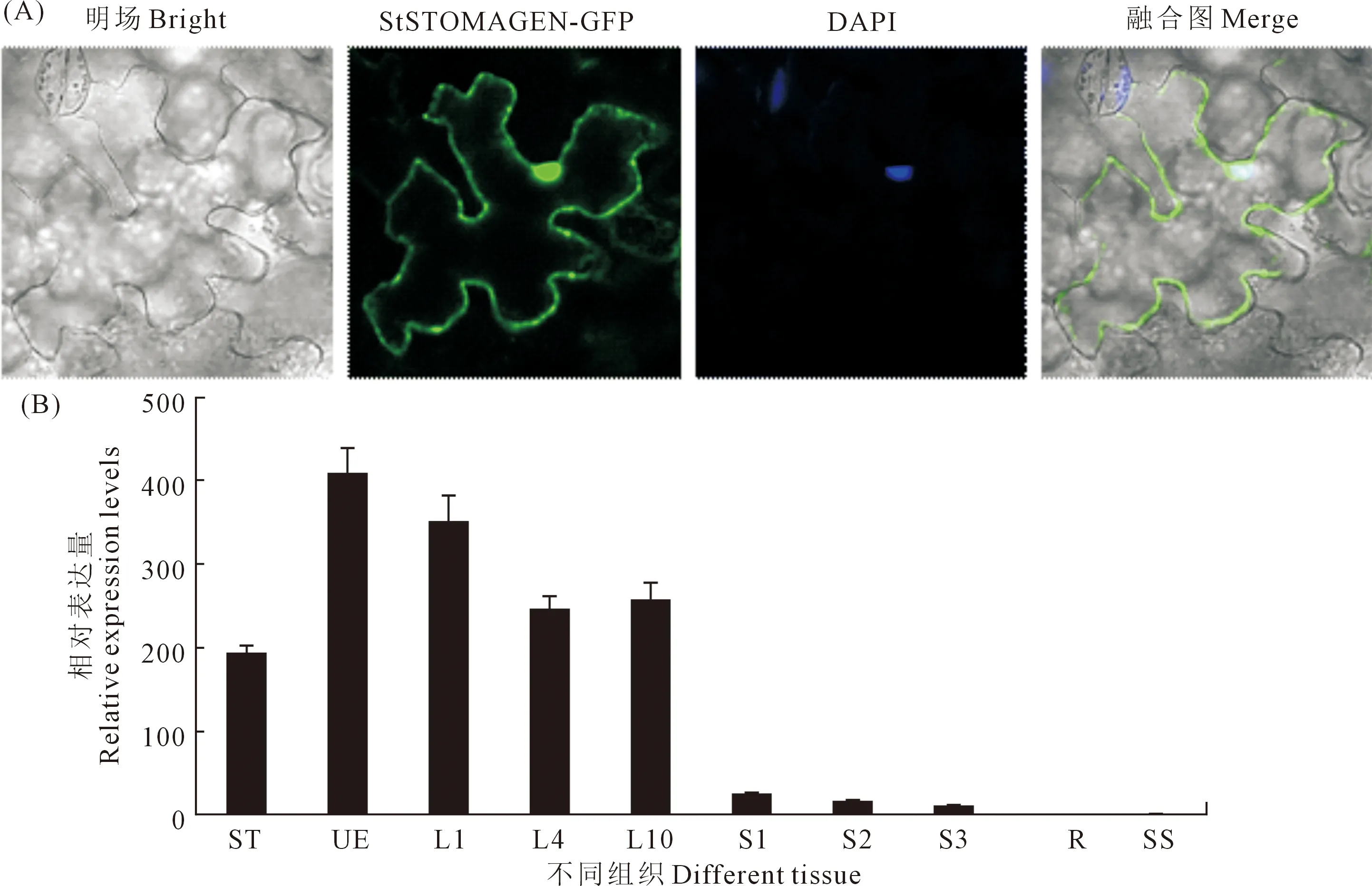
注:(A)StEPF1-GFP融合蛋白亞細胞定位,比例尺為50μm;(B)StESTOMAGEN基因在不同組織的表達分析,包括:ST,莖尖;UE,頂端未展開葉;L1,第一葉;L4,第四葉;L10,第10葉;S1,第1~3莖段;S2,第4~6莖段;S3,第7~9莖段;R,根;SS,塊莖;用Stef1α作為內參基因。Note: (A)Subcellular localization of the StSTOMAGEN-GFP fusion protein. Scale bars: 50 μm; (B) Expression analysis of the StSOMAGEN gene in various tissues of 2-month-old potato plants including stem tip (ST); apical unexpanded leaf (UE); 1st, 4th, and 10th leaf (L) from the top; 1st~3rd, 4th~6th, and 7th~9th stem internode (S); root (R); and storage tuber (SS), Stef1α was used as an internal control for data normalization.圖2 馬鈴薯StSTOMAGEN基因及蛋白質的表達特征Fig.2 Molecular characterization of the StSTOMAGEN gene and the corresponding protein in potato
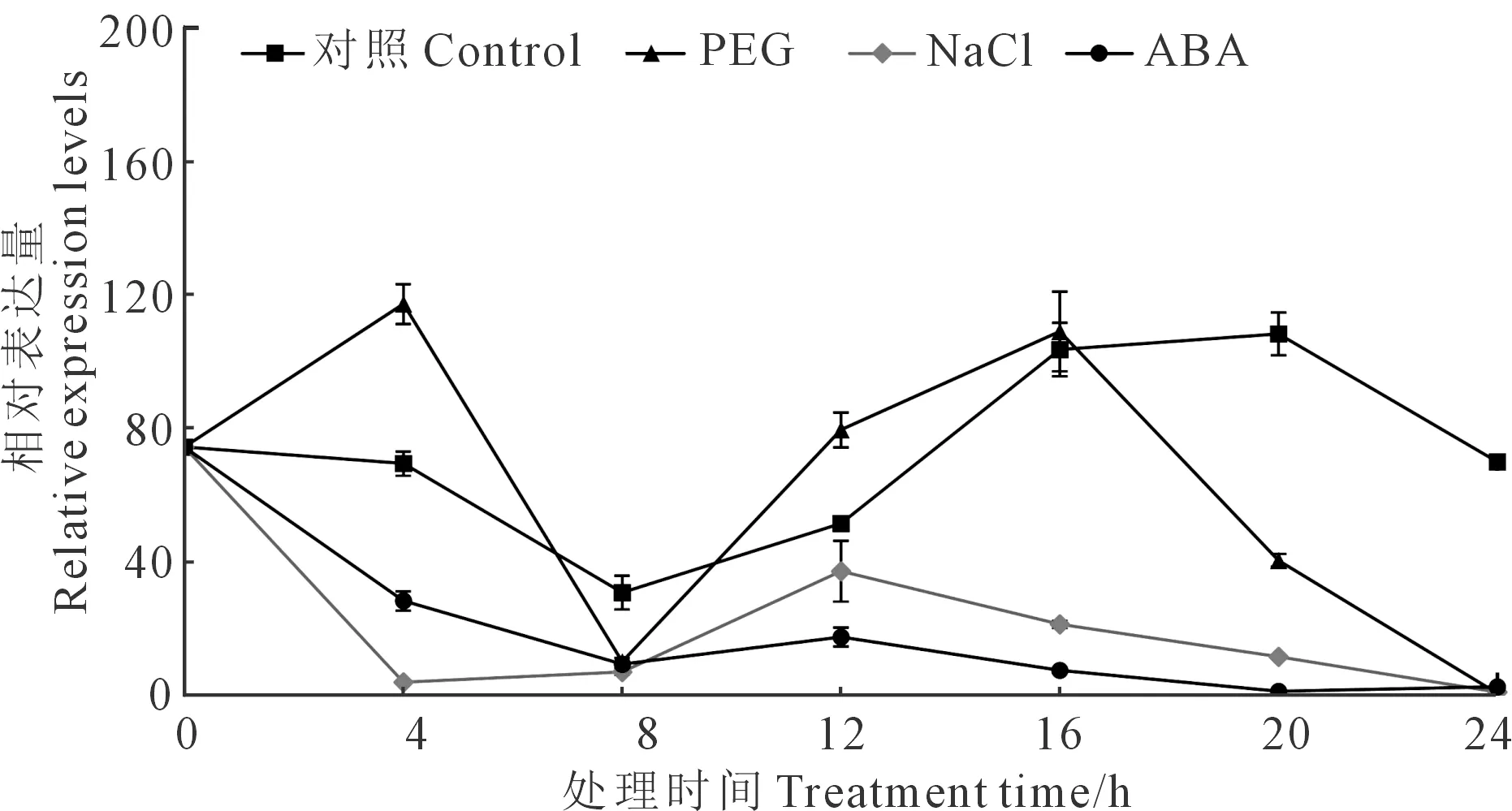
注:對照,正常生長條件;PEG,5%的聚乙二醇(PEG6000)溶液;NaCl,100 mMNaCl溶液;ABA,50 μm 脫落酸溶液,用Stef1α作為內參基因。Note: Control, normal growth condition; PEG, 5% polyethylene glycol (PEG6000); NaCl, 100 mM sodium chloride; ABA, 50 μM abscisic acid, Stef1α was used as an internal control for data normalization.圖3 StSTOMAGEN基因在多種逆境下的表達情況Fig.3 Temporal expression analysis of the StSTOMAGEN genein mature leaves of potato plants under abiotic stress conditions
2.4 StSTOMAGEN轉基因擬南芥光響應曲線測定
由圖6A可知,當光照強度低于250 μmol·m-2·s-1時,3個株系擬南芥的凈光合速率(Pn)隨光強呈線性增加且轉基因系顯著高于WT;當光合有效輻射達到300 μmol·m-2·s-1及以上時,Pn保持平緩增加,當光照強度高于800 μmol·m-2·s-1時,轉基因系和WT擬南芥的Pn都保持平緩,說明Pn已經達到最大值。此外,在不同光照條件下,轉基因擬南芥的氣孔導度(gs)都顯著高于野生型。以上結果表明,氣孔密度對光合作用的光響應產生顯著影響,隨著氣孔密度增大,植物的光合能力隨之增強。
2.5 過表達StSTOMAGEN基因提高擬南芥對干旱的敏感性
對獲得的StSTOMAGEN轉基因擬南芥進行干旱處理,7 d后,轉基因擬南芥表現出大量萎蔫死亡,而WT生長狀態較好(圖7A)。干旱處理后,ST
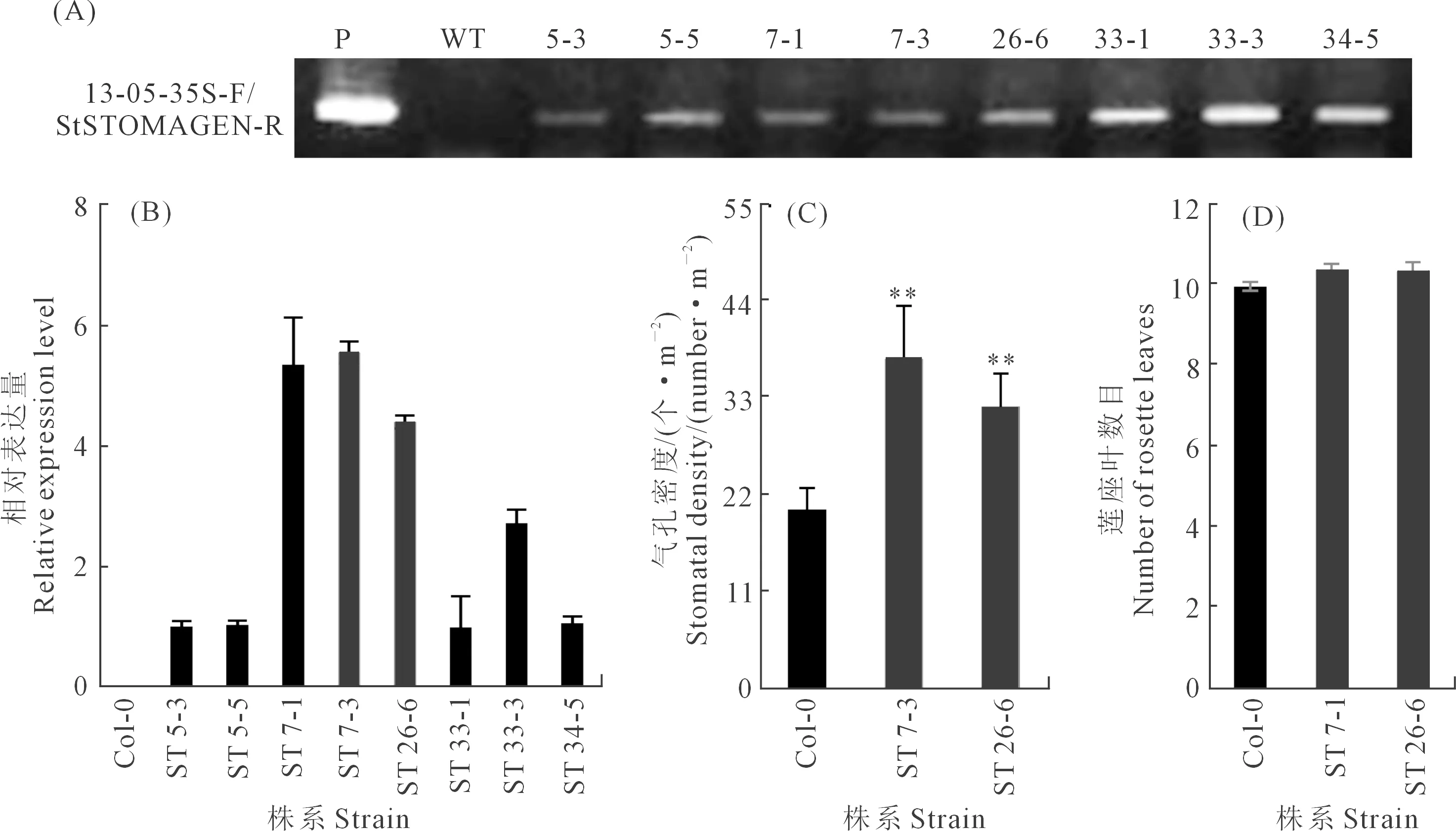
注:*,P<0.05; **, P<0.01; Duncan顯著性檢驗。下同。Note: *,P<0.05; **, P<0.01; Duncan significance test. The same below.圖4 轉基因擬南芥的鑒定及氣孔密度分析Fig.4 Identification and stomatal density analysis of transgenic Arabidopsis

注:(A)WT與ST轉基因擬南芥株系的表型觀察;(B)WT與ST轉基因擬南芥株系的氣孔密度觀察。Note: (A) Phenotype of wild-type (WT; Col-0) and StSTOMAGEN overexpression (ST) lines after 1 month of growth in pots. (B) Photos of mature abaxial leaf epidermis of 30-day-old WT and ST plants. Scale bars: 40 μm.圖5 過表達StSTOMAGEN基因擬南芥的表型分析Fig.5 Phenotypic analysis of transgenic Arabidopsis plants overexpressing StSTOMAGEN
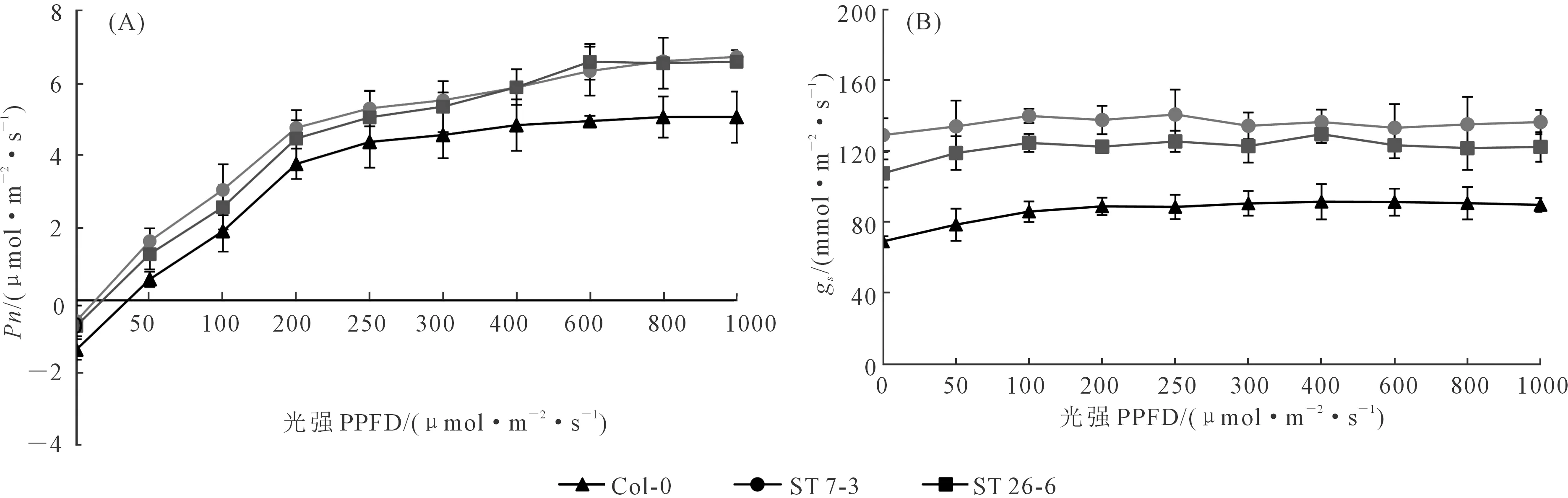
圖6 不同光照強度下WT和ST擬南芥成熟葉片的光響應曲線(A)和氣孔導度響應曲線(B)Fig.6 Photosynthetic response (A) and stomatal conductance (B) curres of mature leavesof WT and ST plants under different light intensities
植株的地上部生物量、RWC、Fv/Fm、Pn、gs和iWUE都顯著降低(圖7B-G)。復水處理2天后,WT植株的存活率顯著高于ST(圖7A)。此外,ST植株的水分散失速率也顯著高于WT植株(圖8A)。葉片經過1 h的水分散失后,通過DAB染色發現,ST株系葉片的H2O2含量也顯著高于于WT(圖8B和C)。以上結果表明,StSTOMAGEN在擬南芥中過量表達會降低擬南芥的抗旱性。
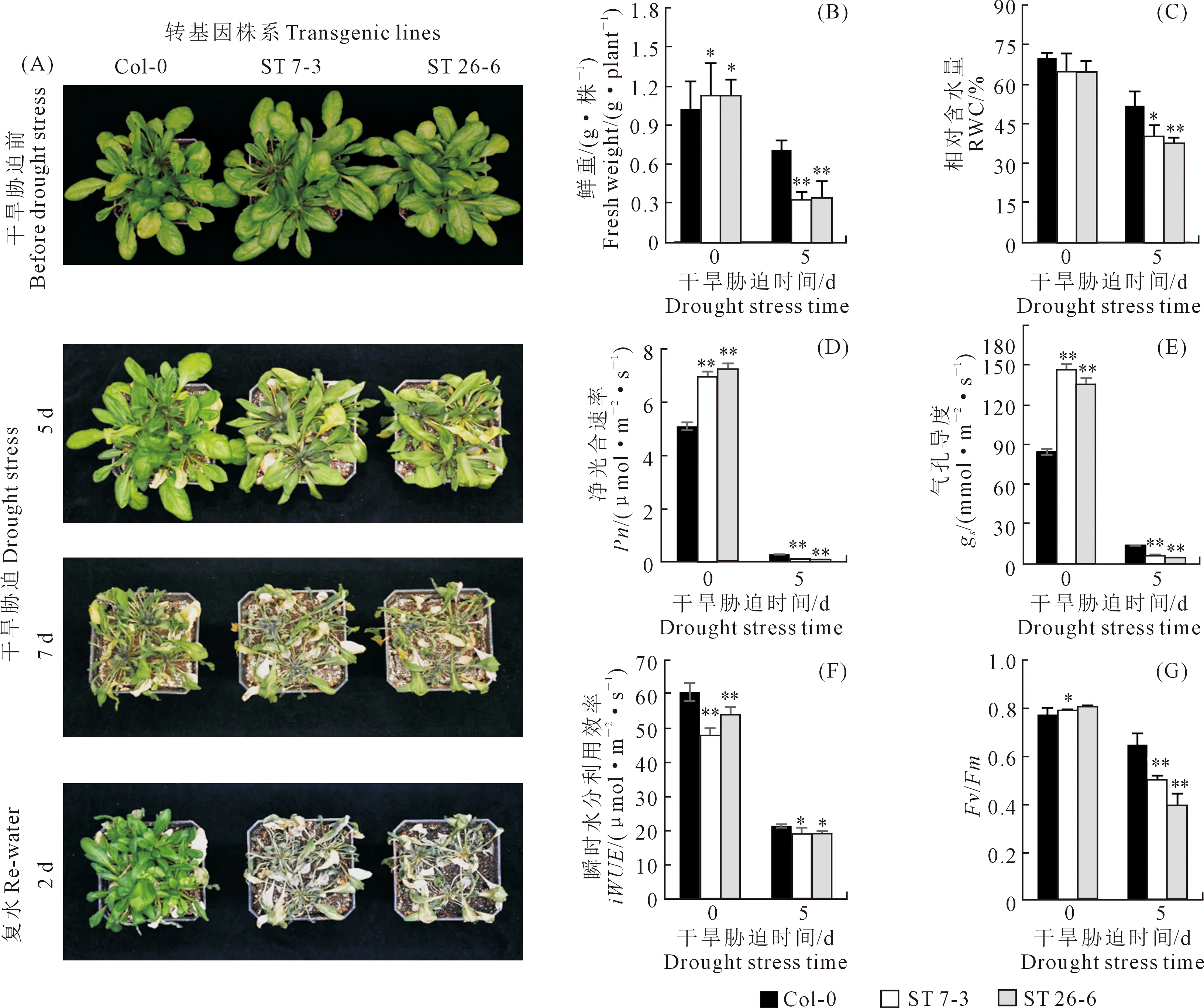
注:*:P<0.05,**:P<0.01,Duncan顯著性檢驗。Note: *P< 0.05, **P< 0.01 by Duncan significance test.圖7 干旱處理對WT和ST擬南芥生長的影響Fig.7 Influence of drought stress on WT and ST plants
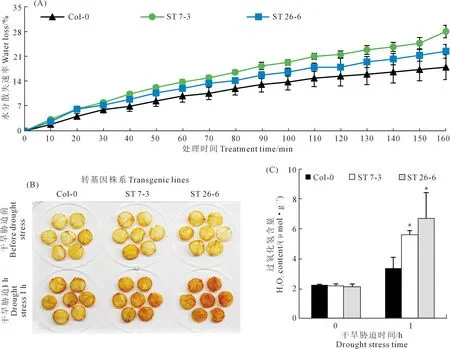
圖8 WT與ST擬南芥植株的水分散失(A)和過氧化氫含量(B、C)Fig.8 Water loss (A) and hydrogen peroxide content (B,C) of WT and ST Arabidopsis plants
3 討 論
全球氣候的不斷變化使植物的生長受到了嚴峻的威脅[16]。為了應對復雜多變的陸生環境,植物進化出了氣孔,它是連接植物光合系統和大氣環境的通道[17]。氣孔的發育過程涉及信號轉導、細胞命運轉化、細胞不對稱分裂等重要的發育調控事件[18]。前人研究表明,在擬南芥中過表達氣孔密度表皮模式因子AtSTOMAGEN會增大擬南芥的氣孔密度,同時植物的光合能力也顯著提高[12,19]。本研究從馬鈴薯中克隆得到StSTOMAGEN基因,并對其在調控氣孔發育和調節擬南芥抗旱性中的作用進行研究。
AtSTOMAGEN是擬南芥表皮模式因子(EPIDERMAL PATTERNING FACTOR,EPF)家族的成員,是目前發現的唯一一個正調控氣孔密度的表皮模式因子[19]。前人研究表明,AtSTOMAGEN主要是通過競爭性代替表皮模式因子2(EPIDERMAL PATTERNING FACTOR 2,EPF2)與ER受體結合,抑制后者引起下游MAPK組分磷酸化,從而促進氣孔發育[20]。在本研究中,我們發現StSTOMAGEN主要定位于細胞間隙和細胞核,其表達模式具有組織特異性,主要在嫩葉中表達,這與氣孔主要分布在莖、葉等器官表皮的現象一致[21]。光合組織可能是通過其調節表皮氣孔密度,優化CO2的吸收,提高光合效率[12]。此外,通過與AtSTOMAGEN的氨基酸序列比對發現,StSTOMAGEN在N端含有信號肽序列,C段含有相對保守的6個半胱氨酸殘基。過表達StSTOMAGEN基因的擬南芥氣孔密度顯著增大,這與AtSTOMAGEN在調控擬南芥氣孔密度中的作用一致[18],說明StSTOMAGEN在進化過程中功能保守。
光響應曲線是以光合產量或相對電子傳遞速率為一軸,而以PPFD或PAR為另一軸作圖得到,可以測量葉片適應不同水平光照的能力以及葉片的最大凈光合速率[22]。前人通過研究擬南芥syp121氣孔開度突變體發現,盡管突變體的氣孔開度降低,但是只有在高光條件下植株的CO2同化速率和氣孔導度才會降低[23]。在本試驗中,我們通過測定ST和WT擬南芥的光響應曲線發現,氣孔密度對光合速率具有積極作用,3個株系的光合作用隨著光強的增加呈上升趨勢且ST擬南芥的光合速率顯著高于WT,但是氣孔導度隨光照變化不明顯。這與之前的報道是一致的,由干旱脅迫造成的氣孔導度降低僅在高光強下影響植物的光合作用[24]。
干旱脅迫會使植物的生長受到抑制、光合速率降低,體內積累大量活性氧,甚至導致植物死亡[25]。為了研究StSTOMAGEN在植物響應干旱脅迫中的作用,我們對轉基因擬南芥進行干旱處理并觀察表型,結果顯示,干旱處理7 d后,轉基因擬南芥大量萎蔫甚至死亡,而野生型狀態較好。進一步分析顯示,干旱處理后,轉基因擬南芥的地上部生物量、相對含水量、瞬時水分利用效率、二氧化碳同化速率、氣孔導度、蒸騰速率都顯著降低,說明在擬南芥中過表達StSTOMAGEN會降低植株對干旱脅迫的抗性。同時,利用擬南芥葉片測定水分散失速率,發現轉基因擬南芥的水分散失速率顯著高于野生型,表明轉基因系通過提高葉片失水速率增強了對干旱脅迫的敏感性。綜上,轉基因植株在干旱條件下生長受到抑制可能與組織水分狀況有關[26],因為ST株系葉片氣孔密度增大,會造成更多水分散失,從而使植物在受到嚴重脅迫的情況下,葉片水勢迅速降低,因此在干旱脅迫下,轉基因株系無法保存葉片內的可用水分,從而表現出明顯的枯黃萎蔫表型。
4 結 論
本研究對StSTOMAGEN進行干旱脅迫分析發現,該基因能被PEG誘導表達;將該基因轉化擬南芥,轉基因材料葉片中的氣孔數量顯著增多且光合速率顯著增強;對轉基因擬南芥和WT進行干旱脅迫處理,發現轉基因材料的抗旱性降低。上述結果表明,StSTOMAGEN是氣孔密度正調控因子,過表達StSTOMAGEN可提高擬南芥葉片的氣孔密度而降低擬南芥對干旱脅迫的耐受性。本研究初步揭示了StSTOMAGEN基因與氣孔密度和干旱應答的關系,為進一步深入探討其分子機制提供理論依據。

