人乳頭瘤病毒16型表位嵌合病毒樣顆粒的構建及免疫原性研究
郭 健,張 力,陳力源,李玉華,楊皓杰,田一凡,朱 潔, 劉 微
人乳頭瘤病毒(human papillomavirus,HPV)感染是誘發女性宮頸癌的主要原因。已知發現的HPV亞型達200多種,其中HPV16和18型屬于高危型中最易致癌型,超過70%的宮頸癌病變由此導致[1-3]。HPV疫苗是控制宮頸癌的有效手段之一。HPV的主要衣殼蛋白L1可以單獨表達并自組裝成病毒樣顆粒(virus-like particles,VLPs)。VLPs與天然病毒的結構高度相似,將其免疫機體后可刺激產生高滴度的中和抗體,目前,利用VLPs研制的HPV預防性疫苗已用于臨床。但是,此類疫苗誘導機體產生的細胞免疫應答較弱。HPV基因組的早期轉錄區(E區)編碼的E7蛋白是導致細胞發生惡性轉化的關鍵[4-5]。E749-57表位能誘導T淋巴細胞分化為細胞毒性T淋巴細胞(cytotoxicTMlymphocyte,CTL)[6]。本研究中將E749-57表位嵌合進L1后表達并組裝形成VLPs,可以同時激發較強體液和細胞免疫應答,可使VLPs疫苗兼具預防和治療雙重功能。
1 材料與方法
1.1動物、試劑與儀器 Balb/c小鼠購自吉林大學白求恩醫學院動物中心。293FT細胞由本實驗室保藏;BamHI、XhoI內切酶,pET28a質粒購自TaKaRa公司;大腸桿菌BL21(DE3)、DH5感受態細胞購自北京鼎國生物技術有限公司;PVDF膜、ECL化學發光試劑盒、HRP標記山羊抗鼠IgG購自碧云天公司;鼠抗HPV16 L1單克隆抗體購自英國Abcam公司;DMEM、1640培養基購自美國GIBCO公司;質粒pShell16與pcDNA3.1-Luc+由吉林大學艾滋病疫苗重點實驗室提供;Bright-GloTMLuciferase Assay system購自美國Promega公司;E749-57肽由上海生工公司合成;多因子流式分析試劑盒(LEGENDplexTMMouse Th1/Th2)購自美國BioLegend公司;其他試劑均為國產分析純。納米粒徑電位分析儀Zetasizer Nano ZS90(Malvern, 英國);透射電子顯微鏡H-7650(Hitachi, 日本);AKTA蛋白純化系統(GE, 美國);預裝鎳柱His Trap FF(GE-Healthcare, 美國);酶標儀(Bio-Rad, 美國);流式細胞儀C6(BD, 美國)。
1.2pET28a-16L1-E749-57重組質粒的構建 在蛋白質數據庫(Protein Data Bank, PDB)獲得HPV16 L1蛋白的高分辨率晶體結構作為模體,利用分子模擬軟件Discovery Studio(version 2.1)分別于BC、DE、EF和HI環形區通過同源建模分析L1最佳的E749-57表位嵌合位點。在預測的HPV16 L1基因序列(GenBank,序列號: KU721788.1) 最佳嵌合位點處插入E749-57基因序列,運用http ://www.jcat. de/對序列進行優化,獲得HPV16 L1-E749-57基因片段(上海捷瑞生物工程有限公司合成)。以合成的HPV16 L1-E749-57基因為模板進行PCR擴增。上游引物: 5′- CGCGGATCCATGCCGTCTGAAG-CGACC-3′, 下游引物: 5′-GGCG-AGCTCTTAG-TGATGGTGATGGTGATGAAA-TTTCGGTTT-AGCTTTCAG-3′。正確的擴增產物與pET28a載體雙酶切連接(BamHI和XhoI),構建pET28a-16L1-E749-57重組表達質粒。轉入大腸桿菌DH5,篩選陽性克隆并提取質粒進行測序。
1.3HPV16L1-E749-57蛋白的誘導表達及純化 將陽性克隆質粒轉入大腸桿菌BL21(DE3),接種于LB液體培養基中(含卡那霉素50 μg/mL),37 ℃、180 r/min震蕩培養。0.2 mmol/L的IPTG,16 ℃條件下誘導過夜。向收集的菌體沉淀中以1∶10加binding buffer,冰浴超聲15 min。分別收集上清和沉淀進行SDS-PAGE電泳,鑒定目的蛋白的表達及可溶性。將上清液經鎳柱HisTrap FF親和層析,以Elution buffer(20 mmmol/L NaH2PO3, 150 mmol/L NaCl, 300 mmol/L咪唑,pH=7.4)洗脫蛋白,SDS-PAGE電泳鑒定蛋白純化結果。
1.4Western blot 鑒定HPV16L1-E749-57重組蛋白
HPV16L1-E749-57蛋白經SDS-PAGE電泳分離后,利用半干轉法轉印到PVDF膜上,條件為20 V、30 min。轉印后的PVDF膜用5%脫脂奶粉室溫封閉1 h。分別用HPV16 L1單克隆抗體作為一抗(1∶3 000)、HRP標記山羊抗鼠IgG作為二抗(1∶10 000)與PVDF膜37 ℃孵育1 h,ECL發光顯色分析免疫印跡,檢測HPV16L1-E749-57蛋白表達是否正確。
1.5E749-57嵌合VLPs的組裝及純化 向純化的HPV16L1-E749-57蛋白中加入終濃度為10 mmol/L的DTT,4 ℃下充分作用2 h。用透析管透析72 h,待其自組裝為E749-57嵌合VLPs。于30%(w/w)蔗糖/PBS層上緩慢加入自組裝完畢的E749-57嵌合VLPs混合液,27 000 r/min 4 ℃離心3 h,取沉淀(小黃色圓斑樣物質)加1 mL PBS重懸。將重懸液緩慢沿管壁加入10 mL的29% CsCl溶液中,35 000 r/ min、4 ℃離心20 h后收集沉淀。
1.6E749-57嵌合VLPs的形態學表征
1.6.1粒徑分析 用0.22 μm 濾膜過濾嵌合VLPs樣品后,通過 Malvern Zetasizer Nano ZS90 納米粒徑電位分析儀檢測病毒樣顆粒的粒徑大小,Zetasizer Software軟件分析數據。
1.6.2電鏡觀察 將樣品滴于噴炭的銅網上,靜置5 min,再滴加2%磷鎢酸鉀染色,靜置5 min,自然半干固定。設定透射電鏡放大倍率為50 000倍,電壓80 kV,觀察樣品顆粒形態。
1.7E749-57嵌合VLPs的免疫原性的檢測
1.7.1假病毒的包裝與滴度檢測 將結構基因表達質粒pShell16與熒光蛋白報告質粒pcDNA3.1-Luc+共轉染1×107個293FT細胞,轉染比例為1∶4。37 ℃孵育6 h后更換新鮮的DMEM完全培養基,繼續培養40 h。收集細胞,加等體積裂解液,37 ℃繼續培養16 h后,加入NaCl溶液至終濃度0.85 mmol/L。將混合物冰浴20 min, 12 000 r/min、4 ℃離心收集上清,用0.45 μm濾器過濾后分裝,-80 ℃保存備用。將假病毒作10倍稀釋,6個梯度,每個稀釋度加4孔,每孔100 μL于96孔板中。將293FT細胞鋪于96孔板,每孔細胞數3×104個/100 μL,與假病毒稀釋液混勻。孵育72 h后,每孔取50 μL培養液,加等體積 Bright-GloTMLuciferase Assay試劑,作用5 min,酶標儀檢測熒光素酶活性值,以10倍空白對照組為cutoff值,采用Reed-Muench法計算假病毒滴度(CCID50)。
1.7.2免疫血清中和試驗 將24只Balb/c小鼠均分為3組,依次為E749-57嵌合VLPs組、野生型HPV16 VLPs組和PBS組,以Al(OH)3為佐劑。在第0、2、4周對小鼠進行腹腔注射免疫。在第0、1、2、3、4、6周尾靜脈采血,收集血清,-80 ℃保存備用。將293FT細胞鋪于96孔板,每孔細胞數3×104個/100 μL。將待測血清做4倍倍比稀釋(初始稀釋度為1∶20)。稀釋血清和假病毒(400 CCID50/50 μL)各60 μL混合,冰浴1 h后,取混合物100 μL加入細胞板中,孵育72 h,計算假病毒滴度(方法同1.7.1)。
1.7.3Th1和Th2型細胞因子檢測 二免后3周后,分離各組小鼠脾臟。將脾臟置于200目篩網上并浸泡淋巴細胞分離液,注射器活塞研磨。將細胞懸液移至15 mL離心管,緩慢加入1 mL預冷的1640培養液,2 000 r/min離心10 min。取淡白色淋巴細胞層,2 000 r/min離心5 min收集淋巴細胞,加5 mL預冷的紅細胞裂解液,混勻后室溫放置2 min,離心收集沉淀,加預冷的1640培養液重懸,離心收集細胞沉淀。用PBS清洗細胞2次,并調整細胞濃度為5×105個/100 μL。向細胞培養液內加E749-57肽5 μg/mL,37 ℃、5% CO2條件下刺激培養細胞24 h。按照流式多因子分析試劑盒說明書操作,流式細胞儀檢測Th1和Th2型細胞因子情況,利用BioLegend LEGENDplexTM軟件分析流式數據,得出所測細胞因子濃度值。
1.8統計分析 采用SPSS 22.0 對數據進行統計描述和分析。組間差異比較采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1HPV16 L1最佳E749-57嵌合位點預測 通過分子模擬軟件Discovery Studio(version 2.1)同源模擬后確定HPV16 L1的HI loop區355/356為最佳表位嵌合位點(圖1)。

A: The virtual structure of E749-57 chimeric L1 monomer; B: The virtual structure of E749-57 chimeric L1 pentamer圖1 最佳嵌合位點預測Fig.1 Prediction of the optimal chimeric site
2.2pET28a-16L1-E749-57重組質粒的構建 pET28a-16L1-E749-57重組質粒經PCR鑒定,得到目的基因條帶為1 400 bp,與預期結果一致(圖2)。將質粒進行核酸測序,結果顯示序列正確。
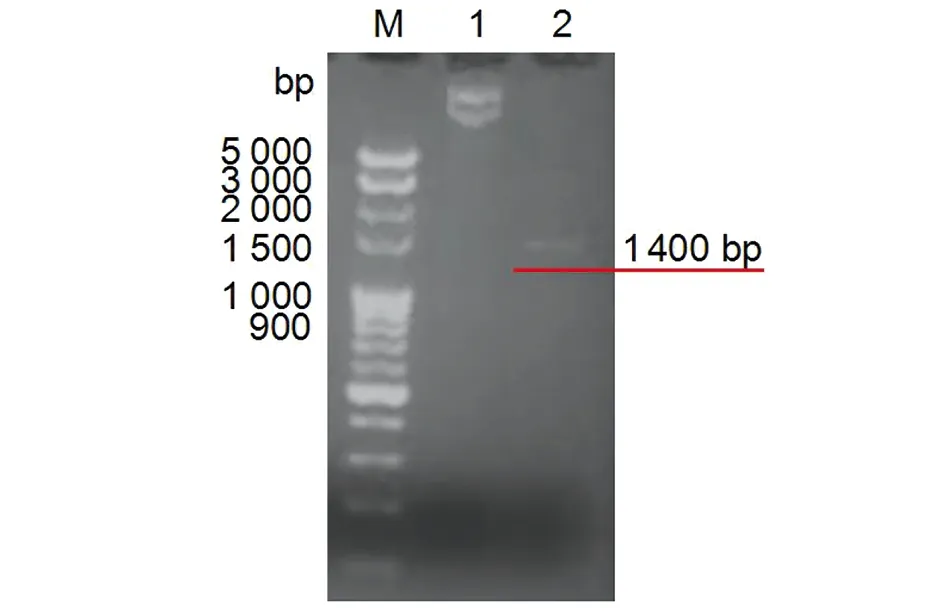
M: DNA Marker; 1: pET28a-16L1-E749-57 plasmid; 2: PCR product圖2 pET28a-16L1-E749-57重組質粒PCR鑒定Fig.2 Identification of recombinant plasmid pET28a-16L1-E749-57 by PCR
2.3HPV16L1-E749-57蛋白的誘導表達 重組菌經IPTG誘導后表達HPV16L1-E749-57蛋白。將誘導菌體的上清和沉淀分別用SDS-PAGE電泳鑒定。結果如圖3,誘導后在55 kD處可見特異性條帶,表明蛋白誘導表達成功。檢測誘導后超聲破碎菌體后的上清與沉淀中均含有目的蛋白,且在上清中濃度較高,初步判斷目的蛋白為可溶性蛋白(圖4)。
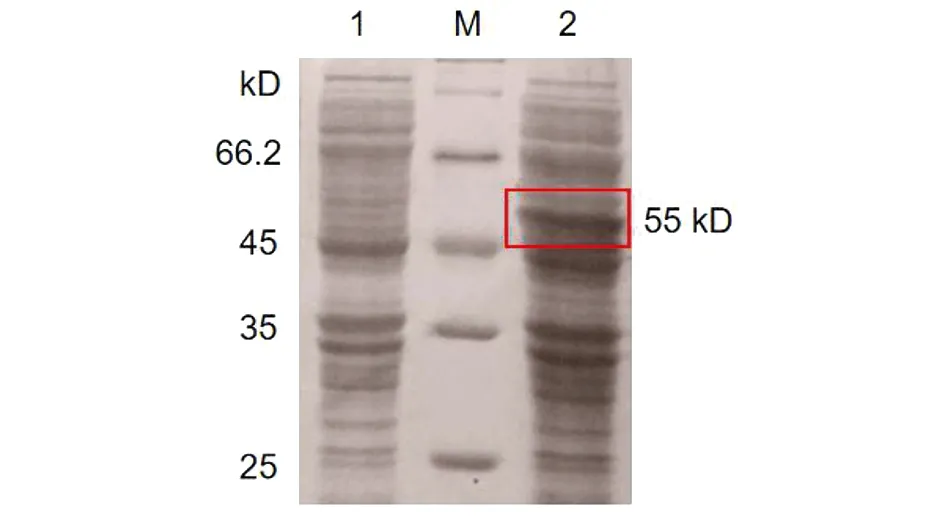
M: Protein marker; 1: Before induction; 2: After induction圖3 HPV16L1-E749-57蛋白表達的SDS-PAGE分析Fig.3 SDS-PAGE analysis of HPV16L1-E749-57 protein
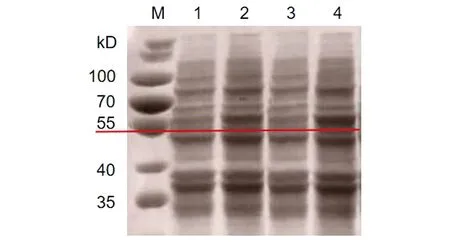
M: Protein marker; 1 and 3: Precipitation of broken bacteria; 2 and 4: Supernatant of broken bacteria圖4 HPV16L1-E749-57蛋白可溶性鑒定Fig.4 Identification about solubility of HPV16L1-E749-57 protein
2.4HPV16L1-E749-57蛋白的純化 收集重組菌誘導表達后的上清液,經鎳柱His Trap FF親和層析,收集洗脫流分。SDS-PAGE電泳(圖5),結果顯示經鎳柱純化后得到較高純度目的蛋白。蛋白免疫印跡(Western blot)(圖6)顯示在55 kD處出現目的斑帶,證明目的蛋白表達正確。
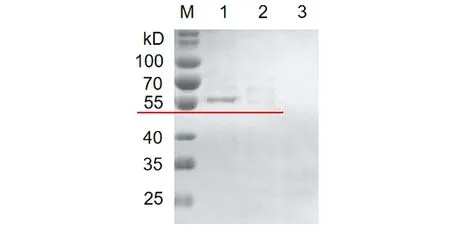
M: Protein marker; 1, 2, 3: 1 to 3 eluted fraction with 300 mmol/L imidazole圖5 HPV16L1-E749-57蛋白純化的SDS-PAGE分析Fig.5 SDS-PAGE analysis of HPV16L1-E749-57 protein
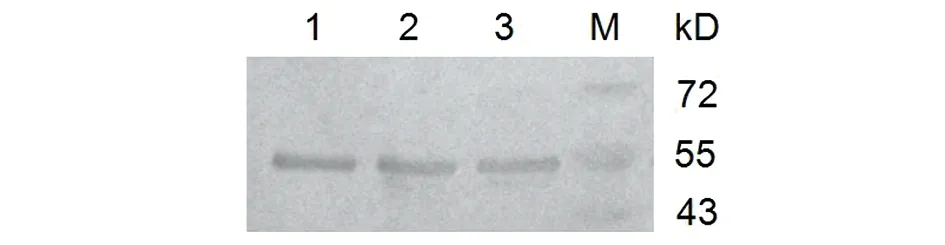
M: Protein marker; 1, 2, 3: HPV16L1-E749-57 protein圖6 HPV16L1-E749-57蛋白純化的Western blot分析Fig.6 Western blot analysis of HPV16L1-E749-57 protein
2.5E749-57嵌合VLPs的形態學表征 將體外組裝后的E749-57嵌合VLPs進行動態光散射粒徑分析和透射電鏡檢測,可觀察到大量形態結構、直徑(50~55 nm)與野生VLPs基本一致的球形顆粒,且粒徑均一(圖7,圖8),說明HPV16L1-E749-57蛋白在體外成功自組裝為VLPs。
2.6E749-57嵌合VLPs的免疫原性檢測

圖7 E749-57嵌合VLPs粒徑分析Fig.7 Size distributions of cVLPs-E749-57
2.6.1假病毒滴度及中和試驗 采用Reed-Muench法計算CCID50來表示假病毒滴度。結果顯示假病毒的滴度為105.9/100 μL。
以400 CCID50/50 μL假病毒接種量測陽性血清中和滴度。初次免疫后E749-57嵌合VLPs組小鼠血清中和抗體滴度log10平均值為2.63;隨著第2、3次免疫,中和抗體滴度明顯升高,第6周時log10平均值達到4.23。野生型HPV16 VLPs組小鼠在初次免疫后血清中和抗體滴度log10平均值為3.17, 加強免疫后,第6周時log10平均值達到4.45。E749-57嵌合VLPs組中和抗體滴度較野生型HPV16 VLPs組略低(χ2=7.575,P<0.05)(圖9)。

圖9 免疫血清中和試驗Fig.9 Neutralization test of serum samples
2.6.2Th1和Th2型細胞因子檢測 小鼠脾臟淋巴細胞經E749-57肽體外刺激后,用流式多因子法檢測Th細胞分泌細胞因子情況。結果如圖10所示,E749-57嵌合VLPs能刺激小鼠分泌高水平的 Th1型細胞因子(INF-γ, IL-2, TNF-α), 與野生型HPV16 VLPs相比具有明顯的統計學差異(χ2=7.410、4.333、8.308,P均<0.05),提示E749-57嵌合VLPs能刺激小鼠產生較強的細胞免疫應答。同時,E749-57嵌合VLPs刺激小鼠分泌的Th2型細胞因子水平與野生型HPV16 VLPs組相似(IL-5, IL-10),而野生型HPV16 VLPs組刺激小鼠分泌的IL- 4的含量更高一些。

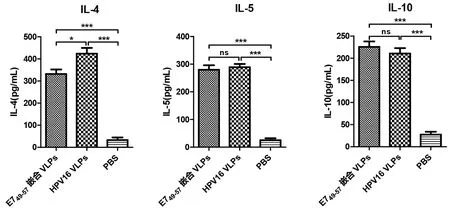
*P<0.05, **P<0.01, ***P<0.001圖10 Th1和Th2型細胞因子水平檢測Fig.10 Levels of Th1 and Th2 cytokines
3 討 論
宮頸癌是女性最常見的惡性腫瘤之一,發病率居女性惡性腫瘤第2位,且發病逐漸趨于年輕化[7-9]。據世衛組織報道,2018年全球宮頸癌新發病例57萬,死亡人數31.1萬[10], 嚴重危害女性健康。目前宮頸癌預防性疫苗的研究較成功,國際上市的HPV疫苗分別是默沙東公司生產的四價疫苗佳達修-4 (Gardasil-4)和九價疫苗佳達修-9(Gardasil-9),及葛蘭素史克公司的二價疫苗希瑞適(Cervarix),3種疫苗均是以體外表達的HPV L1衣殼蛋白自組裝成VLPs為有效抗原,混合佐劑誘導機體產生中和抗體。此類疫苗能有效預防高危型HPV病毒感染,但對已經感染HPV的人群無效[11-12]。
為了使疫苗具有治療功能,HPV E7基因成為近年來國際上的研究熱點[13-14]。E7蛋白作為高危型(HPV16、18、31、45)早期致癌蛋白,能干擾宿主細胞正常周期,誘導細胞無限增殖最終進展為癌癥[15-16]。E7蛋白在宮頸癌及癌前病變組織中持續表達,是腫瘤特異性抗原,因此成為免疫治療的理想靶標[17-18]。但全長E7蛋白仍有轉化活性,不能直接應用到疫苗中[19],而將優勢表位E749-57(短肽)作為抗原遞送至患者體內,既能保證疫苗安全,又能有效激活細胞免疫應答,特異性殺傷表達E7蛋白的腫瘤細胞,起到免疫治療作用[20]。國內外學者對此已展開研究: Liu WJ等[21]利用昆蟲細胞表達牛乳頭瘤病毒1型(bovine papillomavirus type 1, BPV1)L1嵌合E749-57蛋白(插入多個表位取代L1的C末端23個氨基酸); Monroy-García A等[22]利用番茄表達HPV16 L1嵌合E749-57蛋白(插入多個表位取代L1的C末端34個氨基酸),形成的嵌合VLPs均可刺激小鼠產生E749-57表位特異性CTL。褚曉杰[23]將E749-57表位與乙肝核核心抗原(HBcAg)嵌合,制備的HBcAg -VLPs能夠激發持續有效的特異細胞免疫應答并顯著抑制腫瘤生長。這些研究共同揭示了E749-57表位嵌合型VLPs成為治療性疫苗載體的潛力。
在本研究中,通過同源模擬分析HPV16 L1 環形區最佳嵌合位點。該方法利用生物信息學的手段,可以直接從蛋白的一級結構預測蛋白質的高級結構。所有的建模方法中,以同源建模法應用最為廣泛,預測結果的準確性最大[24-25]。我們以已知的天然HPV VLPs的結構為模體,預測表位嵌入后順利組裝成VLPs的可能結構,最終確定HI loop區355/356為最佳嵌入點。將優勢CTL表位E749-57嵌入該位點,形成的VLPs粒徑均一,形態飽滿,穩定性好,與野生型VLPs相似度高,這樣的結構對激發機體免疫應答極為重要。構建HPV16 L1- E749-57基因突變體后利用大腸桿菌進行表達,成本低廉,VLPs得率較高,這為疫苗的生產提供更大的可能性。
嵌合型VLPs免疫小鼠后,能激發小鼠體液免疫反應產生中和抗體,但是與野生組比較中和抗體滴度偏低;對細胞因子水平檢測則發現嵌合組的IL-4(Th2型)細胞因子水平也略低于野生組。此前報道顯示,HPV主要中和抗體HPV16.V5的中和表位位于HPV16 L1的FG 和HI loop區,將表位插入HI loop區(352/353)致使嵌合后的VLPs免疫原性與野生型相比下降[26]。我們推測,在L1- E749-57嵌合過程中(插入位點355/356)一定程度上破壞了L1原有的中和表位的完整性,影響到體液免疫應答發生。但是嵌合型VLPs可以刺激小鼠產生較強的細胞免疫應答,使VLPs能夠具備預防和治療雙重功效,這與我們的初衷是一致的。
人乳頭瘤病毒16型表位嵌合病毒樣顆粒(E749-57嵌合VLPs)的構建為宮頸癌治療性疫苗的探索和研制提供重要基礎,對于控制和治療宮頸癌、保障女性健康有著重要意義。
利益沖突:無

