HOXA-AS3通過調控HOXA6/7基因對人肺腺癌細胞增殖凋亡作用機制
張超 曲曉翰 韓立波
中國醫科大學附屬第一醫院(沈陽110001)
肺癌(lung cancer)是支氣管黏膜上皮細胞發生病變所導致的惡性腫瘤[1],既是最常見的惡性腫瘤,同時也較難治愈[2]。在中國,肺癌已經成為惡性腫瘤致死的最主要原因[3]。由于現代工業和經濟的不斷發展,在吸煙、可吸入顆粒物增加以及巨大社會心理壓力等的作用下,肺癌的發病率不斷上升[4]。盡管目前我國肺癌男性發病率高于女性,但近年來由于烹飪油煙等的危害,導致女性發病率也在逐年攀升[5]。按照不同的組織病理學特征及生物學行為,肺癌可分為腺癌、大細胞癌和鱗癌等類型[6-7]。其中,肺腺癌(lung adenocarcinoma)已經成為目前肺癌發病率較高,同樣也是較難治愈的一種類型。大部分肺腺癌在檢出時就處于中晚期[8],手術不能完全治愈,因此患者還需要輔助放化療等其他治療方法。但該病對放化療接受力較差,因此沒有特別有效的治療方法,導致肺腺癌的預后通常較差[9]。盡管許多學者對肺腺癌已經進行了大量的臨床實驗研究,但肺腺癌的發病機理仍不明確[10]。因此,尋找該病的發病原因,探究在該病的發生發展過程中細胞內基因和蛋白的表達關系,有望成為預防和治療肺腺癌的有效途徑,并對今后醫學領域中肺腺癌的研究起到重要促進作用[11-12]。近年研究[13-14]發現HOX 基因在哺乳動物中均有表達,其含有183 個核苷酸序列并具有嚴密保守性。大量研究[15-16]表明,HOX 基因在多種腫瘤中都有表達,并調節細胞的增殖與遷移并對DNA 合成和轉錄過程起關鍵的調控作用。位于染色體7p15-p14 上的HOXA6/7 所編碼的蛋白質能識別特定的DNA 序列進而調控腫瘤細胞的增殖與遷移[17-19]。因此,本文通過TUNEL 法、CCK-8 法、劃痕實驗、Western blot 法及RT-PCR 法分析單純人肺腺癌細胞株與HOXA-AS3 轉染的人肺腺癌細胞株之間細胞凋亡、增殖、遷移能力、HOXA6/7 蛋白表達及HOXA6/7 mRNA 表達的差異,研究HOXAAS3 通過調控HOXA6/7 基因對人肺腺癌細胞增殖凋亡的作用機制,為實現控制肺腺癌的發展與轉移提供臨床幫助。
1 材料與方法
1.1 細胞分組與培養將ATCC 細胞庫購買的人肺腺癌細胞株在含10%胎牛血清的DMEM 培養液中與孵育箱中(37 ℃,5%CO2)培養。細胞密度達到80% ~90%時,使用0.25%胰蛋白酶消化細胞。經800 r/min 離心5 min 后收集細胞并加入培養基中繼續培養,重懸細胞,按13 傳代。待細胞生長至80%左右,隨機分為2 組:第1 組為對照組(LA組,單純人肺腺癌細胞株),第2 組為實驗組(EX組,HOXA-AS3 轉染的人肺腺癌細胞株)。
1.2 實驗儀器與試劑臺式高速離心機(德國HETTICH);細胞培養瓶(美國Corning);酶標儀(美國Bio-Rad);熒光顯微鏡(日本Olympus);倒置相差顯微鏡(日本Olympus);PCR 電泳儀(濟南九宏公司);逆轉錄試劑盒(上海酶聯公司);恒溫搖床(成都蘇凈器材公司)等。
1.3 實驗方法
1.3.1 細胞轉染將HOXA-AS3 溶于49 μL 無血清培養基中混勻,溫育5 min。將肺腺癌細胞稀釋至2×105/mL,平鋪到24 孔板中。待肺腺癌細胞密度生長至70% ~80%時,將稀釋的肺腺癌細胞加入培養皿中轉染4 h 左右。隨后棄去上層液體,更換培養基,繼續培養48 h。
1.3.2 TUNEL 法檢測肺腺癌細胞凋亡情況將不同組份的細胞進行低溫低速離心(2 000 r/min,4 ℃)5 min 后,對貼壁細胞用0.25%不含乙二胺四乙酸的胰蛋白酶消化后再離心收集并按TUNEL 試劑盒說明書進行標記染色。每張切片隨機選取視野,使用顯微鏡(SP×400)觀察每個視野的細胞凋亡數量。
1.3.3 CCK-8 法檢測肺腺癌細胞增殖情況配置濃度為5 × 105/mL 的細胞懸液,分別接種于96 孔板中(100 μL/孔),放入孵育箱中于37 ℃培養24 h,隨后加入10 μL 的CCK-8 溶液繼續孵育4 h。使用酶標儀測定450 nm 處的吸光度(OD值)。
1.3.4 劃痕實驗檢測肺腺癌細胞遷移能力配置200 μL 濃度為5 × 105/mL 的細胞懸液,加入0.05%胰蛋白酶并置于不含血清的DMEM 培養基中。稀釋至5 × 102個/孔后接種于6 孔板中。等細胞附著于壁后,用20 μL 槍頭均勻刮劃,并使用PBS(pH 7.4)洗滌3 次。隨后在培養液中培養24 h,使用顯微鏡(SP × 100)記錄細胞運動的距離。
1.3.5 Western blot 法檢測肺腺癌細胞中HOXA6/7 蛋白表達配置200 μL 濃度為5 × 105/mL 的細胞懸液,加入0.25%胰蛋白酶后加RIPA裂解液,冰浴,離心,取上層液體。使用SDSPAGE 電泳分離后轉至PVDF 膜,加5%脫脂奶粉,密封1 h,用BCA 法檢測蛋白濃度。加入一抗GAPDH(1∶5 000)培育24 h,培育后取出并用PBS(pH 7.4)洗滌,隨后加入二抗(1∶12 000),在室溫、無光的條件下培育1 h。HOXA6/7 蛋白表達量使用QuantityOne 軟件進行分析。
1.3.6 RT-PCR 法檢測肺腺癌細胞中HOXA6/7 mRNA 表達在細胞中加入氯仿,經搖蕩、離心,使溶液呈乳白狀。隨后在4 ℃下12 000 r/min 離心并加入異丙醇。再次離心后加75%乙醇。最后離心、干燥并于-80 ℃保存。反轉錄體系使用表1的引物序列,設計為94 ℃處理10 min,94 ℃處理15 s,60 ℃處理34 s,72 ℃處理30 s 以及72 ℃處理10 min,重復40 次并計算HOXA6/7 mRNA 表達量。
PCR 反應結束后,配置2%瓊脂糖凝膠,避光放置1 h,然后依次向每孔中加入各個PCR 產物5 μL,在180 V 電壓下電泳,使溴酚藍與起始點完全分開后結束電泳,將凝膠放置在成像儀下觀察并采集凝膠電泳數據。
1.4 統計學方法使用SPSS 22.0 軟件分析LA組、EX 組之間肺腺癌細胞凋亡、增殖、遷移能力、HOXA6/7 蛋白表達及HOXA6/7 mRNA 表達的差異,P<0.05 為差異有統計學意義。
2 結果
2.1 TUNEL 法檢測肺腺癌細胞凋亡情況經TUNEL 染色,LA 組肺腺癌細胞凋亡較多、分布明顯稀疏,EX 組肺腺癌細胞凋亡數量較少、細胞凋亡率明顯下降(P<0.05)。見圖1。

表1 引物序列Tab.1 Primer sequence
2.2 CCK-8 法檢測肺腺癌細胞增殖情況組間比較表明LA 組和EX 組之間的OD值差異有統計學意義,EX 組肺腺癌細胞的增殖數量較多,LA 組肺腺癌細胞的增殖數量較少,EX 組肺腺癌細胞的增殖明顯高于LA 組(P<0.05),見圖2。
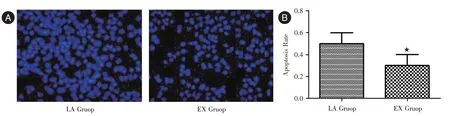
圖1 兩組肺腺癌細胞凋亡情況(SP,×400)Fig.1 Apoptosis of lung adenocarcinoma cells in two groups(SP,×400)
2.3 劃痕實驗檢測肺腺癌細胞遷移能力細胞遷移實驗檢測肺腺癌細胞水平運動遷移能力的結果如圖3所示,各組劃痕24 h 后,LA 組肺腺癌細胞穿過Trangwell 小室的細胞數為(137.8 ±17.5),顯示較寬無細胞區域,EX 組肺腺癌細胞穿過Trangwell 小室的細胞數為(39.2 ± 14.3),顯示較窄無細胞區域,差異有統計學意義(P<0.05)。
2.4 Western blot 法檢測肺腺癌細胞中HOXA6/7蛋白表達使用Western blot 法對LA 組、EX 組肺腺癌細胞內HOXA6/7 蛋白的免疫印跡檢測表明,LA 組的HOXA6/7 蛋白表達含量較低而EX 組的HOXA6/7 蛋白含量明顯升高(均P<0.05),見圖4。HOXA6/7 的蛋白表達水平與腫瘤T 分期(P=0.028)、腫瘤臨床分級(P= 0.029)及淋巴結轉移(P= 0.012)均呈正相關,且肺腺癌細胞內的HOXA6/7 表達明顯高于正常值時。
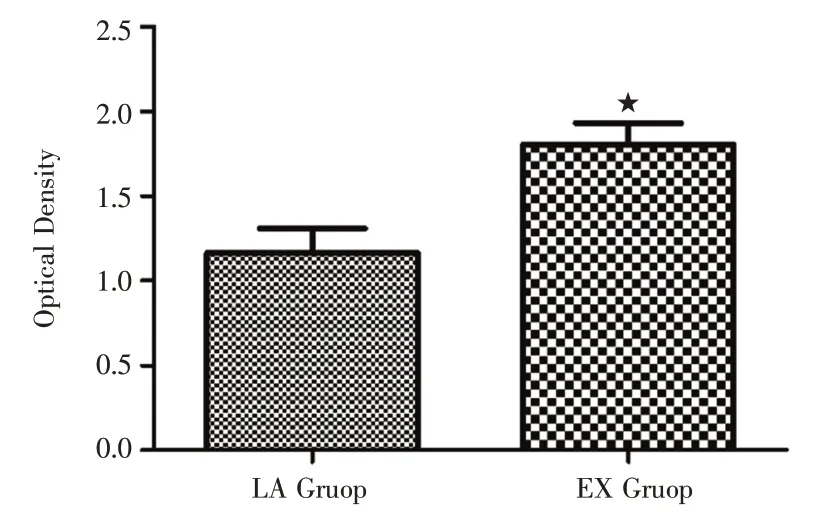
圖2 兩組肺腺癌細胞增殖情況Fig.2 Proliferation of lung adenocarcinoma cells in two groups
2.5 RT-PCR 法檢測肺腺癌細胞中HOXA6/7 mRNA 表達RT-PCR 法檢測肺腺癌細胞中HOXA6/7 mRNA 表達量的結果表明,LA 組肺腺癌細胞內的HOXA6/7 mRNA 表達量較低,EX 組肺腺癌細胞內的HOXA6/7 mRNA 表達量明顯升高(均P<0.05),見圖5。HOXA6/7 蛋白主要在細胞核內表達且在癌組織中的表達明顯高于癌旁正常肺組織,表明HOXA6/7 在肺腺癌組織中的異常高表達狀態可能與腫瘤進展密切相關,可參與肺腺癌發生、發展的調節。

圖3 兩組肺腺癌細胞的遷移能力(SP,×100)Fig.3 Migration ability of two groups of lung adenocarcinoma cells(SP,×100)
3 討論
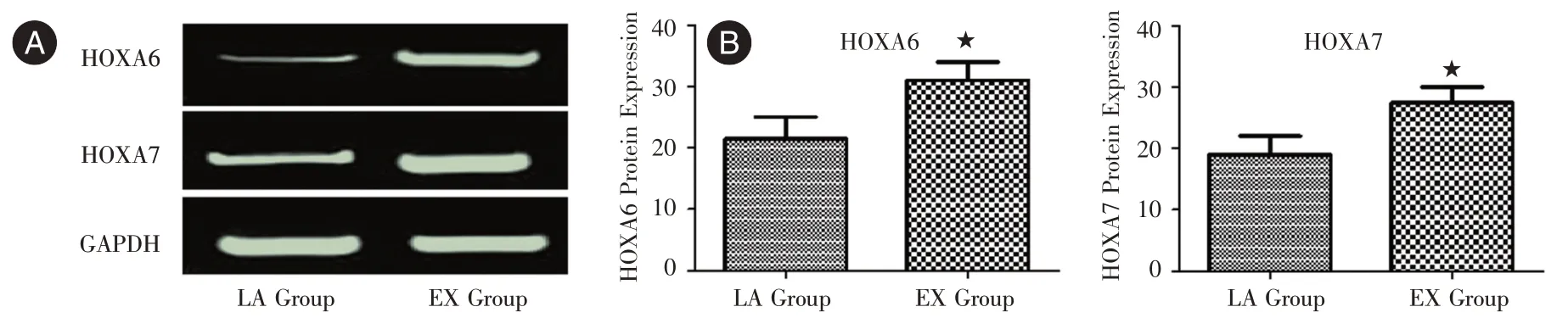
圖4 兩組肺腺癌細胞內的HOXA6/7 蛋白表達Fig.4 Expression of HOXA6/7 protein of lung adenocarcinoma cells in two groups
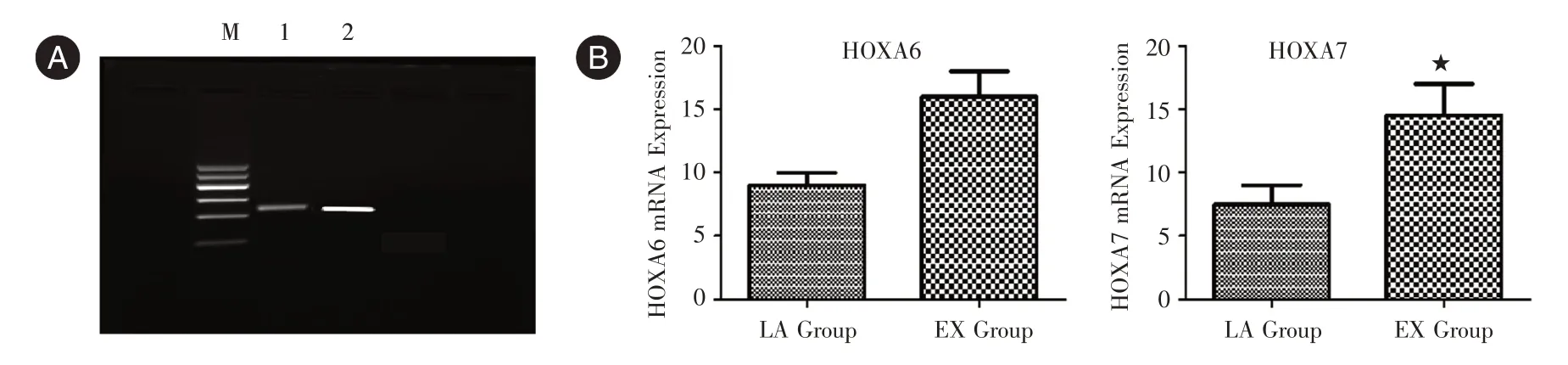
圖5 兩組肺腺癌細胞內的HOXA6/7 mRNA 表達Fig.5 Expression of HOXA6/7 mRNA of lung adenocarcinoma cells in two groups
HOX 基因家族在胚胎發育以及癌癥的發生發展中起到了至關重要的作用[20],作為一種嵌入HOX 基因簇的長鏈非編碼RNA,越來越多的研究表明HOXA-AS3 可能與多種腫瘤的進展相關。WU 等[21]通過高通量測序篩選出HOXA-AS3 在神經膠質瘤組織中的表達量顯著上調,并探討了其對膠質瘤細胞生物行為學功能的影響從而開啟了HOXA-AS3 在實體腫瘤中的研究序幕。很快,有學者證實HOXA-AS3 參與了肝細胞癌[22]、胰腺癌[23]、口腔癌[24]的發生發展。在非小細胞肺癌領域,有研究表明HOXA-AS3 在腫瘤組織及細胞系中的轉錄水平顯著高于癌旁組織及正常支氣管上皮細胞,但其對非小細胞肺癌細胞的調控及具體機制尚不明確。
本研究通過TUNEL 實驗、CCK-8 實驗、劃痕實驗證實上調HOXA-AS3 可顯著抑制肺腺癌細胞凋亡并促進其增殖與遷移能力。作為非編碼RNA 中的一種反義轉錄本,HOXA-AS3 可通過與相鄰基因的mRNA 形成雙鏈RNA 進而保護相鄰基因mRNA 免受核糖核酸酶的降解,增強其穩定性[25-26]。前期有研究表明在腫瘤組織中HOXA-AS3的表達與其臨近編碼基因HOXA6/7 mRNA 表達水平呈顯著正相關。筆者在肺腺癌細胞中上調HOXA-AS3,發現HOXA6/7 基因的轉錄及蛋白表達水平隨之升高。這些結果表明HOXA-AS3 對肺腺癌細胞生物行為學的影響是通過調控HOXA6/7來實現的。但HOXA-AS3 對HOXA6/7 的調控機制目前尚未完全闡明,是否也是基于與HOXA6/7 mRNA 形成雙鏈并增強其穩定性,這些將是筆者下一步研究的重點。
綜上所述,本研究表明lncRNA HOXA-AS3 可以通過調節HOXA6/7 進而促進肺腺癌細胞的惡性生物學行為。對其分子機制的深入研究可能給我們提供了一個治療肺腺癌的潛在靶點,進而為控制肺腺癌的發展與轉移提供臨床幫助。

