艱難梭菌芽孢形成與萌發的研究進展
趙寶鑫, 強翠欣, 趙建宏
艱難梭菌是一種可形成芽孢、產生毒素的革蘭陽性桿菌,是引起醫院感染的重要致病菌之一[1]。艱難梭菌生長繁殖需要嚴格的厭氧環境,芽孢是感染和傳播的重要形式。在艱難梭菌感染患者的腸道內,芽孢萌發成為繁殖體,后者產生毒素,引起腹瀉或偽膜性腸炎等疾病。同時,繁殖體形成難被清除的芽孢,導致感染復發,芽孢也可能播散到環境中[2]。艱難梭菌的芽孢形成、萌發過程和芽孢結構等的研究進展緩慢,其過程與芽孢桿菌屬和梭菌屬細菌差異顯著,本文就艱難梭菌芽孢研究成果作一綜述。
1 艱難梭菌芽孢形成
艱難梭菌芽孢由內膜、芽孢壁、皮質、外膜等多層結構包被,且細胞質高度脫水濃縮,對各種不利條件的抵抗能力增強,利于其在體內外環境中傳播。艱難梭菌芽孢形成過程包括4個階段:①不對稱分裂,形成前芽孢和母細胞;②母細胞裹吞前芽孢;③芽孢皮質、芽孢殼及芽孢外衣包繞前芽孢;④母細胞裂解,釋放成熟芽孢[3]。
1.1 艱難梭菌芽孢形成的起始信號轉導
艱難梭菌芽孢形成的引發信號及分子機制尚未完全闡明。基于Higgins等[4]對枯草芽孢桿菌(Bacillus subtilis)的研究推斷,艱難梭菌芽孢形成與營養不足或群體感應等環境壓力密切相關。Spo0A蛋白是芽孢形成信號向下游傳遞的關鍵分子,Spo0A被磷酸化激活后才可發揮其功能[5],見圖1。Narula等[6]發現,芽孢桿菌細胞膜上的組氨酸激酶通過Spo0F/Spo0B磷酸基轉移系統激活Spo0A。然而尚未在艱難梭菌中發現組氨酸激酶或磷酸基轉移系統的同源基因。Underwood等[7]在艱難梭菌630菌株基因組上鑒定了5個基因(CD1352、CD1492、CD1579、CD1949和CD2492)可編碼孤兒組氨酸激酶,并發現通過ClosTron敲除CD2492基因的艱難梭菌突變株產芽孢能力明顯降低,推測其可能參與Spo0A激活。研究還發現CD1579可自磷酸化,并將磷酸基直接轉移到Spo0A。Childress等[8]指出,CD1492是艱難梭菌芽孢形成的負調節子。研究發現codY和sinR基因缺失可抑制芽孢形成,并推測Spo0A激活過程受到抑制[9-10]。這些研究結果提示,艱難梭菌存在不同于其他細菌的Spo0A激活系統。不同研究發現亮氨酸反應調節蛋白和RstA蛋白可分別抑制或促進芽孢形成[11-12],但具體機制是否涉及Spo0A的激活過程還有待研究。
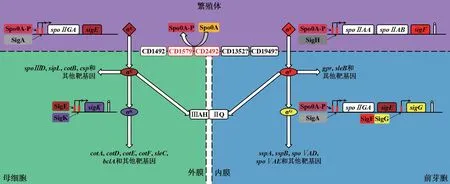
圖1 艱難梭菌芽孢形成過程中的信號通路
1.2 RNA聚合酶σ因子的區域性激活
激活的Spo0A-P可促進RNA聚合酶σ因子(σE、σF、σG及σK)的表達,各σ因子進而識別特定的啟動子,調節相應基因表達,其中σE和σK在母細胞中發揮作用,σF和σG在前芽孢中行使功能[13-14],見圖1。各σ因子的級聯激活過程如下:①芽孢形成開始后,前芽孢中SigH和Spo0A-P與spoⅡAA–spoⅡAB–sigF操縱子上游的啟動子結合啟動轉錄[15]。Campbell等[16]發現枯草芽孢桿菌中,σF與抑制因子SpoⅡAB分離才能在早期的前芽孢中發揮作用。艱難梭菌中σF的活性如何調控,尚需實驗證明。②不對稱分裂完成后,SigA和Spo0A-P啟動spoⅡGA–sigE–sigG操縱子轉錄,后期SigF和SigG先后與sigG基因上游的啟動子結合,啟動sigG轉錄,裹吞完成后SigG活性的調節需SigE及母細胞與前芽孢之間的SpoⅢAH-SpoⅡQ通道參與[17-18]。sigG基因轉錄是如何被精細調節及其活性在不同階段受何種因素的影響,還有待深入研究。③母細胞中,SigA和Spo0A-P共同啟動spoⅡGA–sigE–sigG操縱子轉錄[19]。枯草芽孢桿菌中,pro-σE末端的肽段需要被SpoⅡGA蛋白酶切除才能激活。研究表明,艱難梭菌pro-SigE的激活并不需要SpoⅡGA參與,可能存在其他激活機制[20]。④sigK基因的轉錄前期由SigE啟動,后期依靠SigK的正反饋調節,并受到SpoⅢD的正向調控[21]。與枯草芽孢桿菌不同,艱難梭菌中SigK的表達與SigG無關,但可能受到SigF的影響[22]。綜上,艱難梭菌芽孢形成過程中,前芽孢與母細胞中σ因子的激活過程基本相互獨立,并不像枯草芽孢桿菌復雜。艱難梭菌各σ因子的級聯激活與不對稱分裂和裹吞等時間節點也無直接關聯[23]。
1.3 RNA聚合酶σ因子的功能
RNA測序和微陣列分析顯示[20,24-25],芽孢形成過程中200多種基因受到4種σ因子的調節:σF調控母細胞-前芽孢信息交流的spoⅡR、spoⅡQ及spoⅣB的轉錄,芽孢抵抗性相關蛋白主要依賴σG特異性調節,σE在前芽孢的裹吞、皮質及芽孢殼蛋白質的合成及芽孢成熟時所需的能量代謝方面發揮關鍵作用,σK影響芽孢殼及芽孢外衣的合成及組裝和成熟芽孢的釋放過程。綜合這些研究結果不難發現,與芽孢桿菌屬及梭菌屬細菌相比,艱難梭菌中的4種σ因子的功能和芽孢形成調控網絡獨樹一幟,反映了其作為一種腸道定植細菌為適應生存環境而進化出的特征。
2 艱難梭菌芽孢結構
2.1 艱難梭菌芽孢的基本結構與其抵抗性
艱難梭菌芽孢最內層是芽胞核心,包含基因組DNA、各種RNA、蛋白質和核糖體[26]。Redondo-Solano等[27]發現,核心含有大量的吡啶二羧酸鈣(CaDPA)和α/β型小酸溶性蛋白質(SASP),含水量較低。這些特點使芽孢對各種刺激,如基因毒性藥物、干燥劑、干熱及濕熱、紫外線及γ射線等,具有較強的抵抗性。核心外層是與繁殖體細胞膜具有相似磷脂組成的內膜,內膜對小分子物質的通透性較低,內膜外層是含肽聚糖的芽胞壁、由特殊的肽聚糖組成的較厚的皮質層以及來源于母細胞的外膜[28]。最外層為芽孢殼及芽孢外衣,是艱難梭菌芽孢研究熱點。
研究發現,盡管艱難梭菌和枯草芽孢桿菌芽孢殼結構相似,均為層狀結構的蛋白質[29],但后者編碼芽孢殼蛋白的基因僅有25%與艱難梭菌同源[30]。艱難梭菌芽孢最外層呈毛發樣突起,蛋白質組成的芽孢外衣[31]。透射電鏡研究發現,艱難梭菌芽孢外衣與芽孢殼層緊密連接,但艱難梭菌630菌株芽孢外衣卻不存在發樣突起結構[32-33]。Permpoonpattana等[29]發現生物膜形成過程中形成的芽孢缺少芽孢外衣,說明芽孢外衣不穩定。然而也有研究指出芽孢外衣很穩定,只有經超聲和 /或蛋白酶處理才會丟失[34]。Pizarro-Guajardo等[35]綜合所有研究成果,認為芽孢外衣的穩定性或許與實驗采用的菌株及所用蛋白酶不同有關。
2.2 艱難梭菌芽孢殼的形成
艱難梭菌芽孢形成過程中,母細胞將前芽孢裹吞完成后,芽孢殼中各種蛋白質包繞于前芽孢外層,芽孢逐漸成熟,見表1。Pereira等[36]通過對芽孢桿菌的研究發現,SafA、SpoⅣA、SpoⅤM及SpoⅥD等十余種蛋白協助芽孢殼中各種蛋白質在前芽孢周圍的準確定位。但艱難梭菌中只存在SpoⅣA和SpoⅤM同源蛋白,且SpoⅤM存在與否對芽孢形成影響甚微[37],推測可能存在其他蛋白發揮類似作用。Touchette等[38]發現一種新的梭菌綱蛋白質SipL(SpoⅣA interacting protein L),通過羧基末端LysM結構域與SpoⅣA結合,是芽孢殼形成過程中必不可少的。隨著蛋白質組學技術的發展,芽孢殼中的其他蛋白質與SpoⅣA、SipL和SpoⅤM的相互作用,有待深入研究。
2.3 艱難梭菌芽孢殼和芽孢外衣中關鍵蛋白質的作用
研究發現,艱難梭菌芽孢殼和芽孢外衣中蛋白除了作為結構蛋白存在,還與芽孢的抵抗性及免疫原性相關。Ghose等[39]發現,膠原蛋白樣糖蛋白BclA1是艱難梭菌芽孢外衣的重要組成部分,但免疫原性較差,不足以誘發保護性免疫反應。Calderón-Romero等[40]通過電鏡觀察到編碼富含半胱氨酸的蛋白質基因cdeC缺失的艱難梭菌芽孢外衣缺少發樣突起的芽孢外衣結構,提示CdeC在芽孢殼和芽孢外衣間發揮錨蛋白作用。CotA、CotB、CotCB、CotD、CotE、CotF、CotG、CotL和SodA均作為艱難梭菌芽孢殼的結構蛋白而發揮重要作用[29,41]。另外一項蛋白質組學研究發現艱難梭菌630菌株芽孢外衣中的鐵氧化還原蛋白(CD0116、CD0117、CD0118)及黃素氧化還原蛋白(CD1474、CD1524、CD2845)可能賦予艱難梭菌芽孢對化學消毒劑的抵抗性[31],但還需實驗證實。見表1。
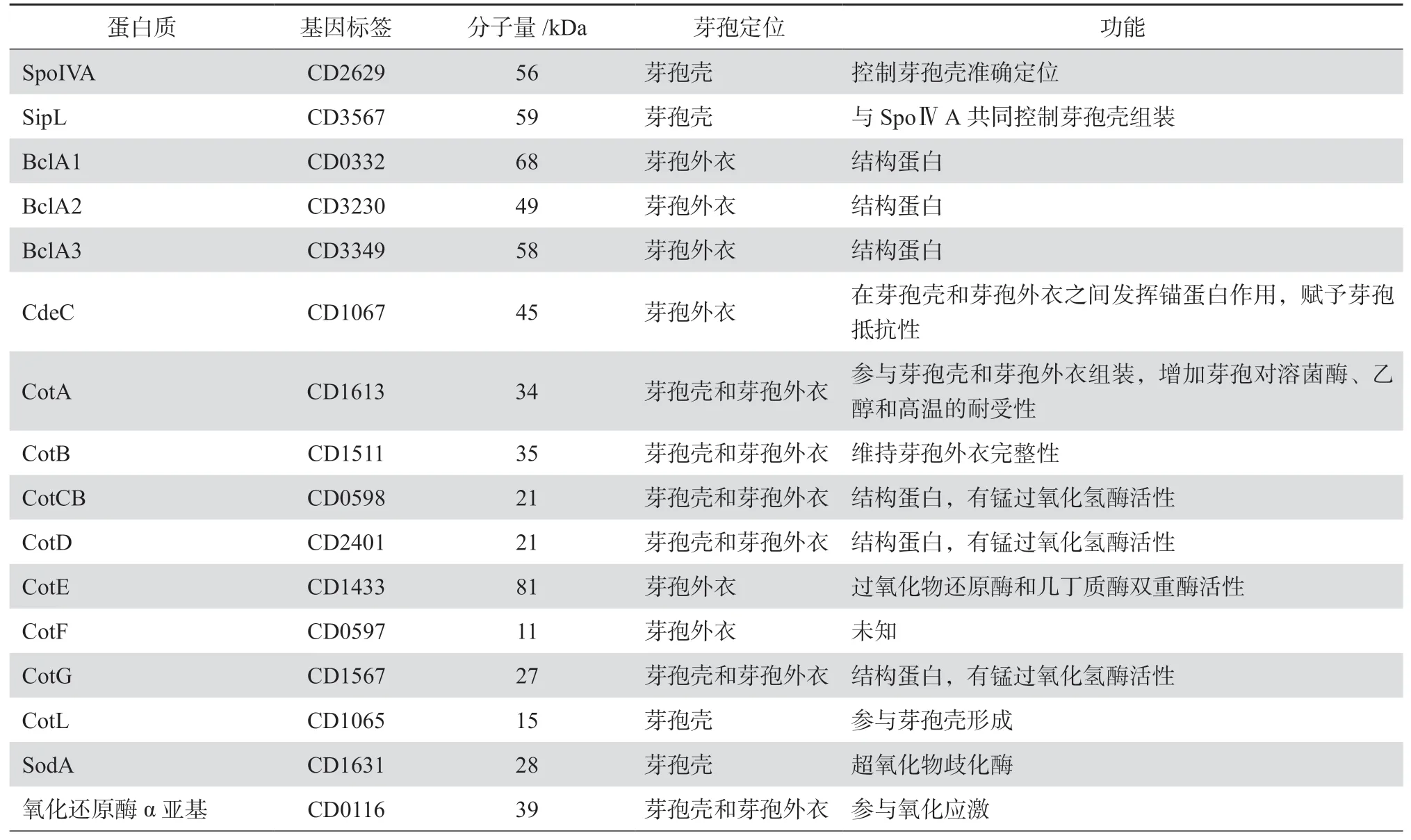
表1 艱難梭菌630菌株芽孢殼和芽孢外衣中的重要蛋白質
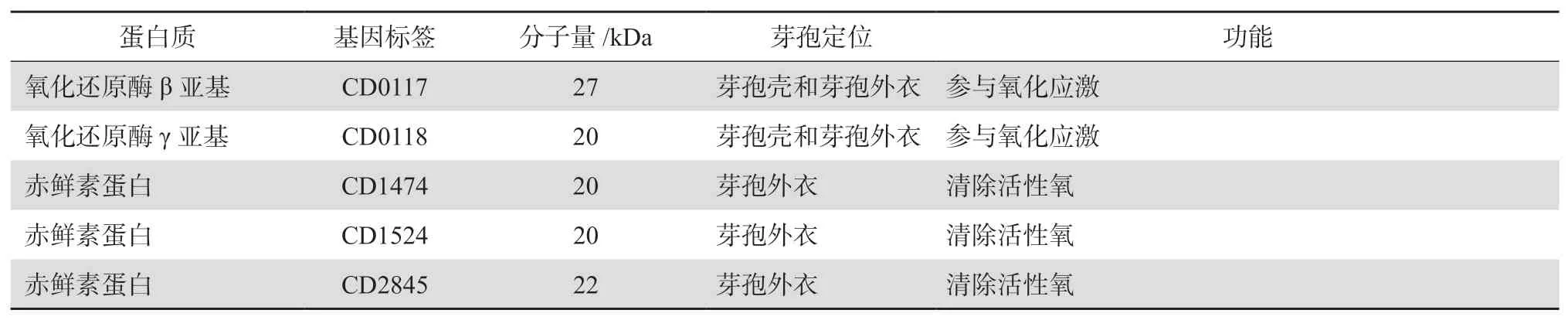
表1(續)
艱難梭菌芽孢可能通過多種相互作用黏附于腸黏膜細胞表面。芽孢表面(即芽孢殼和芽孢外衣)的疏水作用即是其中的一種[35]。不同研究表明,艱難梭菌繁殖體可與宿主小腸黏膜細胞外基質中的膠原蛋白Ⅰ、血小板反應蛋白、纖連蛋白及玻連蛋白結合,黏附于宿主細胞表面[42-43]。芽孢能否也可與上述蛋白結合,還有待研究。Mora-Uribe等[44]研究發現,艱難梭菌芽孢外衣的發樣突起與腸上皮細胞的頂端微絨毛之間存在相互作用,芽孢外衣可能參與芽孢與腸上皮細胞的特異性結合;去除芽孢外衣的芽孢比結構完整的芽孢能更有效地與Caco-2細胞結合,但結合可能是非特異性的。
盡管艱難梭菌芽孢結構研究取得初步進展,但芽孢外衣的組成成分、芽孢外衣在環境中的半衰期、芽孢外衣在芽孢與上皮細胞黏附方面的作用等眾多問題,還懸而未決。
3 艱難梭菌芽孢萌發
在適宜的環境中,艱難梭菌芽孢接受一系列信號刺激,可在數分鐘內失去皮質及芽孢殼等保護性外殼,恢復成為繁殖體。Setlow等[45]綜述,艱難梭菌芽孢必須萌發為繁殖體才可釋放毒素,引起腸壁細胞壞死,導致相應的臨床癥狀,見圖2。
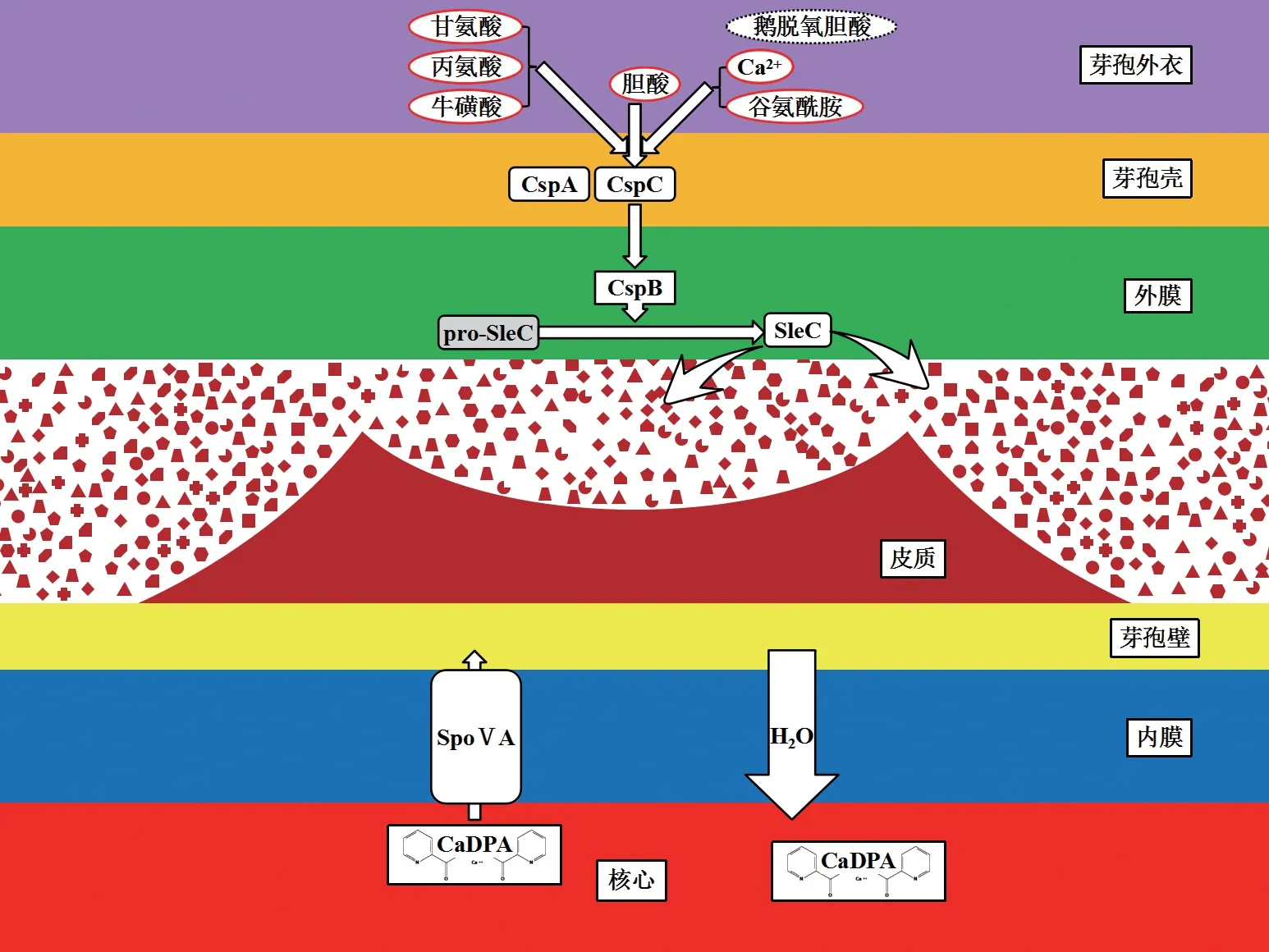
圖2 艱難梭菌芽孢萌發過程示意圖
3.1 艱難梭菌芽孢萌發信號
迄今,艱難梭菌是所有產芽孢細菌中唯一利用膽酸作為萌發劑的一個菌種,這也反映了艱難梭菌主要定植于哺乳動物腸道中并引起腸道疾病的一種適應策略[46]。膽酸和鵝脫氧膽酸(CDCA)是人體內的兩種主要初級膽酸,與牛磺酸或甘氨酸結合。分泌進入小腸的初級膽酸大部分經腸肝循環被肝臟重吸收用于食物消化,少部分進入大腸并在結腸內微生物組代謝生成的膽鹽水解酶作用下脫羥基變為次級膽酸,包括脫氧膽酸(DCA)、石膽酸(LCA)及熊脫氧膽酸(UDCA)等50余種,初級膽酸/次級膽酸平衡失調可促進腸道炎癥[47-48]。體內實驗[49]和體外研究[50]均證明,膽酸可有效促進艱難梭菌芽孢萌發,CDCA是艱難梭菌芽孢萌發的抑制劑。Thanissery等[51]系統分析了不同膽酸對艱難梭菌芽孢萌發的作用,結果表明CDCA、DCA及LCA及其衍生物對艱難梭菌芽孢萌發的影響十分顯著,但不同菌株的敏感性存在差異。在小鼠動物模型中發現,腸道內不同膽酸的平衡狀態影響艱難梭菌感染的進程,并且鑒定了一種可產生初級膽酸7α-脫羥酶的裂解梭菌,后者定植的小鼠對艱難梭菌感染的抵抗力增強,并且與腸道內的次級膽酸代謝相關[52]。
3.2 艱難梭菌芽孢萌發共激活劑
膽酸是艱難梭菌芽孢萌發的首要條件,但萌發還需要氨基酸作為共激活劑[53]。Shrestha等[54]發現,甘氨酸是艱難梭菌芽孢萌發最有效的共激活劑,原因可能是艱難梭菌芽孢壁肽聚糖層中四肽側鏈的第四位為甘氨酸,而其他細菌為丙氨酸。研究表明,L-丙氨酸、牛磺酸及L-谷氨酰胺等也可作為艱難梭菌芽孢萌發的共激活劑[53-55]。Kochan等[55]發現艱難梭菌芽孢在不含Ca2+的培養基中不能萌發,表明Ca2+是芽孢萌發過程中不可缺少的。由此推測:Ca2+可能和甘氨酸一起促進芽孢萌發,抑或Ca2+是萌發信號下游的輔助因子。后續研究發現在萌發關鍵分子CspB的晶體結構中沒有Ca2+,但Ca2+促進芽孢萌發的作用還有待深入研究[56]。Shrestha等[57]發現,鋱也是艱難梭菌芽孢萌發的影響因素,故在芽孢萌發監測實驗中應注意氯化鋱的使用量。
3.3 艱難梭菌芽孢萌發過程中的關鍵分子
研究表明,枯草芽孢桿菌、產氣莢膜梭菌、肉毒梭菌及生孢梭菌等利用芽孢內膜的Ger型萌發劑受體啟動芽孢萌發,但艱難梭菌不表達該受體[58]。艱難梭菌利用融合基因cspBA和cspC,編碼3種絲氨酸蛋白酶CspA、CspB和CspC。Kevorkian等[59]證實,CspA的催化結構域不完整,但可能控制CspC整合進入芽孢。艱難梭菌利用催化結構域同樣不完整的CspC作為膽酸受體,利用CspB蛋白酶向下游傳遞萌發信號,這在其他細菌中還未曾見到[60]。有趣的是,CspC點突變會改變艱難梭菌芽孢萌發劑的特異性,突變株的芽孢可在含有萌發抑制劑CDCA的培養基中萌發[61]。Shrestha等[62]發現CspA突變的艱難梭菌可在無共激活劑氨基酸的環境中萌發,推測CspA是共激活劑的受體。另有研究發現部分艱難梭菌芽孢在不含膽酸的培養基中也能萌發,表明可能存在其他或更加復雜的芽孢萌發機制[50]。
研究表明,CspB蛋白酶通過切除皮質水解酶pro-SleC氨基末端序列,激活SleC,后者將皮質降解,CaDPA從芽孢核心釋放[59,63],見圖2。SpoⅤA在芽孢形成及萌發過程中,作為運輸CaDPA的通道,調節芽孢核心內的滲透壓。Velásquez等[64]發現,芽孢皮質被SleC降解后,在滲透膨脹作用下,內膜上的SpoⅤA蛋白形成小孔,導致CaDPA從芽孢核心釋放。由此可見,艱難梭菌皮質降解先于CaDPA釋放,芽孢萌發過程以一種“從外到內”的方式進行。
4 結語
綜上所述,艱難梭菌芽孢形成及萌發的大致過程及信號通路逐漸清晰,但仍存在一些問題有待解決,如艱難梭菌如何及在什么時機開始形成芽孢,芽孢萌發特異性蛋白酶如何將膽酸信號處理及傳遞,還需要更多研究來解答。由于芽孢是艱難梭菌感染性疾病傳播和復發的關鍵形式,了解艱難梭菌芽胞形成、結構及萌發過程,不僅能充分理解艱難梭菌的生命周期,還可提供控制艱難梭菌感染的新靶點。

