不同濃度胰島素對原代大鼠脂肪細胞增殖分化的研究
雷世成,盧建雄
(1.蘭州職業技術學院,甘肅 蘭州 730070;2.西北民族大學 生命科學與工程學院,甘肅 蘭州 730030)
胰島素(insulin)是由生物體胰臟內的胰島細胞所分泌的一種對脂肪細胞具有調節作用的蛋白激素,同時能夠對蛋白、糖原、脂肪等生物大分子的合成具有促進作用。外源性胰島素主要在臨床上用于治療糖尿病。低濃度的胰島素它能促進脂類合成并且也有支持其他藥物的脂肪積聚作用[1]。胰島素是調節機體內環境的重要激素之一,在機體代謝中起重要作用。胰島素能調節能量平衡,調控脂肪細胞內基因轉錄、蛋白質合成和脂質代謝等,從而影響脂肪細胞的生長[1,2]。在一定濃度范圍內胰島素敏感性增加能夠正向加速脂肪細胞的分化過程[3,4]。根據 Flores 等[5]的定義,細胞分化(differentiation)是指同一來源的細胞逐漸產生形態結構、功能上有差異的細胞群體。脂肪細胞分化由脂肪母細胞、前體脂肪細胞、不成熟脂肪細胞到成熟脂肪細胞的過程[6]。但是目前在生物醫學研究領域對干細胞向脂肪細胞分化的機理還不太清楚,而對前體脂肪細胞向脂肪細胞分化機理的研究的比較深入。在體內脂肪細胞是在相關轉錄因子的調控作用下激活調控脂肪細胞的因子,經過一系列復雜的增殖分化機制轉化為成熟脂肪細胞[7]。
1 材料和方法
1.1 試驗動物
健康的3周齡SD雄性大鼠9只(健康,100 g左右,購自蘭大動物醫學中心)。該大鼠的采食量一般5 g(100 g體重24 h),溫度在18~26℃,相對濕度40%~70%,通風換氣6次/h。
1.2 試驗方法
斷頸處死SD大鼠并用75%的酒精消毒處理,在無菌狀態下取出附睪和腎臟周圍的脂肪組織,除掉毛細血管和其他結締組織,用含有雙抗的PBS沖洗2遍并剪碎。剪碎的脂肪組織塊中加入胰蛋白酶進行消化,消化50 min (每隔10 min振蕩1次),然后用孔徑為600目的不銹鋼過篩,1 000 r/min(半徑8 cm)離心10 min,棄上清液,然后用無血清培養液洗2遍,加入含有10%血清的DMEM/F12培養基吹打均勻,即可獲得脂肪細胞懸液,然后轉入到細胞培養瓶,放進CO2培養箱進行培養。
1.2.1 胰島素對大鼠脂肪細胞增殖活性檢測(MTT法) 培養的大鼠脂肪細胞密度為5×104/cm2時接種于96孔培養板當中,預設胰島素濃度分別為0 nmol/L、100 nmol/L、200 nmol/L、300 nmol/L、400 nmol/L、500 nmol/L,以0 nmol/L為對照組(不添加任何胰島素),每孔總容積為220μl。分別處理2 d、4 d、6 d和8 d進行MTT比色測定,記錄光吸收值(A)。
1.2.2 胰島素對油紅O染色提取檢測大鼠脂肪細胞分化程度 培養的大鼠脂肪細胞按5×104/cm2的密度接種于24孔培養板,按預設濃度加入胰島素稀釋液,每個濃度需設3個重復增加數據的準確率,每孔容積為4μl,每2 d換1次培養液,在第6 d將培養板從CO2培養箱中取出,倒掉其培養基,PBS沖洗2次,用10%的甲醛溶液固定1 h,PBS溶液沖洗3次,油紅O染液染色60 min,移除油紅O染液,再用PBS沖洗3次,100%異丙醇萃取油紅O染液,用酶聯檢測儀分析,記錄光吸收值(A)。
1.2.3 試驗設計與數據統計分析方法 試驗數據以平均數±標準差(x±s)表示,采用SPSS21統計軟件進行單因素方差分析與顯著性檢驗。實驗數據以平均值±SD表示。
2 結果與分析
2.1 胰島素對大鼠脂肪細胞生長活性的影響
在倒置顯微鏡下觀察培養3 d的脂肪細胞形狀和變化,正常培養的脂肪細胞第3 d呈梭形或不規則三角形(如圖1),添加低濃度胰島素培養3 d脂肪細胞已出現脂滴(如圖2),此時脂滴數量多而體積小,隨著時間的延長,以后脂滴會慢慢開始融合、分化的細胞也增多,細胞形態逐漸趨向于圓形或類圓形,從而獲得成熟脂肪細胞的形態特征。

圖1 培養3 d的脂肪細胞生長形態(200×)
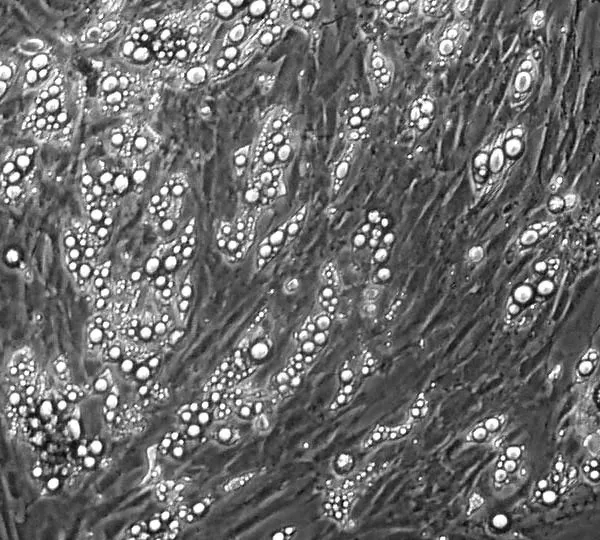
圖2 添加低濃度胰島素培養3 d脂肪細胞生長形態(200×)
2.2 胰島素對大鼠脂肪細胞增殖的影響(MTT法)
檢測培養的大鼠脂肪細胞密度為5×104/cm2時接種于96孔培養板當中,按預設添加不同濃度胰島素,每個濃度需設3個重復增加數據的準確率,以0 nmol/L為對照組(不添加任何胰島素),每孔總容積為220μl。分別處理2 d、4 d、6 d和8 d進行MTT比色測定,記錄光吸收值(A),結果如表1所示。
結果表明與對照組相比,胰島素濃度在100~400 nmol/L范圍時,胰島素促進大鼠脂肪細胞增殖差異顯著,胰島素濃度在300 mmol/L時大鼠脂肪細胞增殖能力最強。隨著胰島素濃度升高到500 nmol/L時,對脂肪細胞的增殖作用減弱,并且只在第4~6 d差異顯著,以后差異不顯著,這就驗證了中低濃度的胰島素能夠促進大鼠脂肪細胞的增殖。

表1 MTT檢測結果
2.3 胰島素對大鼠脂肪細胞分化的影響(油紅O染色)
在倒置顯微鏡下觀察培養5 d的脂肪細胞形狀和變化,正常培養的脂肪細胞第5 d呈梭形或不規則三角形慢慢地分化為少量的脂滴(如圖3),添加低濃度胰島素培養5 d脂肪細胞已出現大量的脂滴(如圖4),隨著時間的延長,以后脂滴會慢慢開始融合,細胞形態逐漸趨向于圓形或類圓形的大脂滴,從而獲得成熟脂肪細胞的形態和特征。

圖3 培養5 d的脂肪細胞油紅染色(200×)

圖4 添加低濃度胰島素培養5 d的脂肪細胞油紅染色(200×)
2.4 胰島素對油紅O染色提取檢測大鼠脂肪細胞的分化程度
檢測培養的大鼠脂肪細胞按5×104/cm2的密度接種于24孔培養板,按預設濃度加入胰島素稀釋液,以0 nmol/L為對照組(不添加任何胰島素),每個濃度需設3個重復增加數據的準確率,油紅O染液染色60 min,移除油紅O染液,再用PBS沖洗,然后用100%異丙醇萃取油紅O染液,用酶聯檢測儀分析,記錄光吸收值(A),結果如表2所示。

表2 油紅O染色檢測分化程度
試驗分析表明,與對照組相比,胰島素濃度在200~400 nmol/L時,大鼠脂肪細胞分化有顯著的促進作用;當胰島素濃度在500 nmol/L時脂肪細胞分化能力最強,這就說明高濃度的胰島素能促進大鼠脂肪細胞的分化。
3 結論
在脂肪細胞形成過程中,當胰島素的濃度在300~400 nmol/L脂肪細胞的增殖能力較強,500 nmol/L脂肪細胞的分化作用最強,這是因為胰島素通過與受體結合調節細胞內脂質生成與降解的酶有關。通過試驗分析說明中低濃度的胰島素可促進脂肪組織的合成,高濃度可誘發脂肪組織的分解。從而也證實了胰島素是重要的大鼠脂肪細胞增殖分化的蛋白激素。為進一步研究脂肪細胞增殖分化的相關轉錄因子碳水化合物反應元件結合蛋白(ChREBP)、固醇調節元件結合蛋白(SREBP-1c)和乙酰輔酶A脫羧酶(ACC)、脂肪酸合成酶(FAS)調控關系奠定基礎,為臨床上肥胖病和糖尿病發病機制的進一步研究和治療效果提供保障。

